© Borgis - Anestezjologia Intensywna Terapia 2/2003, s. 75-82
Grażyna Durek1, Andrzej Kübler1, Waldemar Goździk1, Wojciech Kustrzycki2, Zdzisław Falkiewicz1, Joanna Milczarska3
Diagnostyczne i prognostyczne znaczenie aktywności troponiny C u chorych po zabiegach rewaskularyzacji mięśnia sercowego wykonanych w krążeniu pozaustrojowym
Diagnostic and prognostic value of cardiac troponin C concentration in coronary artery bypass grafting
1 Katedra i Klinika Anestezjologii i Intensywnej Terapii;
Kierownik: prof. dr hab. A. Kübler
2 Katedra i Klinika Chirurgii Serca;
Kierownik: dr hab. W. Kustrzycki
3 Centralne Laboratorium Biochemiczne;
Kierownik: mgr J. Milczarska – AM we Wrocławiu
Streszczenie
Cel pracy. Istotne uszkodzenie mięśnia sercowego podczas zabiegu kardiochirurgicznego powoduje 10-krotny wzrost powikłań. Brak złotego klinicznego standardu diagnostycznego utrudnia rozpoznanie okołooperacyjnego niedokrwienia lub zawału mięśnia sercowego u chorych po zabiegach wieńcowych. Absolutna swoistość stężenia sercowej troponiny I (cTn I) stanowi o jej przydatności w ocenie ryzyka uszkodzenia mięśnia sercowego w przebiegu niestabilnej choroby wieńcowej lub zawału mięśnia sercowego. Celem pracy była ocena diagnostycznego i prognostycznego znaczenia cTn I u chorych po zabiegach rewaskularyzacji mięśnia sercowego wykonanych w krążeniu pozaustrojowym. Metodyka. Badaniami objęto 28 chorych po zabiegach wieńcowych, których losowo przydzielono do 2 grup; grupa I obejmowała 15 chorych, u których stosowano ciepłą krwistą kardioplegię, grupa II – 13 chorych, którym podawano zimną, krystaliczną kardiopleginę. Zabiegi w grupie I wykonano w normotermii, natomiast w grupie II – w umiarkowanej hipotermii. Oznaczano stężenia cTn I, kinazy kreatynowej (CPK) i jej izoenzymu (CKMB) oraz mioglobiny przed rozpoczęciem znieczulenia (T1), przed włączeniem krążenia pozaustrojowego (T2), 30 minut po wyłączeniu krążenia pozaustrojowego (T3) oraz w 4 (T4), w 8 (T5),w 12 (T6), w 24 (T7) i 48 (T8) godzin po zabiegu.
Wyniki. Stężenia badanych parametrów były istotnie wyż-sze u wszystkich chorych po wyłączeniu krążenia pozaustrojowego (T3), ale były niższe w grupie I: cTn I 10,57 vs 12,33 ng ml-1, CPK 235,73 vs 378,33 UI, CKMB 36,00 vs 58,11 UI, mioglobina 449,71 vs 713,80 ng ml-1. Wnioski. Stratyfikacja chorych w oparciu o stężenie cTn I <<40 ng ml-1 a> 60 ng ml-1 ma wysoką wartość rokowniczą w diagnostyce uszkodzenia mięśnia sercowego i zawału okołooperacyjnego. Seryjne wykonywanie badania stężenia cTn I pozwala na szybkie potwierdzenie lub wykluczenie pooperacyjnego uszkodzenia mięśnia sercowego będąc prognostycznym i diagnostycznym markerem u chorych po zabiegach kardiochirurgicznych.
Summary
Background. Significant myocardial injury during cardiac surgery has been associated with a 10-fold increase in the incidence of complications. Immediate recognition is difficult in the perioperative period, since there are no established diagnostic markers for acute ischemia and/or infarction during coronary bypass surgery. Troponin I, because of its peculiar cardiospecificity, can be regarded as a unique marker that may be particularly useful in assessing myocardial ischemia in these patients. The aim of the study was to assess the diagnostic and prognostic value of cardiac troponin I activity (cTn I) in patients after coronary artery bypass grafting (CABG). Methods. Twenty-eight patients, scheduled for coronary bypass surgery with extracorporeal circulation, were randomly divided into 2 groups. Group I consisted of 15 patients who received warm blood cardioplegia (normothermia), while group II consisted of 13 patients who received cold crystalloid cardioplegia (hypothermia). Arterial blood samples were obtained before induction of anaesthesia, immediately before and after cardiopulmonary bypass (CPB) and 4, 8, 12, and 24 hrs after surgery. Plasma concentrations of cTn I, CK, CKMB, and myoglobin were measured using sensitive enzyme-linked immunosorbent assays. Results. The transcardiac release of CK, CKMB, myoglobin and cTn I was evident in all patients after bypass but was lower in group I than in group II: cTnI 10.57 ng ml-1 vs 12.33 ng ml-1, CK 235 UI vs 378 UI; CKMB 36 UI vs 58 UI; and myoglobin 449 ng ml-1 vs 713 ng ml-1. Serum cTn I at 12 hrs after CPB was also lower in the normothermic group than in those receiving cold cardioplegia (40.26 ng ml-1 vs 50.06 ng ml-1). Conclusions. Stratification of patients by peak troponin values <40 and> 60 ng ml-1 was found to be highly predictive of cardiac events. Serial measurements of cTn I can therefore be used as a rapid and accurate method of diagnosis of myocardial injury as well as an independent prognostic marker in CABG patients.

Wstęp
Rozpoznanie okołooperacyjnego niedokrwienia lub zawału mięśnia serca u chorych poddanych zabiegom przęsłowania aortalno-wieńcowego jest niejednokrotnie bardzo trudne. Kliniczne objawy tego schorzenia, jak ból w klatce piersiowej, zaburzenia oddychania czy nudności lub poty mogą być spowodowane innymi przyczynami i pozostawać w powiązaniu z przeprowadzoną operacją lub znieczuleniem; także chory może nie być zdolny do odpowiedzialnego ich przedstawienia. Zmiany odcinka ST i załamka T, zwłaszcza w zawale mięśnia sercowego bez Q, mogą być spowodowane zaburzeniami elektrolitowymi, działaniem środków inotropowych lub pooperacyjnym zapaleniem osierdzia, jak również nieprawidłowym ułożeniem elektrod, co może prowadzić do błędnego rozpoznania. Serologiczne wskaźniki uszkodzenia mięśnia serca, jak aktywność kinazy fosfokreatyninowej (CPK) i jej izoenzymu (CK-MB) są użyteczne w rozpoznaniu ostrego zawału mięśnia sercowego (1, 2). Należy jednak pamiętać, że nie tylko mięsień sercowy jest źródłem CK-MB, mięsień szkieletowy zawiera również ten izoenzym. Wzrost CK-MB będzie obserwowany podczas uszkodzenia mięśni przez procedurę chirurgiczną. Kaniulacja, manipulacje sercem, kardioplegina, zapalenie mięśnia sercowego i osierdzia mogą prowadzić do wzrostu stężenia tego izoenzymu. Dlatego też zmiany stężenia CK-MB, zwłaszcza wobec niejasnych zmian w EKG nie pozwalają na pewne rozpoznanie okołooperacyjnego zawału. Najszybciej pojawiającym się markerem uszkodzenia mięśnia serca jest mioglobina, jednak z uwagi na jej zupełny brak swoistości w stosunku do tego mięśnia postuluje się łączenie jej oznaczania z pomiarem innego markera sercowego (3). Genesini, Adams i Sadony w tych przypadkach wskazują na decydujące znaczenie sercowej troponiny (cTn I) w okołooperacyjnej diagnostyce zawału mięśnia sercowego u chorych po zabiegach wieńcowych (4, 5, 6). Ponieważ troponina I charakteryzuje się absolutną swoistością w stosunku do mięśnia sercowego, nie jest obecna w mięśniach szkieletowych i nie stwierdza się podwyższenia jej stężenia u pacjentów z urazami klatki piersiowej, przewlekłą niewydolnością nerek oraz przewlekłymi chorobami i urazami mięśni, stanowi wiarygodny wskaźnik niedokrwienia mięśnia serca kiedy inne wskaźniki są niejasne, zwłaszcza w rozpoznaniu zawału mięśnia sercowego typu „bez Q” w okresie pooperacyjnym (7, 8). Pozwala również na rozpoznanie niewielkiego uszkodzenia mięśnia sercowego ( Minor Myocardial Injury – MMI), które może się dokonać przy znacznym niedokrwieniu w niestabilnej chorobie wieńcowej (9). Oznaczenie aktywności cTn I u chorych poddanych zabiegom wieńcowym z użyciem krążenia pozaustrojowego pozwoli również na ocenę skuteczności stosowanych metod protekcji mięśnia sercowego, a także uszkodzeń spowodowanych defibrylacją, co może przyczynić się do minimalizacji zmian ischemicznych i związanych z tym powikłań, mając istotne znaczenie praktyczne. W oparciu o doniesienia Arensena i Nygarda potwierdzające związek homocysteiny z chorobami układu krążenia, a także wykazujące zależność pomiędzy umieralnością pacjentów z angiograficznie rozpoznaną chorobą wieńcową a jej wysokimi stężeniami, obserwacje rozszerzono o badanie stężenia homocysteiny – niezależnego czynnika choroby wieńcowej, chorób naczyń mózgowych i chorób zatorowo-zakrzepowych układu żylnego (10, 11, 12).
Dobór chorych i metody
Badaniami objęto 28 chorych (4 kobiety i 24 mężczyzn) leczonych w Klinice Chirurgii Serca we Wrocławiu, u których wykonano zabiegi na naczyniach wieńcowych z użyciem krążenia pozaustrojowego. Chorych losowo przydzielono do 2 grup badanych: w grupie I liczącej 15 chorych operowanych w normotermii (temp. 36,5-37,0°C) do protekcji mięśnia sercowego stosowano ciepłą krwistą kardioplegię (ck); grupa II liczyła 13 chorych operowanych w umiarkowanej hipotermii (28,0-32,0°C) z zastosowaniem zimnej krystalicznej kardiopleginy (zk). U wszystkich chorych wykonano pomiary stężenia troponiny I (cTn I), CPK, CK-MB i mioglobiny przed rozpoczęciem znieczulenia (T1), przed włączeniem krążenia pozaustrojowego (T2), 30 minut po zdjęciu zacisku aorty (T3) oraz w 4 (T4), 8 (T5), 12 (T6), 24 (T7) i 48 godzin (T8) po zabiegu. Zmiany zachowania się stężenia tych wskaźników porównywano z zapisem EKG. Dodatkowo u wszystkich chorych przed operacją określono stężenie homocysteiny – niezależnego czynnika ryzyka w chorobach układu krążenia. Ponieważ stężenie homocysteiny w osoczu daje wysoką przewidywalność umieralności chorych z angiograficznie rozpoznaną chorobą wieńcową, określenie jej stężenia może mieć znaczenie dla zapobiegania powikłaniom choroby wieńcowej. Do oznaczania poziomów cTn I i mioglobiny wykorzystano metody immunoenzymatyczne (AxSYM Troponin I Microparticle Enzyme Immunoassay [MEIA] oraz AxSYM Myoglobin MEIA). Do oznaczenia aktywności CPK i izoenzymu CK-MB używano Enzyline CK NAC bioMerieux a do oceny homocysteiny wykorzystano metodę immunochemiczną z pomiarem spolaryzowania fluorescencji ( Imx Homocysteine Fluorescence Polarisation ImmunoAssay [FPIA]) (13, 14, 15). W obydwu badanych grupach analizowano również czasy zamknięcia aorty (AO) oraz trwania krążenia pozaustrojowego (ECC), liczbę wykonanych pomostów wieńcowych i stosowanych defibrylacji. Uzyskane dane zebrano i usystematyzowano z zastosowaniem arkusza kalkulacyjnego Microsoft Excel. Obliczenia statystyczne wykonano przy użyciu pakietu Statistica 5.0 PL. W porównaniu średnich wartości analizowanych danych między grupami wykorzystano test U Manna-Whitney´a. Istotność różnic przyjęto na poziomie p <0,05. Wyniki przedstawiono jako wartości średnie ± standardowy błąd średniej (SEM).
Wyniki
Dane demograficzne chorych: wiek, wzrost, masę i powierzchnię ciała przedstawiono w tabeli I. Ich średnie wartości nie wykazywały istotnych statystycznie różnic.
Tabela I. Dane demograficzne chorych
| Wiek (lata) | Wzrost (cm) | Masa ciała (kg) | Powierzchnia ciała
(m2) |
| I grupa | 59,6 ? 6,5 | 168,6 ? 6,1 | 78,8 ? 14,0 | 1,82 ? 0,27 |
| II grupa | 56,7 ? 9,4 | 171,8 ? 5,6 | 86,6 ? 12,4 | 1,99 ? 0,15 |
W grupie I u 3 chorych wykonano 2 przęsła, u 9 chorych – 3, a u 3 chorych – 4. W tej grupie w 13 przypadkach wykonano przęsło tętnicze (lewa tętnica sutkowa) oraz żylne, natomiast u 2 chorych wyłącznie przęsła żylne. W grupie II u 5 chorych wykonano 3 przęsła, w 6 przypadkach – 4, a u 2 chorych 5 przęseł. U 11 chorych wykonano przęsła żylne i tętnicze, a u 2 chorych wyłącznie grafty żylne. U 1 chorego w każdej grupie zabieg wieńcowy połączony był z wszczepieniem zastawki mitralnej. W grupie I średni czas zamknięcia aorty był nieistotnie statystycznie krótszy niż w grupie II i wynosił 57 ± 16 min vs 63 ± 13 min. Czas ECC wykazał istotną statystycznie różnicę pomiędzy grupami (p = 0,03) wynosząc w grupie I 103 ± 28 min vs 124 ± 22 min w II grupie. W grupie I powrót akcji serca nastąpił spontanicznie u 14 chorych (93,3%), tylko u 1 chorego konieczne było wykonanie defibrylacji. W grupie II tylko u 1 chorego (7,6%) obserwowano samoistny powrót akcji serca, u pozostałych 12 chorych wykonano od 1 do 3 defibrylacji (p = 0,000004).
W obu badanych grupach stwierdzono podwyższone wartości homocysteiny (norma 4,45-12,42 mcmol l-1). Istotny statystycznie wzrost stwierdzono w grupie I a jej średnia wartość wynosiła 15,81 ± 4,96 mcmol l-1 w porównaniu z grupą II (13,12 ± 4,35 mcmol l-1, p = 0,04). Podwyższone stężenia homocysteiny są wynikiem potwierdzonych angiograficznie zmian naczyń wieńcowych. Znamiennie wyższe wartości homocysteiny w grupie I w porównaniu z grupą II można wiązać również z przebytym wcześniej zawałem u 6 chorych grupy I (tj. 40% chorych), z nagłym zatrzymaniem krążenia 2 miesiące przed operacją u 1 chorego, a także z zabiegiem wszczepienia protezy Y u 1 chorego czy rozpoznaną przed zabiegiem kardiomiopatią u 1 chorego. Przebyty wcześnie zawał mięśnia sercowego w grupie II stwierdzono u 4 chorych (30%). Najwyższy poziom homocysteiny (30,14 mcmol l-1) stwierdzono u chorego grupy I, u którego 4 miesiące przed operacją wykonano angioplastykę wieńcową z założeniem stentu do 2 naczyń.
W obydwu badanych grupach obserwowano istotny statystycznie wzrost stężenia cTn I przez cały czas obserwacji (norma 0,1-2,4 ng ml-1). Bardzo znamienny statystycznie wzrost stężenia troponiny (p = 0,003) obserwowano w obu grupach (I – 10,57 ± 7,0 ng ml-1, II – 13,33 ±9,9 ng ml-1) w 30 minucie po zdjęciu zacisku aorty (T3). Stężenie cTn I w obydwu grupach wzrastało istotnie statystycznie do 24 godzin po zabiegu, w 48 godzinie uległo obniżeniu, pozostało jednak nadal istotnie wyższe w stosunku do wartości wyjściowych. Wyższe średnie wartości cTn I w grupie II nie były statystycznie znamienne w stosunku do obserwowanych w grupie I. Największą ale nieznamienną statystycznie różnicę między grupami (I – 29,3 ± 16,5 ng ml-1, II – 46,7 ± 33,2 ng ml-1) stwierdzono w 8 godzinie po zabiegu (T5). Zmiany stężenia cTn I przedstawiono na rycinie 1. Wyższe stężenia cTn I obserwowane były u chorych z dłuższymi czasami AO (> 60 min) i ECC (> 120 min) oraz ze zmianami ST-T w zapisie EKG, migotaniem przedsionków, częstoskurczem nadkomorowym oraz leczonych wysokimi dawkami katecholamin. U chorego w grupie II, u którego rozpoznano okołooperacyjny zawał przednio-przegrodowy stężenie cTn I w 4 godzinie po zabiegu wynosiło 69,3 ng ml-1. U chorych z niepowikłanym przebiegiem pooperacyjnym w obydwu grupach od 24 godziny pooperacyjnej obserwowano tendencje spadkowe stężenia troponiny I.
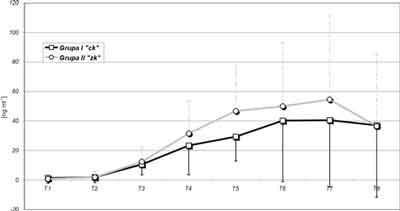
Ryc. 1. Stężenie troponiny – wartości średnie
Aktywność CPK i CKMB wzrastała istotnie w obydwu badanych grupach (norma CPK: mężczyźni 25-195 IU, kobiety 25-170 IU, norma CKMB 0-25 IU). Najbardziej istotne (p = 0,006) zmiany CPK w grupie I obserwowano w T3, T5 i T6 a w grupie II w T3 (p = 0,003) oraz w T6 i T7 (p = 0,001). Niższe średnie wartości aktywności CPK w grupie I wykazywały znamienne statystycznie różnice w porównaniu z wartościami w grupie II w T3, T4 i T5. W pozostałych przedziałach czasowych nie obserwowano istotnych statystycznie różnic pomiędzy grupami. Obserwowany wzrost średnich wartości CPK może być spowodowany wykonaną retorakotomią: w 4 godzinie po pierwszym zabiegu u 1 chorej w I grupie i w 8 godzinie u 1 chorego w II grupie, a także urazem niedokrwiennym mózgu, jak również potwierdzonymi badaniem EKG zmianami niedokrwiennymi mięśnia serca oraz stosowaną terapią. Zmiany aktywności CPK przedstawiono na rycinie 2.
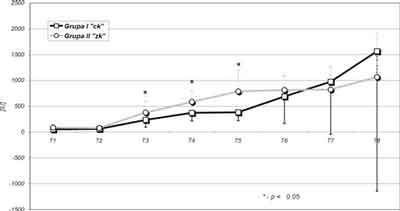
Ryc. 2. Stężenie CPK – wartości średnie
Istotny statystycznie wzrost aktywności CKMB obserwowano w obu grupach w T3 do T8. Niższe statystycznie średnie wartości CKMB w grupie I wykazały znamienną statystycznie różnicę w stosunku do wartości w grupie II w T3, T4 i T5. U chorego w II grupie, u którego rozpoznano okołooperacyjny zawał mięśnia sercowego, maksymalną wartość CKMB stwierdzono w 4 godzinie po zabiegu, z następowym powolnym jej obniżaniem. Wyższe wartości aktywności CKMB stwierdzono u chorych obydwu grup, u których w zapisie EKG występowały zmiany niedokrwienne lub zaburzenia rytmu a były wydłużone czasy AO i ECC. U chorych, u których wykonano zabiegi wieńcowe połączone z wszczepieniem zastawek serca, obserwowano wyższe wartości CKMB. Zachowanie się średnich wartości aktywności w badanych grupach przedstawiono na rycinie 3.
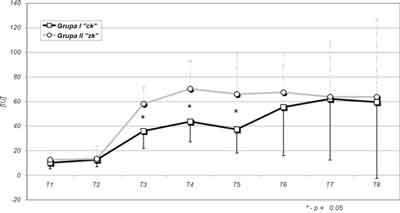
Ryc. 3. Stężenie CKMB – wartości średnie
W obydwu grupach obserwowano wcześniejszy (w T2), znamienny statystycznie wzrost średnich wartości mioglobiny utrzymujący się do 48 godziny obserwacji, który od T3 (30 minut po zdjęciu zacisku aorty) przekroczył górny zakres normy (norma 0-116,3 ng ml-1). Istotną statystycznie różnicę średnich wartości mioglobiny pomiędzy grupami stwierdzono w T3 (gr. I 443,7 ± 221 ng ml-1 vs gr. II 713,8 ± 288 ng ml-1). W pozostałych przedziałach czasowych różnice w średnich wartościach stężenia mioglobiny nie były znamienne statystycznie, wykazując w grupie I tendencje wzrostowe. Mogą one być tłumaczone powikłaniami okresu pooperacyjnego, jak masywny udar mózgowy u 1 pacjentki czy narastająca pooperacyjna niewydolność nerek u 2 chorych. Zachowanie się średnich wartości stężenia mioglobiny przedstawiono na rycinie 4.

Ryc. 4. Stężenie mioglobiny – wartości średnie
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Christenson RH, Azzazy NME: Biochemical markers of acute coronary syndromes. Clin Chemistry 1988; 44: 1855-1864.
2. Ozorowski T, Torliński L: Kliniczne zastosowanie bioche-micznych markerów choroby niedokrwiennej serca. Diagn Lab 1997; 33: 545-553.
3. Plebani M, Zaninitto M: Diagnostic strategies using myoglobin measurment in myocardial infarction. Clin Chemistry 1998; 272: 69-77.
4. Gensini GF, Fusi C, Conti AA, Calamai GC, Montesi GF, Galanti G, Noferi D, Carbonetto F, Palmarini MF, Abbate R, Vaccari M: Cardiac troponin I and Q-wave perioperative myocardial infarction after coronary artery bypass surgery. Crit Care Med 1998; 26: 1986-1990.
5. Adams JE, Sicard GA, Allen BT, Bridwell KH, Lenke LG, Davila-Roman VG, Bodot GS, Ladenson JH, Jaffe AG: Diagnosis of perioperative myocardial infarction with measurment of cardiac troponin I. N Engl J Med 1994; 330: 670-675.
6. Sadony V, Korber M, Albes G, Podtschaske V, Etgen T, Trosken T, Ravens U, Scheulen ME: Cardiac troponin I plasma levels for diagnosis and quantitation of perioperative myocardial damage in patients undergoing coronary artery bypass surgery. Eur J Cardio-Thorac Surg 1998; 13: 57-65.
7. Adams JE, Bodor GS, Davila-Roman VG, Delmez JA, Apple FS, Ladenson JH, Jaffe AS: Cardiac troponin I. A marker with high specifity for cardiac injury. Circulation 1994; 89: 1447-1448.
8. Bodor GS, Porterfield D, Voss EM, Smitb S, Apple ES: Cardiac troponin I is not expressed in fetal and adult human skeletal muscle tissue. Clin Chemistry 1995; 41: 1710-1715.
9. Apple FS, Falahati A, Paulsen PR, Miller EA, Sharkey SW: Improved detection of minor ischemic myocardial injury with measurment of serum cardiac troponin I. Clin Chemistry 1997; 43: 2047-2051.
10. Arensen E, Refsum H, Bonaa KH, Ueland PM, Forde OH, Nordrehung JE: Serum total homocysteine and coronary haert disease. Intern J Epid 1995; 24: 704-709.
11. Nygard O, Nordrehaug JE, Refsum H, Ueland PM: Plasma homocystein levels and mortality in patients with coronary artery disease. N Engl J Med 1997; 24: 230-236.
12. Graham IM, Daly IE, Refsum H, Nordrehung JE: Plasma homocysteine as risk factor for vascular disease: the European Concerted Action Project. JAMA 1997; 277: 1775-1781.
13. Sitkiewicz D: Biochemiczne markery niedokrwienia mięśnia sercowego. Diagn Laborat 1997; 33: 394-415.
14. Shipchandler MT, Moore EG: Rapid, fully automated measurement of plasma homocysteine with the Abbott IMX analyzer. Clin Chemistry 1995; 41: 991-994.
15. Apple FS, Maturen AJ, Mullins RE, Painter PC, Pessin-Minsley MS, Webster RA, Spray Flores J, DeCresce R, Fink DJ, Buckley PM, Marsh J, Ricchuiti V, Christenson RH: Multicenter clinical and analitycal evaluation of the AxSYM troponin I immunoassay to assist in the diagnosis of myocardial infarction. Clin Chemistry 1999; 45: 206-212.
16. Kawahito K, Mohara J, Misawa Y, Kato M, Fuse K: Assessment of the myocardial protective effect of antegrade warm blood cardioplegia by measuring the release of biochemical markers. Surgery 1999; 29: 322-326.
17. Benoit MO, Paris M, Silleran J, Fiemeyer A, Moatii N: Cardiac troponin I: its contribution to the diagnosis od perioperative myocardial infraction and various complications of cardiac surgery. Crit Care Med 2001; 29: 1880-1881.
18. Tatschl C, Fazekas T, Hammerle AF: Relevant markers of the acute coronary ischemic syndrome. Acta Anaesthesiol Scand 1998; 42: 92-99.
19. Jacquet L, Noirhomme P, El Koury G, Goenen M, Philippe M, Col J, Dion R: Cardiac troponin I as an early marker of myocardial damage after coronary bypass surgery. Eur J Cardio-Thorac Surg 1998; 13: 378-384.
20. Greenson N, Macoviak J, Krishnaswamy P, Morrisey R, James C, Clopton P, Fitzgerald R, Maisel AS: Usefulness of cardiac troponin I in patients undergoing open heart surgery. Am Heart J 2001; 141: 447-455.
21. Kontos MC, Anderson EP, Hanbury CM, Roberts CS, Miller WG, Jesse RL: Use of the combination of myoglobin and CK-MB mass for the rapid diagnosis of acute myocardial infarction. Am J Emerg Med 1997; 15: 14-19.




