© Borgis - Nowa Medycyna 2/1999, s. 46-48
Małgorzata Pastuszek, Kazimierz Suwalski, Jan Heybowicz, Ryszard Jackowski, Cezary Szymczak, Beata Gutowska
Operacje wad zastawkowych serca u pacjentów z niską frakcją wyrzutową lewej komory
Cardiac valve surgery in patients with depressed ejection fraction
z II Kliniki Kardiochirurgii Instytutu Kardiologii w Warszawie
Kierownik Kliniki: doc. dr hab. n. med. Kazimierz Suwalski

Wstęp
Operacje wad zastawkowych serca u pacjentów z niską frakcją wyrzutową EF < 30% budziły i budzą liczne kontrowersje. Do niedawna uważano, że ryzyko operacji u chorych z tak zaawansowaną wadą jest bardzo wysokie, a wyniki leczenia operacyjnego nie zadowalające (6). Ugruntował się pogląd, że najlepsze wyniki występują w przypadku operacji przeprowadzonych odpowiednio wcześnie, zanim dojdzie do objawów niewydolności lewej komory (2, 5). W ośrodkach o dużym doświadczeniu śmiertelność związana z planową operacją wymiany zastawki u pacjentów z prawidłową frakcją wyrzutową wynosi 2-5% w zależności od rodzaju wady i chorób współistniejących. Pacjenci z istotnym upośledzeniem czynności lewej komory EF < 30% są obciążeni większym ryzykiem operacyjnym.
Ryzyko to wzrasta do 15% jeśli równocześnie istnieje konieczność pomostowania tętnic wieńcowych.
Celem omawianej pracy była ocena wyników operacyjnego leczenia wad zastawkowych u chorych z niską frakcją wyrzutową EF < 30%.
Materiał i metodyka
W latach 1996-1998 w II Klinice Kardiochirurgii w Warszawie operowano 45 chorych z wadą zastawkową i EF < 30%. Stanowi to 7,64% wszystkich operacji wykonanych z powodu wady serca w tym okresie. Operowano 25 kobiet i 20 mężczyzn w wieku 52-68 lat (średnia wieku 58 lat). W omawianej grupie było 27 chorych z wadą aortalną, 6 z wadą mitralną, a u 12 pacjentów występowała wada aortalna łącznie z wadą mitralną. U 6 pacjentów współistniała istotna niedomykalność trójdzielna wymagająca plastyki zastawki trójdzielnej, a u 1 pacjenta wszczepienia sztucznej zastawki w ujście trójdzielne. W omawianej pracy nie uwzględniono chorych ze współistniejącą chorobą wieńcową, którzy oprócz wymiany zastawek wymagali wszczepienia pomostów aortalno-wieńcowych. Wszystkich pacjentów przed operacją kwalifikowano wg NYHA do grupy wydolności krążenia.
Pacjenci mieli wykonywany RTG klatki piersiowej, badanie EKG, ECHO z Dopplerem i koronarografię, u części – wentrikulografię. Przed operacją wszyscy pacjenci znajdowali się w III lub IV grupie NYHA. Na podstawie RTG klatki piersiowej oznaczano wskaźnik względnej objętości serca RHV. W badaniu elektrokardiograficznym zwracano uwagę na cechy przerostu i przeciążenia lewej komory. Frakcja wyrzutowa EF była określana na podstawie badania echokardiograficznego i dodatkowo u 15 chorych na podstawie wentrikulografii. Badaniem echokardiograficznym oznaczano również wymiar rozkurczowy lewej komory LVDD, wymiar skurczowy LVSD, grubość tylnej ściany lewej komory w rozkurczu PWD, wymiar lewego przedsionka LA.
Wyniki
W omawianej grupie w trakcie zabiegu operacyjnego stosowano kardioplegię krystaliczną podawaną w zależności od wady doopuszkowo lub bezpośrednio do ujść naczyń wieńcowych w początkowej dawce 1000 ml zapewniającej zatrzymanie czynności serca i wystąpienie linii izoelektrycznej w EKG. Następnie dodawano kardioplegię co 30 min. w ilości 500 ml w zależności od czasu zakleszczenia aorty. W omawianej grupie wykonano zabiegi przedstawione w tabeli 1.
Tabela 1.
| Rodzaj zabiegu operacyjnego | Liczba zabiegów |
| AVR | 27 |
| MVR | 2 |
| MVR+TVP | 4 |
| AVR+MVR | 10 |
| AVR+MVR+TVR | 1 |
| AVR+MVR+TVP | 1 |
AVR – wszczepienie sztucznej zastawki w ujście aortalne, MVR – wszczepienie sztucznej zastawki w ujście mitralne, TVR – wszczepienie sztucznej zastawki w ujście trójdzielne, TVP – plastyka zastawki trójdzielnej.
Zastosowanie katecholamin po operacji było konieczne u 38 chorych (w 84,4% przypadków). U 31 pacjentów katecholaminy włączono na sali operacyjnej, a u 7 na OIOM-ie w ciągu 2-6 godzin po operacji. Średni czas stosowania katecholamin wyniósł 74 godziny. Po operacji u pacjentów wykonywano badanie RTG klatki piersiowej, EKG, ECHO.
Badania pooperacyjne wykonywano w okresie wczesnym tj.1-2 tyg. po operacji i w okresie odległym-12 miesięcy po zabiegu operacyjnym. U zdecydowanej większości chorych po operacji uzyskano istotną poprawę kliniczną i hemodynamiczną (ryc. 1).
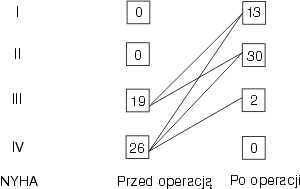
Ryc. 1.
U większości pacjentów obserwowano obniżenie wskaźnika względnej objętości serca, natomiast cechy przerostu lewej komory w zapisie EKG utrzymywały się. W badaniu echokardiograficznym zarejestrowano następujące zmiany podane w tabeli 2.
Tabela 2.
| Grupa chorych | Liczba chorych | EF wartość śr. (%) | LVDD wartość śr. (mm) | LVSD wartość śr. (mm) | PWD wartość śr. (mm) | LA wartość śr. (mm) |
| Przed operacją | Po operacji | Przed operacją | Po operacji | Przed operacją | Po operacji | Przed operacją | Po operacji | Przed
operacją | Po operacji |
| Wada aortalna | 27 | 25 | 48 | 71,4 | 62,2 | 56,3 | 48,2 | 16,3 | 13,2 | 48,2 | 43 |
| Wada mitralna | 6 | 28 | 46 | 68,3 | 62,3 | 52,2 | 46,4 | 12,5 | 12,4 | 55,2 | 46,4 |
| Wada mitralna i wada aortalna | 12 | 26 | 50 | 70,8 | 61,9 | 55,1 | 48,2 | 15,8 | 13,7 | 52,6 | 44,3 |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Butterworth J. et al.: Factors That Predict the Use of Positive Inotropic Drug Support After Cardiac Valve Surgery. Anesth Analg 1998, 86: 461-7. 2. Cormier B. et al.: Prognosis and long term results of surgicaly treated aortic stenosis. Europ. Heart J. 1998, 9 (suppl.E)113-120. 3. Fioretti P. et al.: Postoperative regression of left ventricular dimensions in aortic insufficiency: a long-term echocardiographic study. J. Am. C. C. 1985, 5:856-862. 4. Gaasch W. H. et al.: Chronic aortic regurgitation. The effect of aortic valve replacement on left ventricular volume, mass and function: Circulation 1978, 58:823-829. 5. Kelly T.A. et al.: Comparision of outcome of asymptomatic to symptomatic patients older than 20 years of age with valvular aortic stenosis. Am. J. Cardiol. 1998, 61:123-131. 6. Lund O. et al.: Independent patient-related predictors of long-term results following valve replacement in aortic valve stenosis. The Thoracic and Cardiovascular Surgeon 1987, 64-69. 7. Pela G. et al.: Long-Term Changes in Left Ventricular Mass, Chamber Size and Function after Valve Replacement in Patients with Severe Aortic Stenosis and Depressed Ejection Fraction. Cardiology 1997, 88:315-322. 8. Rohde L.E.P. et al.: Gender-Associated Differences in Left Ventricular Geometry in Patients with Aortic Valve Disease and Effect of Distinct Overload Subsets. Am. J. Cardiol. 1997, 80:475-480. 9. Stone P.H. et al.: Determinants of prognosis of patients with aortic regurgitation who undergo aortic valve replacement. J. Am. Coll. Cardiol. 1984, 3:1118-1126. 10. Tornos M.P. et al.: Clinical evaluation of a prospective protocol for the timing of surgery in chronic aortic regurgitation. Am. Heart J. 1990, 120:649-657.

