© Borgis - Nowa Medycyna 3/1999, s. 15-17
Stanisław Wroński
Przeszczepy komórek i tkanek – nowe perspektywy urologii
Cells and tissues transplantation – new perspectives of urology
z Oddziału Urologii Szpitala Wojewódzkiego im. dr. J. Biziela w Bydgoszczy
Ordynator Oddziału: dr n. med. Zdzisław Jarzemski z Regionalnego Banku Tkanek, Szpitala Wojewódzkiego im. dr. J. Biziela w Bydgoszczy

Na początku lat osiemdziesiątych rozpoczęła się jedna z najważniejszych rewolucji w historii ludzkości – rewolucja technologiczna, która zaowocowała gwałtownym rozwojem elektroniki prowadzącym do opanowania nieomal wszystkich dziedzin życia przez komputery oraz wszelkiego rodzaju nośniki i przekaźniki informacji.
Obecnie, choć być może nie w pełni zdajemy sobie z tego sprawę, tworzy się nowy przełom – rewolucja biotechnologiczna, która, jak się wydaje doprowadzi do jeszcze większych przemian niż jej poprzedniczka. W wielu laboratoriach realizowane są projekty i programy których efekty wkrótce wpłyną, choć nie wiadomo czy w sposób jednoznacznie pozytywny, na funkcjonowanie naszej cywilizacji. Przykładem jest Human Genome Project, gigantyczne dzieło realizowane w wielu instytutach na całym świecie pod kierunkiem C. Ventera.
Dziedziną biotechnologii znajdującą już teraz praktyczne zastosowanie jest hodowla komórek i tkanek. Hodowane in vitro komórki i tkanki stosowane są w transplantologii, a w przyszłości staną się jej niezastąpionym elementem. Wynika to z kilku powodów. Po pierwsze zapotrzebowanie na tkanki i narządy do przeszczepów przekracza znacznie liczbę dawców. Po drugie tkanki tworzone z komórek pacjenta nie są odrzucane jak ma to miejsce w przypadku przeszczepów allogenicznych, wgajają się szybko (wykazane to będzie na materiale własnym). Po trzecie hodowla in vitro już teraz pozwala na kształtowanie całych brakujących narządów w oczekiwanym kształcie i o wymaganych funkcjach, czego nie można było się spodziewać za pomocą innych technik.
Do chwili obecnej pierwszym przeszczepionym człowiekowi a ukształtowanym in vitro narządem jest pęcherz moczowy. Dokonał tego zespół kierowany przez A. Atalę z Uniwersytetu Harvarda. Prócz tego hodowany nabłonek urotelialny wykorzystano w zabiegach powiększania pęcherza za pomocą wstawki jelitowej pokrytej takim nabłonkiem po uprzednim usunięciu jelitowej błony śluzowej.
Od niedawna w leczeniu pacjentów oparzonych stosowany jest hodowany naskórek pacjenta. Pobrany niewielki fragment skóry dostarcza materiału do stworzenia nieomal dowolnej wielkości płata naskórka służącego do pokrywania rany w późnych etapach leczenia lub też do korekcji przerosłych blizn pooparzeniowych. Metoda ta jest też zaaprobowana przez FDA do leczenia trudno gojących się zmian skórnych (ryc. 1).
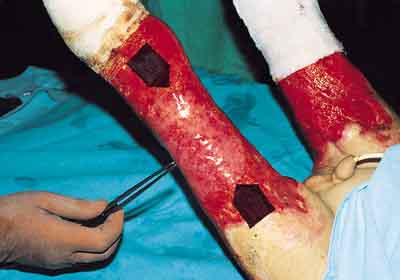
Ryc. 1. Obraz przedatawia moment położenia autologicznego naskórka hodowanego in vitro dziecku z rozległym oparzeniem obu kończyn dolnych. Wyhodowany płat widoczny jest na fotografii jako przezroczysta, biaława powierzchnia (pomiędzy dwoma strzałkami).
Wiele ośrodków naukowych prowadzi prace nad konstrukcją – gdyż wydaje się że inaczej nazwać tego nie można – kolejnych narządów. Osiągnięte wyniki oraz dalsze zamierzenia są zdumiewające dla osób nie zaangażowanych w tego typu prace, a przez wielu traktowane z niedowierzaniem. Przykładem jest hodowla kości dla pacjentów po urazach dłoni przez Ch. i J. Vacanti, zakończona skuteczną transplantacją. Obiecujące wydają się prace nad zbudowaniem naczyń krwionośnych, szczególnie tętnic. W pracach tych wyróżniają się zespoły kierowane przez F. Augera z Uniwersytetu w Quebec i J. Vacanti z Bostonu. Naczynia takie wszczepiono z sukcesem zwierzętom laboratoryjnym. Budowa tętnic z hodowanych tkanek znajduje się także w kręgu zainteresowań Banku.
Na zakończenie tego krótkiego przeglądu wspomnieć należy o prowadzonym programie budowy z hodowanych tkanek całego serca. O wadze tych badań świadczy fakt przeznaczenia na jego realizację 5 miliardów dolarów.
Dla urologów niewątpliwie najbardziej interesujące są doniesienia o konstrukcji narządów układu moczowego. Prace te podjęto w celu rozszerzenia możliwości i poprawy efektywności zabiegów rekonstrukcyjnych wad wrodzonych pęcherza moczowego. Niektóre powikłania enterocystoplastyki jak zaburzenia metaboliczne, produkcja śluzu przez wstawkę jelitową oraz pewne ryzyko rozwoju nowotworu w obrębie wstawki wynikają z różnic strukturalnych i funkcjonalnych nabłonka dróg moczowych i nabłonka jelitowego. Jak się wydaje, niedogodności te można ominąć stosując deepitelializowany segment jelitowy, wtórnie pokryty nabłonkiem urotelialnym wyhodowanym in vitro z komórek pobranych od danego pacjenta. Zabiegi takie wykonane m.in. w Niemczech i USA zakończyły się pełnym sukcesem. Kolejnym celem chirurgii rekonstrukcyjnej stało się stworzenie pęcherza moczowego w pełni złożonego z hodowanych tkanek. Badania takie prowadzone są przez czołowe laboratoria, natomiast największe efekty osiągnięte zostały przez A. Atalę z Uniwersytetu Harvarda. Kierowany przez niego zespół przeszczepił wyhodowany narząd kilkuletniemu chłopcu z wynicowaniem pęcherza moczowego. Zakończony pełnym sukcesem zabieg spowodował iż FDA wydała zgodę na wykonanie dalszych 30 takich zabiegów u chorych dzieci. Proces hodowli tkanek pęcherza jest taki sam jak hodowli ściany cewki moczowej a różnica polega na użytym rusztowaniu na którym rosną hodowane komórki.
Regionalny Bank Tkanek działający w strukturach Wojewódzkiego Szpitala im. dr. J. Biziela w Bydgoszczy prowadzi działalność w zakresie konserwacji i bankowania tkanek w celu przeszczepów a także zajmuje się hodowlą komórek i tkanek. Główna aktywność skierowana jest na konserwację skóry pobieranej ze zwłok a używanej do leczenia ciężko poparzonych pacjentów oraz hodowlę autologicznego naskórka do leczenia poważnych powikłań jakimi są przerosłe, ograniczające ruchomość kończyn blizny. Obraz mikroskopowy wyhodowanej in vitro i przeszczepionej skóry prezentuje poniższa fotografia. Przedstawia ona obraz bioptatu pobranego 4 miesiące od położenia autologicznej skóry dziecku po uprzednim usunięciu przerosłych blizn. Widoczny jest wielowarstwowy nakórek soplami wrastający w kierunku głębszych tkanek, uformowana palisadowata warstwa rozrodcza a także widoczne jest rogowacenie i złuszczanie powierzchni. Świadczy to o tym, że przeszczepiona hodowana skóra żyje oraz namnaża się. Zrozumiały jest brak gruczołów potowych, łojowych i mieszków włosowych (ryc. 2).
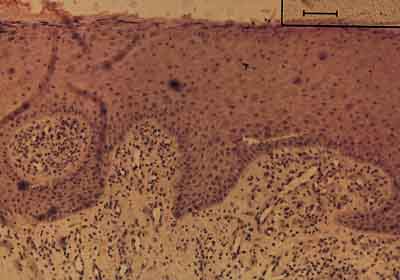
Ryc. 2. Obraz mikroskopowy bioptatu pobranego 4 miesiące po położeniu autologicznego naskórka hodowanego in vitro. Widoczna jest palisadowata warstwa rozrodcza, kilkuwarstwowy (choć jeszcze nieregularny) układ warstw komórek oraz rogowacenie i złuszczanie powierzchni. Naskórek soplami wrasta do skóry właściwej. Po stronie lewej widoczne jest ognisko ziarniny zapalnej.
Doświadczenia uzyskane dzięki hodowli skóry a także innych komórek i tkanek pozwoliły o pokuszenie się o konstrukcję innych niż skóra narządów. Pomocną była także współpraca i wymiana doświadczeń z czołowymi ośrodkami zagranicznymi. W pracy nad hodowlą tkanek istotnym dopingiem jest swoisty wyścig w celu osiągnięcia wyników, co najmniej tak dobrych jak inne laboratoria. Wydaje się, że jeżeli chodzi o hodowlę skóry, urotelium, komórek tkanki łącznej, pracownia nasza dorównuje laboratoriom zagranicznym. Istniejące wyposażenie pozwala na prowadzenie dalszych prac, m.in. hodowlę wspomnianych powyżej naczyń. Nad zagadnieniem tym pracują także inne, zaprzyjaźnione ośrodki i w chwili obecnej trudna jest ocena, który pomysł okaże się być najefektywniejszy.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł


