© Borgis - Nowa Medycyna 2/2009, s. 131-137
*Elżbieta Mazur
Możliwości i ograniczenia diagnostyki mikrobiologicznej ostrych zapaleń górnych dróg oddechowych oraz budowanie podstaw racjonalnej antybiotykoterapii empirycznej na bazie danych lokalnych – opinia mikrobiologa
Scope of microbiological diagnosis and national empiric antibiotic therapyof acute upper respiratory tract infections seen from the microbiological perspective
Katedra i Zakład Mikrobiologii Lekarskiej Uniwersytetu Medycznego w Lublinie
Kierownik Katedry i Zakładu: prof. dr hab. Maria Kozioł-Montewka
Streszczenie
Diagnosis of upper respiratory tract infections is based in most cases on the clinical examination. Careful clinical examination is extremely important, since it decides about initiation of the microbiological diagnostics in cases in which it is recommended (acute pharyngitis and tonsillitis) or about introducing of empiric antibiotic therapy in cases, in which it is not routinely performed. Such cases include acute sinusitis and otitis media since in most patients it is impossible to obtain adequate materials for microbiological examination. Empiric antibiotic therapy must be based on the analysis of the clinical and local epidemiological data. Knowledge about local antibiotic susceptibility patterns comes from the statistical analysis of the data obtained from microbiological examination of our patients or it may be received from national reference center databases.
Even though it has its limitations, microbiological diagnosis of upper respiratory tract may be very useful not only to treat the given patient but also as the important source of local data about most frequent etiological factors of infections and their susceptibility patterns. However, in order to possess such a helpful source of local epidemiologic data, microbiological diagnostics must be performed in every case, in which it is rational and possible. Also, adequate materials for the diagnosis of a given infection should be obtained.
Moreover, it should be kept in mind that microbiological examination is a kind of medical consultation. That means its proper interpretation is only possible if done in association with all relevant patient data.

Wstęp
Najczęściej występujące zapalenia górnych dróg oddechowych (gdo) to: zapalenie błony śluzowej nosa, zapalenie gardła i migdałków podniebiennych, zapalenie ucha środkowego oraz zapalenie zatok. Najczęstszą zaś przyczyną ostrych zakażeń układu oddechowego są wirusy, odpowiadają one za około 80% tych zakażeń (1, 2, 3).
Zapalenia górnych dróg oddechowych rozpoznawane są w znakomitej większości przypadków na podstawie wywiadu i badania klinicznego (2). Kliniczne rozpoznanie ostrego zakażenia układu oddechowego opiera się na stwierdzeniu zespołu objawów, który jednak nie jest charakterystyczny dla drobnoustroju wywołującego zakażenie, a często nie pozwala nawet na odróżnienie etiologii wirusowej od bakteryjnej (3).W różnicowaniu zakażeń wirusowych i bakteryjnych izolowane objawy nie mają znaczenia diagnostycznego (np. ropna wydzielina w nosogardle przez okres krótszy niż 10 dni nie świadczy o zakażeniu bakteryjnym), istotny jest natomiast zespół objawów i ewolucja zmian (np. podejrzewamy zakażenie bakteryjne zatok, jeśli objawy utrzymują się powyżej 7-10 dni i/lub jeśli następuje pogorszenie po wstępnej poprawie) (4).
Wnikliwe badanie kliniczne jest niezwykle istotne, gdyż decyduje ono o podjęciu diagnostyki mikrobiologicznej w tych przypadkach, w których jest ona zalecana (ostre zapalenie gardła i migdałków) oraz o podaniu bądź niepodaniu antybiotyku w terapii empirycznej w tych przypadkach, gdzie diagnostyka mikrobiologiczna nie jest rutynowo zalecana z uwagi na niemożność pobrania właściwego materiału do badań (zapalenie ucha środkowego i zatok).
Możliwości i ograniczenia diagnostyki mikrobiologicznej ostrych zapaleń górnych dróg oddechowych
Badanie mikrobiologiczne jest badaniem diagnostycznym, pomagającym klinicyście w rozpoznaniu choroby infekcyjnej i ustaleniu prawidłowego procesu leczenia (5). W ostrych zapaleniach dróg oddechowych rola badania mikrobiologicznego sprowadza się do dostarczenia odpowiedzi na następujące pytania:
1. Czy mamy do czynienia z wirusem, czy bakterią? (a więc czy należy podać antybiotyk czy też go nie podawać?).
2. Jeśli mamy do czynienia z bakterią, to z jaką? (jaki gatunek, jaki profil oporności, a w związku z tym jaki antybiotyk, jaka dawka, jakie właściwości farmakokinetyczne i farmakodynamiczne antybiotyku oraz jakie są ograniczenia do jego podania ze strony pacjenta?).
Problem w tym, że badanie mikrobiologiczne może pomóc odpowiedzieć na te pytania tylko wówczas, jeśli pobierzemy materiał adekwatny dla danego zakażenia. W przypadku zakażeń górnych dróg oddechowych leczonych ambulatoryjnie, taka możliwość istnieje rzadko. W zasadzie dotyczy jedynie ostrych zapaleń gardła i migdałków podniebiennych, gdzie właściwym materiałem do badania jest wymaz z tylnej ściany gardła oraz powierzchni migdałków (1). Diagnostyka mikrobiologiczna ostrego zapalenia zatok i ucha środkowego jest utrudniona, gdyż właściwymi materiałami do badań są aspiraty, a więc materiały pobierane technikami inwazyjnymi, dlatego rutynowe ich pobieranie nie jest zalecane (1, 2, 3).
Kiedy zatem w zakażeniach gdo powinniśmy wykonywać badanie mikrobiologiczne?
1. Dla odróżnienia etiologii wirusowej od bakteryjnej w ostrym zapaleniu gardła i migdałków, jeśli zespół objawów klinicznych sugeruje zapalenie paciorkowcowe (szybkie testy/posiew).
2. Gdy pacjent z paciorkowcowym zapaleniem gardła i migdałków jest uczulony na antybiotyki beta-laktamowe (konieczność wykonania posiewu i antybiogramu).
3. W zapaleniu zatok i ucha środkowego – zawsze wtedy, gdy można pobrać materiał do badania (zabieg operacyjny w obrębie ucha środkowego lub zatok, paracenteza, samoistne pęknięcie błony bębenkowej).
Ad. 1. Ostre zapalenie gardła i migdałków podniebiennych wywołują przede wszystkim wirusy (70-80% przypadków), etiologia wirusowa jest zdecydowanie częstsza u osób dorosłych. Za 20-30% przypadków tej choroby odpowiedzialne są paciorkowce grupy A ( Streptococcus pyogenes), etiologia paciorkowcowa jest częstsza u dzieci w wieku 5-15 lat (1, 3, 6). Jak wynika z badań epidemiologicznych, Streptococcuspyogenes wywołuje około 25-30% ostrych zapaleń gardła i migdałków u dzieci i około 10% ostrych zapaleń gardła i migdałków u dorosłych (7).
Ponieważ leczenie paciorkowcowego i wirusowego zapalenia gardła jest odmienne, różnicowanie tych dwóch postaci jest bardzo ważne. Sam obraz gardła, jako izolowany objaw, nie ma znaczenia diagnostycznego – ważny jest pewien zestaw objawów. Pomocą praktyczną może być skala punktowa Centora/McIssaca, biorąca pod uwagę wiek pacjenta oraz występowanie gorączki, kaszlu, powiększonych węzłów chłonnych szyjnych, nalotu i obrzęku migdałków (2, 3). Na zakażenie paciorkowcowe wskazuje: obecność gorączki powyżej 38,5°C, obecność wydzieliny na powierzchni migdałków, brak kaszlu, tkliwe węzły chłonne szyjne (zwłaszcza ten objaw ma duże znaczenie różnicujące), a u dzieci również obecność nudności i wymiotów (8).
Badaniem pomocnym w potwierdzeniu etiologii paciorkowcowej jest szybki test, wykrywający obecność antygenu polisacharydowego Streptococcuspyogenes (RADT – rapid antigen detection test), łatwy do wykonania i możliwy do przeprowadzenia w gabinecie lekarza, bezpośrednio po pobraniu materiału z migdałków (czas wykonania 5-10 min). Umożliwia on szybkie rozpoznanie czynnika etiologicznego i właściwe leczenie, co redukuje ryzyko rozsiewu S. pyogenes w populacji oraz skraca okres absencji w szkole lub miejscu pracy (7). Ponadto należy pamiętać, że okres zakaźności w przypadku paciorkowcowego zapalenia gardła i migdałków kończy się po 24 h od rozpoczęcia skutecznej antybiotykoterapii; natomiast okres zakaźności u pacjenta, u którego nie zastosowano leczenia antybiotykiem trwa przez około tydzień od czasu ustąpienia objawów (3).
Badania ostatnich dwudziestu lat dowiodły, że swoistość szybkich testów, czyli ich zdolność do wykrycia obecności w materiale paciorkowców grupy A, jest znacznie wyższa niż ich czułość, czyli możliwość wykluczenia obecności S. pyogenes poprzez ujemny wynik testu.
Oznacza to, że jeśli RADT jest dodatni, pacjent z bardzo dużym prawdopodobieństwem jest zakażony S. pyogenes, decyzje terapeutyczne mogą być zatem bezpiecznie podejmowane na podstawie dodatniego wyniku testu. Natomiast wynik ujemny nie wyklucza zakażenia przez ten drobnoustrój (8). Ponieważ RADTs opierają się na reakcji antygen przeciwciało, w której antygenem jest grupowo swoisty wielocukier ściany komórkowej, aby reakcja mogła zajść – odpowiednia ilość bakterii musi być obecna w wymazie. Oznacza to, że nieprawidłowo pobrany wymaz i/lub relatywnie mała ilość bakterii w jamie gardłowej mogą być przyczyną wyniku fałszywie ujemnego. Z tego powodu zaleca się potwierdzenie wyniku ujemnego RADT hodowlą wtedy, gdy obraz kliniczny sugeruje etiologię paciorkowcową (3, 8, 9). Zalecenie to powinno być bezwzględnie przestrzegane u dzieci, gdyż u nich prawdopodobieństwo wystąpienia etiologii paciorkowcowej jest znacznie wyższe niż u dorosłych (3).
Fałszywie dodatnie RADTs zdarzają się bardzo rzadko. Wynika to z faktu, iż niektóre szczepy Streptococcus milleri (pochodzące z flory fizjologicznej jamy ustnej i gardła) mogą mieć na swojej powierzchni antygen grupowy A, dlatego przy obecności takich szczepów test może dawać wynik dodatni mimo braku S. pyogenes (8).
Swoistość RADTs w porównaniu z posiewem wynosi 95%, jego czułość – około 80-90%.
Niestety ani posiew, ani RADTs, nie są w stanie odróżnić jednoznacznie chorych z ostrym paciorkowcowym zapaleniem gardła od nosicieli S. pyogenes, którzy aktualnie przechodzą wirusowe zapalenie gardła, dlatego przy obecności obrazu klinicznego wskazującego na zakażenie wirusowe nie jest zalecane wykonywanie szybkich testów, gdyż w takich przypadkach najczęściej „leczy się” nosicielstwo (7, 9).
Dodatni wynik testu jest podstawą do rozpoczęcia leczenia penicyliną (u chorych, którzy nie są uczuleni na penicylinę) lub u uczulonych na penicylinę – cefalosporyną I generacji (cefadroksyl) (10). U chorych uczulonych na antybiotyki beta-laktamowe należy wykonać posiew i test wrażliwości na antybiotyki (częsta oporność S. pyogenes na makrolidy) (3). U dzieci ujemny wynik testu przy obrazie klinicznym wskazującym na zakażenie bakteryjne powinien być zawsze uzupełniony posiewem (3, 8, 9). Prawidłowo pobrany wymaz do badania w kierunku S. pyogenes powinien być pobrany z obu migdałków podniebiennych i tylnej ściany gardła. Pobrany wymaz nie wymaga podłoża transportowego, jeśli dociera do laboratorium w czasie krótszym niż 4 godziny. Jeśli przewidywany czas transportu przekracza 4 h, wymaz powinien być umieszczony w podłożu transportowym (1).
„Złotym standardem” dla potwierdzenia paciorkowcowej etiologii zapalenia gardła i migdałków jest hodowla (czułość 90-95%), prowadzona na agarze z krwią przez 24 godziny.
Przy ujemnym wyniku posiewu, zalecane jest pozostawienie płytki z posiewem na kolejne 24 godziny w temperaturze pokojowej (7).
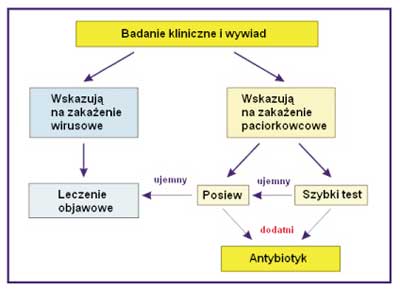
Ryc. 1. Algorytm różnicowania i leczenia ostrego zapalenia gardła i migdałków podniebiennych (według C.M. Nascimento-Carvalho [9], reprodukowany za zgodą autorki).
Ad. 2. Ponieważ 100% szczepów S. pyogenes wykazuje wrażliwość na penicylinę, na podstawie dodatniego wyniku RADT lub posiewu, możemy wdrożyć leczenie penicyliną lub u osób uczulonych na penicylinę – cefalosporyną I generacji (cefadroksyl) (10). Problem pojawia się u chorych uczulonych na antybiotyki beta-laktamowe, gdyż wybór alternatywnego antybiotyku musi opierać się na wyniku testu wrażliwości na antybiotyki wyhodowanego szczepu. Wynika to z faktu znacznego stopnia oporności na makrolidy wśród szczepów izolowanych w Polsce. Około 15% szczepów wykazuje oporność wobec makrolidów, ponadto w naszym kraju przeważa oporność typu receptorowego (MLSB), czyli równoczesna oporność na makrolidy, linkozamidy i streptograminy B – 90% szczepów opornych na makrolidy posiada ten typ oporności (3, 11). W Polsce mamy do czynienia również ze znacznego stopnia opornością na tetracykliny. Warto również pamiętać, że S. pyogenes nie jest wrażliwy na kotrimoksazol (naturalna oporność na trimetoprim), co jednoznacznie wyklucza ten lek z terapii paciorkowcowego zapalenia gardła i migdałków (6).
W przypadku uczulenia na antybiotyki beta-laktamowe można zaczekać na wynik badania mikrobiologicznego i zastosować antybiotykoterapię celowaną. Opóźnienie we wdrożeniu antybiotyku (nawet o 3-4 dni) nie ma wpływu na wynik leczenia, niektóre opracowania podają wręcz lepsze i szybsze efekty leczenia celowanymi antybiotykami, mimo późniejszego ich włączenia do leczenia (6). Wdrożenie leczenia penicyliną w okresie do 9 dni od pojawienia się pierwszych objawów choroby nadal skutecznie zapobiega gorączce reumatycznej (3).
Leczenie anginy paciorkowcowej, w świetle aktualnej wiedzy medycznej, powinno wyglądać następująco:
– penicylina V/G (doustnie 2x dziennie, domięśniowo 1 dawka dziennie),
– alternatywnie (u chorych uczulonych na penicylinę) cefalosporyny I generacji (cefadroksyl),
– u chorych uczulonych na antybiotyki beta-laktamowe alternatywą są makrolidy, jeśli wyhodowany szczep jest na nie wrażliwy (makrolidy nie zapobiegają gorączce reumatycznej),
– leczenie powinno trwać 10 dni (profilaktyka powikłań) (3).
Celem antybiotykoterapii w paciorkowcowym zapaleniu gardła jest eradykacja drobnoustroju z jamy gardłowej przy minimalnym wpływie na florę fizjologiczną gardła – dlatego, jeśli nie ma przeciwwskazań ze strony pacjenta, stosujemy penicylinę lub alternatywnie cefalosporyny I generacji, natomiast nie stosujemy amoksycyliny (3). Eradykacja S. pyogenes jest niezbędna dla prewencji powikłań (miejscowych i ogólnych) (6).
Ad. 3. Rutynowo, zwłaszcza u chorych leczonych ambulatoryjnie, diagnostyka bakteriologiczna w ostrym zapaleniu zatok i ucha środkowego nie jest zalecana. Wynika to z faktu, że aby pobrać materiał adekwatny do zdiagnozowania tych zakażeń, niezbędne są procedury inwazyjne (w obu przypadkach właściwymi materiałami do badań są aspiraty) (1, 2, 3).
Podobnie, jak w przypadku zapalenia gardła i migdałków podniebiennych bardzo istotne dla rozpoznania ostrego zapalenia ucha środkowego (OZUŚ) jest wnikliwe badanie kliniczne. Decydujący dla rozpoznania jest obraz otoskopowy, w którym stwierdza się obecność płynu w uchu środkowym i zmiany zapalne błony bębenkowej (2, 3). Według aktualnego stanu wiedzy, pierwotną przyczyną zapalenia ucha środkowego są wirusy (2, 3, 12). Dlatego w łagodnych klinicznie przypadkach zalecana jest obecnie zasada czujnego wyczekiwania bez podawania antybiotyku (2, 3, 4, 12).
Antybiotyki powinny być podawane tylko w następujących przypadkach:
– u dzieci poniżej 6 miesiąca życia z obustronnym zapaleniem ucha środkowego,
– u pacjentów z wyciekiem z ucha,
– u dzieci z wysoką gorączką i wymiotami (3, 12).
Zdecydowana większość bakteryjnych OZUŚ jest powodowana przez Streptococcus pneumoniae, Haemophilus influenzae i Moraxella (Branhamella) catarrhalis (3, 10, 12). Antybiotyk stosowany w OZUŚ powinien być skuteczny wobec najczęściej występujących patogenów, a więc S. pneumoniae i H. influenzae. Uwzględniając profil lekooporności tych drobnoustrojów w Polsce lekiem z wyboru powinna być amoksycylina. Za jej skutecznością przemawia wysoka aktywność wobec pneumokoków, w tym również szczepów o zmniejszonej wrażliwości na penicylinę oraz stosunkowo rzadkie występowanie w Polsce szczepów H. influenzae produkujących beta-laktamazy (3). Ponadto, amoksycylina charakteryzuje się bardzo dobrą penetracją oraz znakomitymi właściwościami farmakodynamicznymi (5, 12).
Optymalny czas antybiotykoterapii w OZUŚ jest nadal przedmiotem dyskusji. Zalecany obecnie czas leczenia powinien wynosić 10 dni, może on zostać skrócony do 5 dni u dzieci powyżej 2. roku życia z niepowikłanym OZUŚ (3). U pacjentów uczulonych na amoksycylinę stosujemy cefalosporyny: aksetyl cefuroksymu lub w cięższych przypadkach ceftriakson. Reakcja uczuleniowa na wszystkie antybiotyki betalaktamowe wymaga zastosowania makrolidów: klaritromycyny lub azitromycyny (3, 12).
Pierwotną przyczyną ostrego zapalenia zatok, podobnie jak OZUŚ, jest zakażenie wirusowe nosogardła. Najczęstsze patogeny bakteryjne to: Streptococcus pneumoniae i Haemophilus influenzae, a następnie Moraxella (Branhamella) catarrhalis, Streptococcuspyogenes, Staphylococcus aureus oraz bakterie beztlenowe (2, 3, 12).
Różnicowanie między wirusowym i bakteryjnym zapaleniem zatok jest utrudnione ze względu na brak specyficznych dla etiologii objawów. Rodzaj wydzieliny z nosa, w szczególności jej ropny charakter, nie świadczy o zakażeniu bakteryjnym i nie powinien stanowić kryterium różnicującego. Podobnie mało różnicującym objawem jest gorączka. Ponieważ zakażenie bakteryjne prawie zawsze poprzedza infekcja wirusowa, większe znaczenie różnicujące ma ewolucja objawów. Objawy infekcji wirusowej ustępują na ogół w ciągu 7-10 dni. U dzieci utrzymywanie się objawów zakażenia górnych dróg oddechowych dłużej niż 10 dni wskazuje na zakażenie bakteryjne. Różnicowanie między zakażeniem wirusowym i bakteryjnym w okresie krótszym niż 10 dni może odbywać się poprzez zauważalne pogorszenie po okresie klinicznej poprawy lub poprzez identyfikację cięższego obrazu klinicznego. Ostre zapalenie zatok przebiegające jako ciężkie zakażenie mogące sugerować zakażenie bakteryjne jest definiowane jako obraz kliniczny dziecka wyglądającego na chore, z gorączką powyżej 39°C i wyciekiem z nosa trwającym dłużej niż 3-4 dni. Jednak najważniejszym kryterium różnicującym zakażenia wirusowe i bakteryjne jest czas trwania objawów powyżej dziesięciu dni (2, 3, 4, 12).
U pacjentów z przebiegiem łagodnym lub umiarkowanym, trwającym krócej niż 7 dni można rozważyć stosowanie zasady czujnej obserwacji i wyczekiwania bez stosowania antybiotyku.
Stosowanie antybiotyku jest zalecane w następujących sytuacjach:
– brak poprawy po 7-10 dniach,
– ciężki przebieg zakażenia; ciężkość przebiegu jest definiowana wg oceny intensywności bólu twarzy oraz gorączki powyżej 39°C,
– objawy pogorszenia po wstępnej poprawie klinicznej,
– obecność powikłań (2, 3, 4, 12).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Stefaniuk E. "Pozaszpitalne zakażenia układu oddechowego - etiologia bakteryjna, zasady pobierania materia-ów do badań mikrobiologicznych". Nowa Klinika 2007; 14 (9,10): 942-948. 2. Kotowska M. "Znaczenie diagnostyki klinicznej w rozpoznawaniu pozaszpitalnych zakażeń układu oddechowego" Materia-y XII Sympozjum Naukowego "Postępy w medycynie zakażeń" Warszawa 18-19.11.2008: 28-29. 3. Hryniewicz W, Grzesiowski P, Kozielski J, Kuś J, Meszaros J, Ozorowski T, Pirożyński M, P-usa T, Radzikowski A. "Rekomendacje diagnostyki i leczenia zakażeń układu oddechowego" - wersja robocza 2008 (http://www.nfz-opole.pl/Swiadczeniodawcy/POZ/Rekomendacje.oddechowe.pdf). 4. Radzikowski A. Leczenie objawowe - czy koniec farmakologii? Materia-y XII Sympozjum Naukowego "Postępy w medycynie zakażeń" Warszawa 18-19.11.2008: 31-32. 5. Hryniewicz W, Meszaros J. "Antybiotyki w profilaktyce i leczeniu zakażeń". PZWL 2001. 6. Łazęcka K. "Angina paciorkowcowa - rozpoznawanie, leczenie" Klinika Pediatryczna 2006; 13 (4): 418-422. 7. Chopra H., Snyder J.W. "Laboratory diagnosis of streptococcal pharyngitis" Laboratory Advisor 2004; 2: 1-6. 8. Kaplan E.L. "Rapid mis-st(r)ep" Pediatrics 2007 (http://www.dynabizvenezuela.com/images/dynabiz/ID3749/siteinfo/Caso%20Cl%C3%ADnico%207.pdf). 9. Nascimento-Carvalho C.M. "Outpatient antibiotic therapy as a predisposing factor for bacterial resistance: a rational approach to airway infections". J Pediatr (Rio J). 2006; 82(5 Suppl): S146-52. 10. Albrecht P. "Antybiotykoterapia empiryczna zakażeń układu oddechowego w dobie narastania oporności Streptococcus pneumoniae" Materia-y XII Sympozjum Naukowego "Postępy w medycynie zakażeń" Warszawa 18-19.11.2008: 30. 11. Szczypa K, Chmylak B, Hryniewicz W. "Oporność Streptococcus pyogenes na antybiotyki makrolidowe" Nowa Klinika 2004; 11 (7-8): 729-731. 12. Hassmann-Poznańska E. "Racjonalna antybiotykoterapia w ostrych zakażeniach górnych dróg oddechowych". Materia-y XI Sympozjum Naukowego "Postępy w medycynie zakażeń" Warszawa 30.11-1.12.2007: 29. 13. Murphy T.M. "Respiratory infections caused by non-typeable Haemophilus influenzae" Curr Opin Infect Dis 2003; 16: 129-134. 14. Verduin C.M., Hol C., Fleer A., van Dijk H., van Belkum A. "Moraxella catarrhalis: from emerging to established pathogen" Clin. Microbiol. Rev. 2002; 15(1): 125-144. 15. Hryniewicz W., Sulikowska A., Szczypa K., Skoczyńska A., Łuczak-Kad-ubowska A., Gniadkowski M. "Rekomendacje doboru testów do oznaczania wrażliwości bakterii na antybiotyki i chemioterapeutyki" 2006 (ze zmianami, wprowadzonymi w 2007 roku: http://www.korld.edu.pl/pdf/ZMIANY_REKOMENDACJI_11-2007.pdf). 16. Sulikowska A, Hryniewicz W. "Nosicielstwo Streptococcus pneumoniae w nosogardle jako czynnik ryzyka zakażeń i rozprzestrzeniania się szczepów opornych na antybiotyki" Nowa Klinika 2001; 8(9): 922-924. 17. Sadowy E. "Wybrane aspekty molekularne nosicielstwa bakteryjnego w nosogardzieli człowieka". Post. Mikrobiol. 2003; 42(4): 369-384. 18. Wise R. "Nasopharyngeal carriage of Streptococcus pneumoniae: a review of the potential role of pharmacokinetics and pharmacodynamics". JAC 2002; 50 (Suppl. S2): 45-50. 19. Garcia-Rodriguez J.A., Martinez M.J.F. "Dynamics of nasopharyngeal colonization by potential respiratory pathogens" JAC 2002; 50 (Suppl. S2): 59-73. 20. Kozińska A, Bojarska K, Hryniewicz W. "Nosicielstwo S. aureus czy prawdziwe zagrożenie?" Nowa Klinika 2008; 15 (5,6): 553-558. 21. Garau J, Dagan R. "Accurate diagnosis and appropriate treatment of acute bacterial rhinosinusitis: minimizing bacterial resistance" Clinical Therapeutics 2003; 25(7): 1936-1951.

