Wojciech P. Olszewski
Status HER2 w raku piersi – informacje praktyczne dla lekarzy
HER2 status in breast carcinoma – practical information for physicians
Zakład Patologii, Centrum Onkologii – Instytut im. Marii Skłodowskiej-Curie
Streszczenie
Summary
The aim of the article is an oncologists-oriented comprehensive presentation of practical aspects of HER2 status evaluation in breast carcinoma. Basic information on HER2 function, both in benign and malignant cells is presented, as well as its role as a prognostic and a predictive factor in breast cancer management. Two techniques of HER2 status evaluation: immunohistochemistry (IHC) and FISH, are described. Scoring systems and clinical interpretations of results for both methods are showed. Graph of algorithm of HER2 status evaluation visually summarize practical aspects of the article. Finally, addresses of Pathology Departments in Poland, which perform HER2 status evaluation for clinical requirements are obtainable.
Key words: breast carcinoma, prognostic factors, predictive factors, HER2, immunohistochemistry, FISH

Celem artykułu jest możliwie zwarte i proste przedstawienie praktycznych aspektów oznaczania statusu HER2 – nowego czynnika prognostycznego i predykcyjnego w raku piersi. Artykuł wyjaśnia na wstępie, w podstawowy sposób, funkcje i budowę receptora HER2 oraz genu HER2, który koduje to białko. Informacje te są potrzebne do zrozumienia przedstawionych w artykule technik oceny HER2. Na zakończenie opisany jest algorytm postępowania przy określaniu statusu HER2 (ryc. 1) oraz adresy zakładów patologii w Polsce, które dokonują oceny HER2.
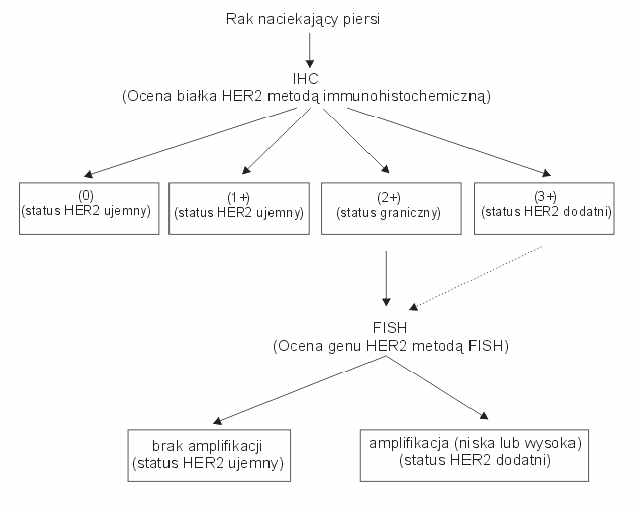
Ryc. 1. Algorytm postępowania przy statusie HER
Informacje ogólne dotyczące receptora HER2
Receptor ludzkiego naskórkowego czynnika wzrostu (Human epidermal growth factor receptor 2 – HER2) jest jednym z rodziny białkowych receptorów naskórkowych czynników wzrostu (EGFR). Te powierzchniowe białka są zaangażowane w przekazywanie komórkom sygnałów związanych z kontrolą ich wzrostu i funkcjonowania. Nadekspresja białka HER2 jest związana z agresywniejszym rozrostem raka piersi i gorszym rokowaniem u pacjentów z przerzutami do węzłów chłonnych, co stanowi teoretyczną podstawę do stosowania leczenia przy użyciu przeciwciała monoklonalnego przeciwko temu białku. Dało to również początek większemu zainteresowaniu pozostałymi trzema członkami rodziny EGFR (HER1, HER3, HER4) oraz ich prawdopodobną rolą w procesie powstawania i progresji raka. Wszystkie cztery białka EGFR są strukturalnie podobne. Zakotwiczone w błonie komórkowej posiadają domeny zewnątrz- i wewnątrzkomórkowe. Część zewnątrzkomórkowa posiada domenę łączącą się z ligandem (czynnikiem wzrostu), część wewnątrzkomórkowa wykazuje aktywność enzymatyczną kinazy tyrozynowej, która jest zaangażowana w przekazywanie sygnału do wnętrza komórki. Połączenie czynnika wzrostu z domeną zewnątrzkomórkową prowadzi do powstania dimeru z inną cząsteczką białka rodziny EGFR, co z kolei aktywuje kinazę tyrozynową, która pozwala na przekazanie drogą chemiczną informacji do wewnętrznych struktur komórki. W komórkach raka system kontroli wzrostu i proliferacji jest zmieniony. W komórkach nowotworowych stwierdzono liczne zaburzenia dotyczące m. in. rodziny białek EGFR. Należą do nich:
amplifikacje genów,
nadekspresja białek,
mutacje wpływające na interakcje białkowe.
Pomimo, że przy obecnym stanie wiedzy nie jest możliwe stwierdzenie czy wykryte zmiany są pierwotną przyczyną transformacji nowotworowej komórek, to nieprawidłowości w budowie i funkcjonowaniu białek EGFR stanowią cel nowych metod terapeutycznych. Amplifikacja genów i nadekspresja białek EGFR (m.in. HER2) może być związana z nadmierną proliferacją komórek, co ma miejsce w przypadku raka piersi. Nadekspresja HER2 jest również obserwowana w innych nowotworach, m. in. w rakach jajnika i jelita grubego. Sugeruje to powszechność tego zaburzenia w komórkach raka wywodzących się z różnych narządów. Pozytywne efekty terapii przeciwciałem monoklonalnym skierowanym przeciwko białku receptorowemu HER2 w rakach piersi wykazujących nadekspresję tego receptora dają nadzieję, że ten typ leczenia, przynajmniej w części odpowiednio wyselekcjonowanych przypadków, znajdzie szersze zastosowanie.
Ocena ekspresji HER2 stała się ważnym czynnikiem przy podejmowaniu decyzji leczniczych w raku piersi. Marker ten początkowo był uznawany tylko za czynnik prognostyczny, czyli informujący o potencjalnym przebiegu choroby. Istniały również dane sugerujące, że poziom ekspresji HER2 pomaga przewidzieć odpowiedź na terapię hormonalną i chemioterapię. Wprowadzenie terapii skierowanej specyficznie przeciw HER2 powoduje, że wynik oznaczenia ekspresji HER2 w komórkach raka piersi ma istotne znaczenie w podjęciu decyzji leczniczej. Tym samym stan receptora HER2 w komórkach raka ma znaczenie predykcyjne; informuje o potencjalnej reakcji na zastosowane leczenie. Ta predykcyjna właściwość wyniku oceny receptora HER2 – określanego statusem HER2 – decyduje o roli tego białka we współczesnej onkologii raka piersi. Sytuacja ta wymogła opracowanie technik pozwalających na ocenę ekspresji HER2 (1-3).
HER2 jako czynnik prognostyczny
Postęp w zrozumieniu biologii nowotworów, jaki dokonał się w ostatnich latach, doprowadził do identyfikacji molekularnych czynników prognostycznych, stających się uzupełnieniem czynników ocenianych konwencjonalnymi metodami, (czyli oceną makroskopową i mikroskopową z zastosowaniem barwienia hematoksyliną i eozyną), takich jak wielkość guza, lokalizacja zmiany, stan węzłów chłonnych (obecność lub brak przerzutów), typ histologiczny raka czy też ogólnie, stopień zaawansowania według klasyfikacji pTNM. Spośród nowych czynników prognostycznych, nadekspresja HER2 jest uznanym, choć drugorzędnym markerem złego rokowania. Występuje w około 25-30% raków piersi. Pośród pacjentów z przerzutami do węzłów chłonnych, chorzy z nad-ekspresją HER2 wykazują średnie 3-letnie przeżycie (mediana), przy średnim 6-7-letnim przeżyciu u chorych bez nadekspresji HER2 w komórkach raka.
Aktywacja receptorów HER2 i ekspresja innych członków rodziny HER również wpływa na rokowanie. Również ustalono, że pewne relacje HER2 w formie aktywnej i nieaktywnej z innymi czynnikami prognostycznymi dodatkowo wpływają na ich interpretację. Dokładniejsza analiza poziomów ekspresji HER2 wraz z informacjami o ekspresji innych genów tej rodziny oraz o ich aktywacji może pozwolić na dokładniejsze określenie rokowania dla pacjenta (4).
HER2 jako czynnik predykcyjny
Dostępność przeciwciała przeciw HER2 oznacza, że rola HER2 jako czynnika predykcyjnego w obecnej praktyce onkologicznej ma większe znaczenie niż jego właściwości prognostyczne. Przeciwciało przeciw białku HER2 – trastuzumab – znane bardziej pod swoją handlową nazwą herceptyny, podane pacjentowi z rakiem, którego komórki wykazują nadekspresję HER2, wiąże się z tym receptorem, nie pobudzając go jednak. Tym samym znoszony jest stymulujący komórki raka wpływ zbyt licznych pobudzonych receptorów czynnika wzrostu. Należy oczywiście pamiętać, że HER2 nie jest jedynym czynnikiem decydującym o dynamice wzrostu komórek, zarówno łagodnych, jak i złośliwych, i w praktyce treść poprzedniego zdania wymaga wielu zastrzeżeń.
W ostatnich latach wzrosło również zainteresowanie interakcjami pomiędzy nadekspresją receptora HER2 a różnymi formami terapii systemowej w przypadkach raka piersi. Informacje te mogą pomóc w wyborze najodpowiedniejszej formy terapii dla danego pacjenta. Tym samym predykcyjne znaczenie HER2 nie jest ograniczone do terapii trastuzumabem (herceptyną), ale powinno być uwzględniane również w programach leczenia niezawierających tego terapeutyku (5-12).
Ocena HER2 i interpretacja wyników
Wartość HER2, zarówno jako czynnika prognostycznego, jak i predykcyjnego, wymaga praktycznej, powtarzalnej, wiarygodnej i łatwo dostępnej metody pomiaru. Jak wspomniano wyżej receptor HER2 występuje, zarówno w komórkach łagodnych, jak i w komórkach rakowych. Co więcej, w komórkach nowotworowych, w większości przypadków raka piersi (ok 70%), nie stwierdza się nadekspresji tego białka. W około 25-30% przypadków raka piersi zawartość białka receptorowego jest wyraźnie większa (nawet kilkaset razy większa). O przypadkach takich mówimy, że występuje w nich nadekspresja HER2 i mają dodatni status receptora HER2. Z klinicznego punktu widzenia, należy wyselekcjonować wszystkie przypadki raka piersi z dodatnim statusem receptora HER2, co najmniej tych pacjentów, którzy mają być poddani chemioterapii lub hormonoterapii. Dostępnych jest kilka technik. Metoda immunohistochemiczna, ocenia nadekspresję białka HER2. Metodami określającymi amplifikację genu HER2 są FISH (fluorescencent in-situ hybridization) oraz PCR (polymerase chain reaction). Krążące we krwi białkowe fragmenty zewnątrzkomórkowej domeny HER2 mogą być oceniane techniką biochemiczną ELISA.
W praktyce uznanymi metodami oceny statusu HER2 są metody immunohistochemiczna (IHC) i fluorescencyjnej hybrydyzacji in situ (FISH). Ich wartość wynika z możliwości oceny interesującego nas parametru w zachowanym utkaniu raka (IHC) bądź zachowanych jądrach komórek raka (FISH) pod kontrolą mikroskopu optycznego. Poza tym obie metody pozwalają na łatwe wykorzystanie materiału archiwalnego z tkanki nowotworowej z bloczków parafinowych. Ze względu na konieczność znajomości morfologii nowotworów przy ocenie HER2 wymienionymi metodami, a także, choć w mniejszym stopniu ze względu na znajomość technicznych aspektów przygotowania materiału archiwalnego (np. wybór bloczka parafinowego z utkaniem guza, ocena możliwości badania w materiale biopsyjnym, cytologicznym, materiale z ognisk przerzutowych itp.) badanie powinno być od strony merytorycznej przeprowadzane przez lekarza patologa (w przypadku techniki IHC), bądź co najmniej przez niego nadzorowane (w przypadku techniki FISH).
Metoda immunohistochemiczna wykorzystuje przeciwciała przeciw białku HER2. Technika ta pozwala na ocenę ekspresji HER2 w błonach komórkowych poszczególnych komórek raka. Może być przeprowadzona zarówno w „świeżym”, jak i w archiwalnym materiale (bloczki parafinowe), jak również w preparatach cytologicznych. Wyniki badania metodą immunohistochemiczną są klasyfikowane półilościowo, w skali czterostopniowej jako: 0 i 1+ (negatywne, status ujemny); 2+ (o granicznej pozytywności); 3+ (pozytywne, status dodatni). Pozorna sprzeczność pomiędzy oznaczeniami intensywności wybarwienia a oceną statusu [np. (1+) – status ujemny] wynika z tego, że czym innym jest opisanie obrazu mikroskowego barwienia IHC, a czym innym jego interpretacja. Ocena odbywa się na podstawie intensywności wybarwienia błon komórkowych. Istnieją liczne czynniki, które powodują, że metoda ta jest nie w pełni powtarzalna. Należą do nich:
wybór przeciwciała,
immunoreaktywność tkanki,
artefakty (np. zgniecenie),
czułość zastosowanych przeciwciał w tkance z bloczków parafinowych,
zniszczenie epitopów HER2 przez formalinę przy zbyt długim utrwalaniu,
subiektywność oceny,
poziom ekspresji HER2 w zdrowej tkance.
Należy mieć na uwadze, że część z wymienionych ograniczeń metody ma tym mniejsze znaczenie, im większe jest doświadczenie oceniających. W dobrych, co najczęściej znaczy, pracowniach z odpowiednim doświadczeniem (przynajmniej kilkaset ocenianych w kierunku HER2 przypadków rocznie) analizowany materiał wykazuje 95%-ową zgodność wyniku oceny metodą IHC z wynikami oceny metodą FISH.
Metoda FISH w ocenie statusu HER2 jest uznawana za złoty standard. Pozwala ona na bezpośredni pomiar liczby kopii genu HER2.
Przed krótkim omówieniem tej metody, należy wyjaśnić relacje pomiędzy liczbą kopii genu a ilością białka receptorowego HER2. Funkcja biologiczna HER2, a także działanie farmakologiczne trastuzumabu jest związane z białkiem receptorowym HER2 – produktem genu HER2. W przypadku HER2 zwiększenie liczby kopii genu HER2 idzie w parze ze zwiększeniem ilości białka receptorowego. Wykazano, że analizując liczbę kopii genu HER2 w jądrach komórek raka piersi, w pośredni sposób, z większą wiarygodnością niż w przypadku bezpośredniej oceny białka metodą IHC, można określić potencjalną reakcję na leczenie terapeutykiem-trastuzumabem-działającym przecież na receptor, a nie gen.
Prawidłowa liczba kopii genu określana jest jako brak amplifikacji. W większości prawidłowych, niebędących w fazie podziału, komórek występują dwie kopie każdego genu. Dotyczy to również genu HER2. Określając status receptora HER2 metodą FISH, bierze się również pod uwagę, że część komórek znajduje się w fazie podziału komórkowego i tym samym mogą mieć one podwojoną ilość materiału genetycznego. W takim przypadku w dzielącej się komórce stwierdzimy 4 kopie genu HER2. Tak więc za nieprawidłowo wysoką liczbę kopii genu HER2 przyjmuje się wartości powyżej 4 kopii genu w jądrze komórki raka. Obecnie przyjęte są następujące kryteria oceny liczby kopii genu HER2:
do 4 kopii genu w komórce – brak amplifikacji,
5-10 kopii genu w komórce – amplifikacja (niska amplifikacja),
ponad 10 kopii genu w komórce – amplifikacja (wysoka amplifikacja).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Allred D.C., Harvey J.M., Berardo M. et al.: Prognostic and predictive factors in breast cancer by immunohistochemical analysis. Mod Pathol 1998, 11:155-168. 2. Henderson I.C., Patek A.J.: The relationship between prognostic and predictive factors in the management of breast cancer. Breast Cancerres Treat 1998, 52:261-288. 3. Bast R.C., Ravdin P., Hayes D.F. et al.: 2000 update of recommendations for the use of tumor markers in breast and colorectal cancer: clinical practice guidelines of the American Society of Clinical Oncology. J Clin Oncol 2001, 19:1865-1878. 4. Fitzgibbons P.L., Page D.L., Weaver D. et al.: Prognostic factors in breast cancer: College of American Pathologists´ Consensus Statement 1999. Arch Pathol Lab Med 2000, 124:966-978. 5. Di Leo A., Cardoso F., Dubercq V. et al.: Predictive molecular markers in the adjuvant therapy of breast cancer: state of the art in the year 2002. Int J Clin Oncol 2002, 7:245-253. 6. Miles D.W., Harris W.H., Gillett C.E. et al.: Effect of c-erbB2 and estrogen receptor status on survival of women with primary breast cancer treated with adjuvant cyclophosphamide/methotrexate/fluorouracil. Int J Cancer 1999, 84:354-359. 7. Tubbs R.R., Pettay J.D., Roche P.C. et al.: Discrepancies in clinical laboratory testing of eligibility for trastuzumab therapy: apparent immunohistochemical false-positives do not get the message. J Clin Oncol 2001, 19:2714-2721. 8. Menard S., Valagussa P., Pilotti S. et al.: Response to cyclophosphamide, methotrexate, and fluorouracil in lymph node-positive breast cancer according to HER2 overexpression and other tumor biological variables. J Clin Oncol 2001, 19:329-335. 9. Paik S., Bryant J., Tan-Chiu E. et al.: HER2 and choice of adjuvant chemotherapy for invasive breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-15. J Natl Cancer Inst 2000, 92:1991-1998. 10. Slamon D.J., Leyland-Jones B., Shak S. et al.: Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpress HER2. N Engl J Med 2001, 344:783-792. 11. Vogel C.L., Cobleigh M.A., Tripathy D. et al.: Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002, 20:719-726. 12. Leyland-Jones B.: Trastuzumab: hopes and realities. Lancet Oncol 2003, 3:137-144. 13. Olszewski W.T., Mrozkowiak A., Olszewski W.P. i wsp.: Ocena populacyjna ekspresji HER2 w raku piersi w Polsce. Nowotwory 2003, 53:53. 14. Olszewski W.T., Olszewski W.P., Mrozkowiak A. et al.: HER2 status population screening of breast carcinoma in Poland – immunohistochemical evaluation of 5946 cases. Breast Cancer Research and Treatment 2003, 84:604. 15. Olszewski W.P., Mrozkowiak A., Olszewski W.T. i wsp.: Ocena wirygodności badań receptora HER2 metodą immunohistochemiczną. Nowotwory 2003, 53:52. 16. Roche P.C., Suman V.J., Jenkons R.B. et al.: Concordance between local and central laboratory HER2 testing in the Breast Intergroup Trial N9831. J Natl Cancer Inst 2002, 94:855-857. 17. Zujewski J.A.: „Build Quality in” – HER2 testing in the real world. J Natl Cancer Inst 2002, 94: 788-789. 18. Olszewski W.T., Krzakowski M. i wsp.: Rekomendacje Polskiej Grupy Badawczej ds. HER2 Nowotwory 2004, 5:500-505.

