– znaczna oligozoospermia, uniemożliwiająca zapłodnienie w sposób naturalny i w zapłodnieniu pozaustrojowym;
– teratozoospermia – poniżej 4% prawidłowych morfologicznie plemników w ejakulacie (wg ścisłych kryteriów Krugera), w tym globozoospermia;
– powtarzające się niepowodzenia w zapłodnieniu oocytów, po konwencjonalnym zapłodnieniu pozaustrojowym (tj. brak zapłodnień lub zapłodnienie <5% oocytów);
– azoospermia obstrukcyjna – do ICSI używa się wówczas plemników z najądrzy wydobytych drogą punkcji przezskórnej – PESA, lub mikrochirurgicznie – MESA.
– azoospermia z zaburzeniami spermatogenezy – do ICSI używa się plemników uzyskanych drogą biopsji jąder – TESE, TESA.
Techniki wspomaganego rozrodu z użyciem ICSI wymagają aktywnego uczestnictwa w kuracji zdrowej partnerki niepłodnego mężczyzny.
Przygotowanie do zabiegu obejmuje: (3, 21)
1. Kontrolowaną hiperstymulację jajników, przy użyciu analogów GnRH i gonadotropin.
Ma to na celu uzyskanie kilku, optymalnie 5-10 oocytów, aby zwiększyć szansę na zapłodnienie.
2. Punkcję jajników.
Pobranie komórek jajowych odbywa się najczęściej drogą punkcji przezpochwowej pod kontrolą USG, w znieczuleniu ogólnym (tzw. krótkim dożylnym).
3. Przygotowanie oocytów.
Pobrane komórki jajowe muszą być pozbawione warstwy komórek ziarnistych. Stosuje się oczyszczanie enzymatyczne (hialuronidaza), a następnie mechaniczne (pipetki o coraz mniejszej średnicy). Umożliwia to ocenę dojrzałości i jakości oocytów przed zabiegiem. Tylko oocyty w metafazie II (z wydzielonym I ciałkiem kierunkowym) nadają się do zabiegu ICSI.
4. Przygotowanie nasienia.
Nasienie preparuje się na odpowiednikach Percolu (np. Sil Select, Pure Sperm).
Mikromanipulacja – ICSI
Zabieg mikroiniekcji plemnika do komórki jajowej odbywa się przy pomocy mikromanipulatora sprzężonego z mikroskopem. Najważniejszymi narzędziami są szklane mikropipetki: trzymająca (Holding) i iniekcyjna (Injection), o średnicy wewnętrznej odpowiednio 20 i 5 mikrometrów. Oocyty umieszcza się w małych kroplach medium pod parafiną, a wypreparowane plemniki w kropli roztworu poliwinylopirolidonu – PVP.
I etap – Polega na unieruchomieniu wybranego plemnika przez uszkodzenie mu witki (ryc. 1).
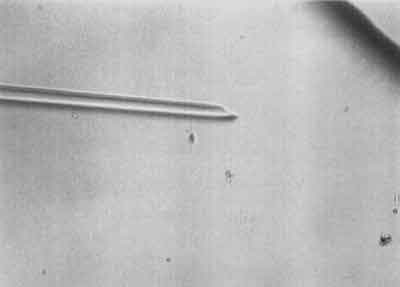
Ryc. 1.
II etap – Wciągnięcie plemnika do pipetki iniekcyjnej (ryc. 2).
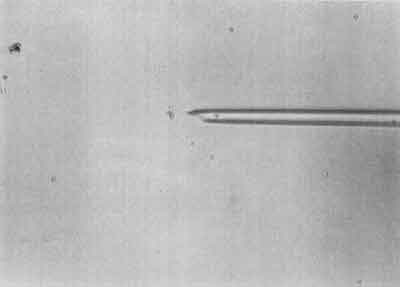
Ryc. 2.
III etap – Za pomocą pipety trzymającej unieruchamia się komórkę jajową w takiej pozycji, aby ciałko kierunkowe znajdowało się na godzinie 6.00, a pipetka iniekcyjna nakłuwała oocyt na godzinie 3.00. W tej pozycji istnieje najmniejsze ryzyko uszkodzenia wrzeciona kariokinetycznego (ryc. 3).
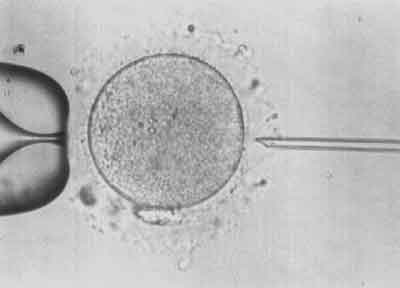
Ryc. 3.
IV etap – Nakłucie otoczki przejrzystej i błony komórkowej oocytu (ryc. 4).
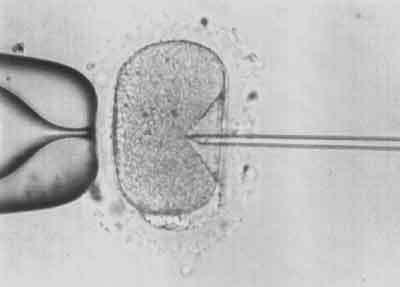
Ryc. 4.
V etap – Aspiracja części cytoplazmy do pipety iniekcyjnej (ryc. 5).
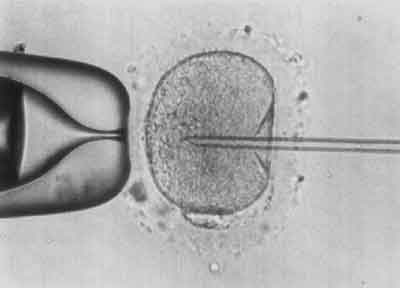
Ryc. 5.
VI etap – Iniekcja plemnika (ryc. 6).
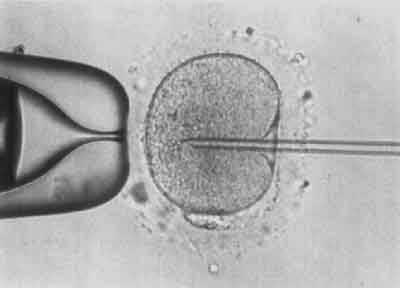
Ryc. 6.
VII etap – Kanał po nakłuciu bardzo szybko przestaje być widoczny. Komórka wraca do pierwotnego stanu (ryc. 7).
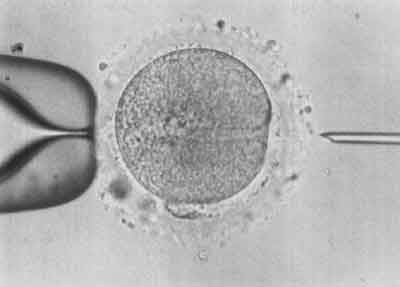
Ryc. 7.
Wyniki
W 18-20 godzin po udanej mikroiniekcji w komórce jajowej pojawiają się dwa przedjądrza – męskie i żeńskie. Świadczy to o prawidłowym zapłodnieniu komórki (ryc. 8). W 48 godzin po mikroiniekcji zapłodniona komórka jajowa jest podzielona na 2-8 blastomerów (ryc. 9).
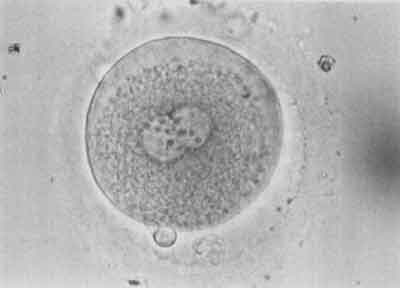
Ryc. 8.
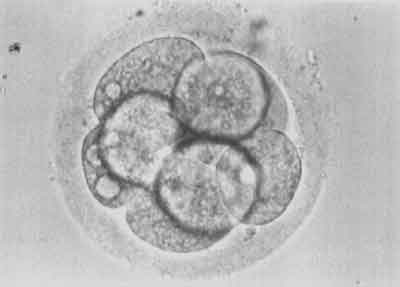
Ryc. 9.
Techniką tą udaje się zapłodnić ok. 60-70% pobranych komórek jajowych (Van Steirteghem, badania własne). Van Steirteghem (16) w latach 1991-97 na 6397 cykli uzyskał 33,6% ciąż. Autorzy w latach 1995-99 na 1372 cykle uzyskali 479 ciąż klinicznych, co daje średnią zajść w ciążę na cykl 34,9%. W piśmiennictwie podkreśla się, że % uzyskanych ciąż po ICSI nie różni się znamiennie od % ciąż uzyskanych w wyniku konwencjonalnego zapłodnienia pozaustrojowego IVF, bez czynnika męskiego. Według badań własnych jednak ilość uzyskanych po IVF jest znacząco niższa i wynosi 22,4% (lata 1995-99). Tłumaczy się to niższym średnim wiekiem pacjentek podchodzących do ICSI, oraz niewystępowaniem u nich, w większości przypadków, innych schorzeń, zaburzających proces zapłodnienia i implantacji.
Bezpieczeństwo metody
Ważnym problemem, wynikającym z szerokiego stosowania ICSI w leczeniu męskiej niepłodności, jest bezpieczeństwo metody. Według badań Van Steirteghema i wsp. (5, 8, 16) istnieje nieznacznie podwyższone ryzyko aberracji chromosomów płciowych u potomstwa poczętego po ICSI. Wynosi ono 0,3-1,6% w porównaniu do 0,19-0,23% populacji dzieci poczętych naturalnie. W pewnym stopniu wiąże się to z częstszym występowaniem tych aberracji u niepłodnych mężczyzn podchodzących do ICSI. Dlatego podstawowym badaniem przed przystąpieniem do leczenia niepłodnej pary z powodu czynnika męskiego jest określenie kariotypu obojga partnerów. Częstość występowania wad u potomstwa poczętego w wyniku ICSI jest podobna jak w ogólnej populacji i wynosi ok. 2,3% (16). W trakcie badań jest problem delecji chromosomu Y jako przyczyny azoospermii i skrajnej oligozoospermii oraz jego dziedziczenia przez męskie potomstwo poczęte dzięki ICSI. Bardzo istotna jest więc stała kontrola nad rozwojem dzieci poczętych dzięki ICSI. Zajmuje się tym program badawczy TASK FORCE ON ICSI powstały przy ESHRE (European Society of Human Reproduction and Embriology – Europejskie Towarzystwo Rozrodu Człowieka i Embriologii) (5).
Czynnik męski – rosnąca rola w rozrodzie wspomaganym
Na przestrzeni mijającego wieku obserwuje się systematyczne pogarszanie jakości męskiego nasienia, a więc bezpośrednio potencjału płodności mężczyzny. Przykładem są klasyczne obserwacje w Skandynawii Skakkebaeka i wsp. Analizując liczbę plemników w ejakulacie w Danii i Finlandii, wykazał znaczny spadek jakości spermy w ciągu ostatnich kilkudziesięciu lat (1, 2, 9). Efektem tego procesu, obok notowanego zmniejszania się populacji w krajach wysoko rozwiniętych Europy i Ameryki związanego ze spadkiem potencjału płodności mężczyzn, jest także ustalenie nowej normy ilości plemników w standardowym badaniu nasienia wg Światowej Organizacji Zdrowia – kryteria WHO – do 20 mln w 1 ml z 60 ml, które obowiązywały w latach poprzednich (17).
W 1999 roku ukazały się bardzo wartościowe i przydatne w praktyce andrologicznej pozycje piśmiennictwa wydawnictwa W.B.Saunders Company: „Male Infertility” red. Philip E. Werthman w serii „Infertility and Reproductive Medicine Clinics of North America” vol. 10, no 3, July 1999 oraz kolejny numer „Urologic Clinics of North America” – Uropathology red. David G. Bostwick vol. 26, no 3, August 1999. W oparciu o artykuły zawarte w powyższych publikacjach można zauważyć ewolucje w odniesieniu do problemu braku potomstwa w obrębie małżeństwa lub pary wywołanej czynnikiem męskim. Wprowadzenie do kliniki niepłodności na początku lat dziewięćdziesiątych (13) (w Polsce styczeń 1995 r. (18)) metody mikromanipulacji – docytoplazmatycznego podania plemnika – ICSI (Intracytoplasmic Sperm Injection) i szerokie upowszechnienie tej metody, spowodowały swoistą rewolucję w podejściu do mężczyzny. Przy konieczności dysponowaniu kilkunastoma żywymi plemnikami potrzebnymi do ICSI, dyskusyjne staje się wdrażanie wielu kosztownych procedur medycznych mających na celu poprawę potencjału płodności pacjenta. Przykładowo, koszt jednej kuracji stymulowania spermatogenezy gonadotropinami LH/FSH wynosi w Polsce ok. 1000 zł, skuteczność jest stwierdzana w około 50%. Wyniki tych terapii często nie pozwalają na uzyskanie ciąży sposobem naturalnym, przy pomocy inseminacji domacicznej IUI czy klasycznego zapłodnienia pozaustrojowego IVF-ET. Ciąża wówczas możliwa jest tylko w protokole ICSI. Drugim ważnym elementem zmiany podejścia do czynnika męskiego jest zwiększająca się edukacja medyczna społeczeństwa. Często, już w czasie pierwszego kontaktu z ośrodkiem leczenia niepłodności, pary wiedzą o metodzie mikromanipulacji (np. z Internetu – www.fertilinet.org). W sytuacji, gdy mają za sobą dłuższy okres „walki” o ciążę, oczekują szybkiego zakwalifikowania ich do tej procedury. Czynnik czasu oczekiwania na uzyskanie ciąży i znacznych kosztów związanych z tradycyjnym sposobem diagnostyki oraz leczenia niepłodnego partnera, często poniesionych już przez pacjentów, są poważnym argumentem we wspólnym (lekarz – para małżeńska) ustalaniu strategii uzyskania dziecka w protokole ICSI. Tak więc, w chwili obecnej coraz więcej uwagi poświęca się na szybkie pozyskiwanie dobrych plemników do ICSI, kosztem dłuższych i kosztowniejszych procedur diagnostycznych i terapeutycznych niepłodnego mężczyzny (18).
Pomimo tych nacisków należy jednak pamiętać, że obniżony potencjał płodności pacjenta wiąże się, ogólnie rzecz ujmując, z patologią gonady męskiej. Zaburzenie funkcji jądra ma wpływ nie tylko na prokreację, ale także na funkcjonowanie organizmu w ciągu całego życia mężczyzny. Dlatego, pomimo szybszego, łatwiejszego i często tańszego rozwiązania problemu niepłodności małżeńskiej, jaką wydaje się być mikromanipulacja ICSI, diagnostyka i terapia andrologiczna są potrzebne nadal.
Diagnostyka zaburzeń płodności męskiej
Bardzo użyteczny schemat diagnostyczny, szczegółowo analizujący niepłodnego mężczyznę, podaje Kim i Lipshultz w numerze Infertility and Reproductive Medicine of North America z lipca 1999 roku (11).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Bostofte E. et al.: Has the fertility of Danish men declined trough the years in terms of semen quality? A comparison of semen qualities between 1952 and 1972. Int. J. Fertil., 1983; 28(2):91-5. 2. Carlsen E. et al.: Evidence for decreasing quality during past 50 years. BMJ, 1992, Sep 12; 305(6054):609-613. 3. Devroey P.: Clinical application of new micro manipulative technologies to treat the male. Hum. Reprod., 1998, 13, Supl. 3:112-120. 4. Domitrz J. i wsp.: Epidemiologia. [W:] Niepłodność. Pisarski T., Szamatowicz M. (red.), PZWL 1997, 13-18. 5. ESHRE Task Force on Intracytoplasmic Sperm Injection: Assisted reproduction by intracytoplasmic sperm injection: a surveyor clinical experience in 1994 and children born after ICSI, carried out until 31 Dec.1993. Hum. Reprod., 1998, 13:1737-1746. 6. Hargreave T.B.: Varicocele: Overview and Commentary on the Results of the World Health Organisation Varicocele Trial. [W:] Current Advanced in Andrology. Proceedings of the VIth International Congress of Andrology. Waites G.M.H., Frick J., Baker G.W.H. (Eds.). Monduzzi Editore Italy 1997. 7. Harrington T.G. et al: Percutaneous testis biopsy: An Alternative to open testicular biopsy in the evaluation of the subfertile man. J. Urol., 1996, 156:1647-1651. 8. IFFS-International Consensus 1998. 9. Jensen T.K. et al.: Semen quality among Danish and Finnish men attempting to conceive. The Danish Fist Pregnancy Planner Study Team. Eur. J. Endocrinol., 2000, Jan; 142(1):47-52. 10. Kass E.J. et al.: Adolescent varicocele: Objective indications for treatment. J. Urol., 1989, 142:579. 11. Kim E.D. et al.: Evaluation and Imaging of the infertile male. [W:] Infertility and Reproductive Medicine Clinics of North America. 1999, 10, 3:377-409. 12. Nistal M. et al.: Testicular biopsy: Contemporary Interpretation. Urologic Clinics of North America, 1999, 26, 3:555-594. 13. Palermo G. et al.: Pregnancies after intracytoplasmic injection single spermatozoon into an oocyte. Lancet, 1992, 340:17. 14. Rombants L. et al.: What about intracytoplasmatic sperm injection? Modern ART in the 2000s. 1998, 117-120. 15. Sigman I. et al.: Evaluation of the subfertile men [W:] Lipshultz L.I., Howards H.H.: Infertility in the Male. Mosby-Year Book, 1997, 173-193. 16. Van Steirteghem A. et al.: Is ICSI the ultimate ART procedure? Fertility and Reproductive Medicine. Fertility and Sterility, 1998, 1:27-36. 17. WHO Laboratory Manual for the Examination of Human semen and Sperm-Cervical Interactions. Cambridge, Cambridge University Press, 1992. 18. Wolski J.K. i wsp.: Własne doświadczenia w przezskórnym pozyskiwaniu plemników do zapłodnienia pozaustrojowego ICSI-PESA oraz ICSI-TESE u mężczyzn z azoospermią obstrukcyjną. Gin. Pol., 1998, 69 (6):545-550. 19. Wolski J.K. i wsp.: Igłowa biopsja jąder w diagnostyce niepłodności męskiej. Gin. Pol., 1998: 69(6):541-544. 20. Wolski J.K.: Żylaki powrózka nasiennego. [W:] Patologia jądra i moszny. Urologia Dziecięca Problemy-Poglądy-Opinie, Wydawnictwo Serverus, Warszawa 1996, 53-57. 21. Wołczyński S. i wsp.: Techniki wspomaganego rozrodu. [W:] Niepłodność. Pisarski T., Szamatowicz M. (red.), PZWL 1997, 311-344.









