© Borgis - Nowa Stomatologia 2-3/2007, s. 61-66
*Dorota Gajdzik-Plutecka1, Janusz J. Bucki2, Anna Denysiuk3, Ewa Prokopowicz3, Przemysław Gajownik4, Katarzyna Łubkowska4, Marta Szańkowska4
Badanie zjawiska wzbogacania w jony fluoru zmineralizowanych tkanek zębów zaopatrzonych w wypełnienia szkło-jonomerowe. Badania własne
The evaluation of the enrichment of mineralized teeth tissues with fluoride ions from GIC filling. Own research
1Zakład Stomatologii Dziecięcej IS AM w Warszawie
Kierownik Zakładu: dr n. med. Aleksander Remiszewski
2Zakład Projektowania Materiału Wydziału Inżynierii Materiałowej Politechniki Warszawskiej
Kierownik Zakładu: prof. dr hab. Krzysztof Kurzydłowski
3Studenckie Koło Naukowe przy Zakładzie Stomatologii Dziecięcej IS AM w Warszawie
Opiekun Koła: dr n. med. Dorota Gajdzik-Plutecka
4Studenckie Koło Naukowe Inżynierii Materiałowej „WAKANS”
Opiekun Koła: dr inż. Janusz J. Bucki

Wstęp
Szkło-jonomery uważane są za materiały, które odznaczają się najsilniejszymi właściwościami kariostatycznymi w porównaniu do innych stosowanych materiałów wypełniających. Wiąże się to z możliwością długotrwałej emisji jonów fluoru ze szkło-jonomerów do otaczającego je środowiska i tym samym stworzenia dogodnych warunków do zachodzenia procesów remineralizacji, wzbogacania struktur zęba w związki fluoru, jak też działania przeciwbakteryjnego.
Wypełnienia z cementów szkło-jonomerowych mogą stanowić rezerwuar jonów fluoru. Oznacza to, że jeżeli stężenie tych jonów w otoczeniu wypełnienia jest wyższe niż w samym materiale (np. po zastosowaniu przez pacjenta past lub płukanek do zębów z fluorem), to wówczas dojdzie do wychwytywania ich przez szkło-jonomery, a następnie uwalniania z materiału w sytuacjach, gdy różnica stężeń będzie odwrotna (1, 2, 3).
CEL PRACY
Celem pracy było zbadanie:
– czy występują różnice w koncentracji jonów fluoru w tkankach zęba będących w bezpośrednim kontakcie z wypełnieniem szkło-jonomerowym w stosunku do pozostałych tkanek tego samego zęba?
– czy czas użytkowania wypełnienia szkło-jonomerowego ma wpływ na stopień koncentracji jonów fluoru wbudowanych w tkanki zęba?
MATERIAŁ I METODY BADAŃ
W wyniku wymiany fizjologicznej uzębienia pozyskano 14 zębów mlecznych z wypełnieniami szkło-jonomerowymi Ketac Molar Aplicap firmy 3M ESPE (ryc. 1). Wypełnienia zakładane były podczas leczenia ubytków próchnicowych różnej głębokości. Najczęściej zlokalizowane były one na powierzchniach bocznych zębów (styczne lub wargowe/policzkowe). Ubytki opracowywane były w sposób tradycyjny, tj. przy użyciu turbiny i mikrosilnika oraz wierteł – stalowych i/lub diamentowych. Przed ich wypełnianiem nie stosowano dodatkowo materiałów podkładowych. Czas „użytkowania” wypełnienia był różny (od 6 miesięcy do 4 lat).

Ryc. 1. Przykład zęba wykorzystanego w badaniu. Pacjent T.H. lat 11
a) ząb 85 z wypełnieniem Ketac Molar Aplicap na powierzchni medialnej,
b) ten sam ząb po wymianie fizjologicznej.
Pod względem wieku wypełnień zęby posegregowano na 3 grupy: grupa I – zęby z wypełnieniami 0,5-1 roku, grupa II – zęby z wypełnieniami 1-2 lata, ponad połowa wszystkich wypełnień to grupa III – zęby z wypełnieniami od 2-4 lat (ryc. 2).
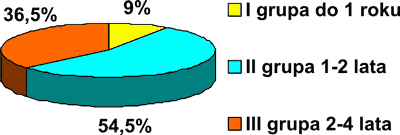
Ryc. 2. Udział procentowy wypełnień w zależności od „wieku” wypełnienia.
Z otrzymanych od pacjentów zębów wykonano preparaty do badania metodą mikroanalizy rtg. Dokonano ich przecięcia poprzecznego prowadząc tak płaszczyznę cięcia, by na przekroju dokładnie uwidocznić miejsce kontaktu wypełnienia (ryc. 3) z tkanką szkliwną – punkt A1 oraz z tkanką zębinową – punkt A2, jak również z tkankami nie będącymi w bezpośrednim kontakcie z wypełnieniem, a nawet dość odległymi od miejsca połączenia wypełnienie – ząb, tj. po przeciwległej ścianie zęba w stosunku do lokalizacji wypełnienia – punkty B1, B2.
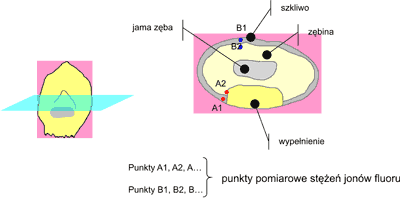
Ryc. 3. Schemat poprzecznego przekroju zęba siecznego z wypełnieniem na powierzchni wargowej, przygotowanego do badania.
Zęby inkludowano w żywicy epoksydowej. Próbki następnie szlifowano przy użyciu wodoodpornych papierów ściernych o różnej gradacji na maszynie Struers Labotom oraz polerowano na tarczach polerskich przy użyciu tlenku glinu. Po dokładnym odtłuszczeniu i umyciu, próbki zostały napylone warstewką węgla (o grubości około 20 nm) i poddano badaniu mikrosondą elektronową SU – 30 firmy CAMECA, wyposażoną w dwa spektrometry rentgenowskie z dyspersją długości fali (WDS – Wavelength Dispersive Sprectrometer). Badania wykonywano przy napięciu przyspieszającym wiązkę elektronów V = 10 kV i prądzie wiązki I = 20 mA.
W każdym punkcie analizy wykonywano 20-sekundowe pomiary natężeń charakterystycznego promieniowania rentgenowskiego badanych pierwiastków oraz 20-sekundowe pomiary natężeń tła, co pozwoliło na zapewnienie precyzji oznaczeń na poziomie 1-3% wartości mierzonych. Określenie stężeń badanych pierwiastków było możliwe dzięki specjalnemu programowi korekcyjnemu, który został opracowany przez firmę CAMECA na podstawie metody Pouchou i Pichoira (4).
Do analizy zawartości fluoru zastosowano wzorzec fluorytu o składzie: 48,67%F, 51,33%Ca oraz kryształ dyfrakcyjny PC1 (2d=6 nm).
Wstępnie dokonano pomiarów zawartości fluoru w szkliwie i zębinie w obranych punktach A1, A2 oraz kontrolnych punktach B1, B2. Następnie na każdej próbce wykonano szereg analiz punktowych, począwszy od miejsca bezpośrednio sąsiadującego z wypełnieniem szkło-jonomerowym, skończywszy w miejscu, w którym czułość tej metody wskazywała na koncentrację fluoru bliską zeru. W ten sposób uzyskano profile koncentracji fluoru w zależności od odległości od wypełnienia.
WYNIKI
Stwierdzono zwiększone stężenie jonów fluoru w tkankach zęba będących w bezpośrednim kontakcie z wypełnieniem szkło-jonomerowym. We wszystkich próbkach zębów odnotowano zawartość fluoru w punktach A1 i A2 – dla tkanki szkliwnej i zębinowej będących w bezpośrednim sąsiedztwie wypełnienia, natomiast dla punktów B1, B2 odnotowano zawartość równą zeru.
Największa koncentracja tego pierwiastka występowała w bezpośrednim sąsiedztwie wypełnienia. W przypadku tkanki szkliwnej najwyższe jego wartości wynosiły 0,025% do 0,15-0,18% wag. F, a w przypadku tkanki zębinowej od 0,6-0,8% do 1,3% wag. F (ryc. 4).
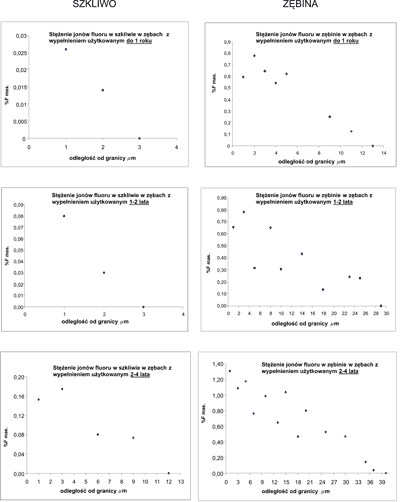
Ryc. 4. Koncentracja jonów fluoru w zębinie i szkliwie w zależności od odległości od granicy ząb-wypełnienie.
W miarę oddalania się od granicy ząb-wypełnienie stężenie jonów F malało. Zasięg dyfuzji jonów fluoru był większy w tkance zębinowej niż w tkance szkliwnej. Dla zębiny wynosił 13-40 ?m, zaś dla szkliwa 3-12 ?m. Koncentracja jonów fluoru w tkankach zmineralizowanych poszczególnych zębów oraz zasięg ich dyfuzji uzależnione są od „wieku wypełnienia”. Im starsze wypełnienia, tym wartości są wyższe (ryc. 5).
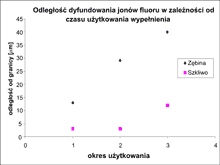
Ryc. 5. Zasięg dyfuzji jonów fluoru w tkankach zmineralizowanych zęba w zależności od czasu użytkowania wypełnienia.
Dla wypełnień I grupy (wypełnienia roczne) najwyższe stężenie jonów fluoru w zębinie wynosiło w granicach 0,6-0,8%, a w szkliwie 0,025%. Zasięg dyfuzji jonów w zębinie wynosił 13 ?m,a w szkliwie 3 ?m (ryc. 6).
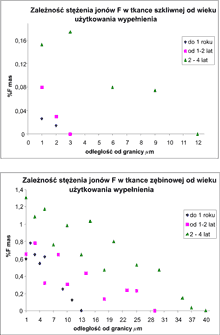
Ryc. 6. Zależność stężenia jonów F- w tkankach szkliwnej (a) i zębinowej (b) w zależności od wieku użytkowania wypełnienia.
Dla najstarszych wypełnień III grupy (wypełnienia 2-4-letnie) najwyższe stężenie wynosiło dla zębiny 1,3%F a dla szkliwa 0,15-0,18% F, zasięg dyfuzji jonów dla zębiny wynosił 40 ?m, dla szkliwa 12 ?m (ryc. 6).
DYSKUSJA
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Mount G., Ngo H.: Stomatologia mało interwencyjna; Med Tour Press International, Warszawa 2006. 2. Graham J,. Mount G., Ngo H.: Aktywność biologiczna glassjonomerów; Stomatologia Współczesna, 2003, Suplement nr 2, 20-24. 3. Prędecka I., Wagner L.: Cementy szkło-jonomerowe - skład jonowy, rola wody i aktywność biologiczna - na podstawie piśmiennictwa, Stomatologia Współczesna; 2004, vol. 11, 4, 55-59. 4. Szummer A., praca zbiorowa: Podstawy ilościowej mikroanalizy rentgenowskiej; WNT, Warszawa 1994. 5. Mielczarek A., i wsp.: Ocena strukturalna i mikroanalityczna szkliwa ludzkiego; Stomatologia Współczesna, 1999, 6, 5, 30-34. 6. Knychalska-Karwan Z., i wsp.: Twarde tkanki zębów u ludzi w młodym, średnim i podeszłym wieku. Badania w elektronowym mikroskopie skaningowym i mikroanalizatorze rtg; Czasopismo Stomatologiczne; 1994, XLVII, 672-680. 7. Knychalska- Karwan Z., Pawlicki R.: Tkanki twarde zębów w Periodontitis juvenile. Badania w mikroskopie optycznym, elektronowym skaningowym oraz mikroanalizatorze rtg, Magazyn Stomatologiczny; 1998, vol. 2, 10-13. 8. Pawlicki R., Knychalska-Karwan Z., Jakób-Doleżał K., Lejman T.: Osteogenesis imperfekta - badania zębów mlecznych w mikroskopie optycznym, elektronowym skaningowym oraz mikroanalizatorze rtg, Czasopismo Stomatologiczne; 1998, LI , 433-440. 9. Pawlicki R., Knychalska-Karwan Z.: Próchnica powierzchni żujących zębów trzonowych. Analiza ilościowa wapnia i fosforanu w mikrosondzie rtg, Czasopismo Stomatologiczne; 1997, L, 4, 243-247. 10. Knychalska-Karwan Z., Pawlicki R.: Próchnica zębów mlecznych w obrazie morfologicznym w SEM i mikroanalitycznym w mikrosondzie rtg ; Czasopismo Stomatologiczne, 1999, LII, 1, 8-13. 11. Stopa J. i wsp.: Jakościowe i ilościowe badanie wczesnych zmian próchnicowych szkliwa przy zastosowaniu różnych technik in vitro; Stomatologia Współczesna, 1995, 5, 2, 84-88. 12. Pawlicki R., Knychalska-Karwan Z.: Hipoplazja szkliwa - badania strukturalne w mikroskopie optycznym, elektronowym, skaningowym oraz analiza w mikrosondzie rtg; Magazyn Stomatologiczny, 1995, 6, 19-23. 13. Knychalska-Karwan Z., Pawlicki R.: Procesy resorpcyjne zębów stałych w obrazach morfologicznych i badaniach mikrosondą rtg, Czasopismo Stomatologiczne; 1995, XLVIII, 632-636. 14. Szczepańska J.: Mikroanaliza rtg szkliwa zębów mlecznych poddanych działaniu fluorku sodu z ksylitolem z wykorzystaniem zewnątrzustnego modelu doświadczalnego in situ, Czasopismo Stomatologiczne; 2001, LIV, 68-76. 15. Szczepańska J.: Analiza pierwiastków wchodzących w skład szkliwa zębów mlecznych w badaniach in vitro po zastosowaniu preparatów remineralizujących zawierających fluorek sodu i ksylitom. Doniesienia wstępne; Czasopismo Stomatologiczne, 1999, LII, 12, 798-803. 16. Brodzikowska A.: Mikroanaliza rtg ognisk próchnicy cementu korzeniowego po zastosowaniu lakieru fluorowego Fluor Protector i chlorheksydynowego Cervitec; Czasopismo Stomatologiczne, 2005, LVIII, 3, 167-174. 17. Stopa J. i wsp.: Badanie strefy połączenia wybranych materiałów złożonych z tkankami zęba metodą mikroanalizy; Stomatologia Współczesna, 2002, 9, 4, 14-17. 18. Drozd J., Hopkała M., Bachanek T., Hopkała J.: Uwalnianie jonów fluorkowych z glass-jonomerowych materiałów stomatologicznych; Stomatologia Współczesna; Suplement nr 2, 2005, 8-14. 19. Wagner L.: Materiały wypełniające uwalniające fluorki w leczeniu próchnicy zębów mlecznych; Med. Tour Press International, Warszawa 2001. 20. Forsten L.: Uwalnianie fluoru z glass-jonomerów; Stomatologia Współczesna, 1995, 2, 3, 219-225. 21. Wagner L., Trykowski J., Miazek- Wagner M.: Badania doświadczalne i kliniczne materiału Ketac Molar; Stomatologia Współczesna, 2001, 7, 1, 39-43. 22. Schiffner U., Saul L.: Release of Fluoride from Glass-Ionomer Cement or Compomer and its Uptake by Enamel under Neutral and Acidic Conditions; Espertise 2004, Scientific Facts, (82 nd IADR Meeting Honolulu, Hawaii, USA, March 10-13 , 2004) 63. 23. Christensen R. P., Ploeger B.J., Hollis R.A., Croll T.P.: Release & Uptake of Fluoride from Fluoride - Containing Dental Materials; J. Dent. Res., 1998, 77, 241, (AADR Abstracts) 1088. 24. Scoville R., Foreman F., Burgess J.: In vitro fluoride uptake by enamel adjacent to a glass-ionomer luting cement; J. Dent. Child, 1990, 57, 352-355. 25. Forsten L., Rytomaa I., Antilla A., Keinonen J.: Fluoride uptake from restorative dental materials by human enamel. Scan, J. Dent. Res.; 1976, 84, 391-396. 26. Jodkowska E., Raczyńska M., Sikorski K.: Ocena ilościowa fluoru wbudowanego do twardych tkanek zęba - badanie metodą mikroanalizy rtg; e-Dentico, 2005, nr 4(8), 30-35. 27. Ngo H.: Ostatnie osiągnięcia w dziedzinie glassjonomerów, Stomatologia Współczesna; 2004, vol. 11, 1, 8-13. 28. Szpringer-Nodzak M., Wochna-Sobańska M.: Stomatologia wieku rozwojowego; PZWL, Warszawa 2003. 29. Jodkowska E., Wagner L.: Wprowadzenie do ćwiczeń przedklinicznych z materiałoznawstwa. Materiały stosowane w stomatologii zachowawczej i endodoncji, 2005, 26-37.







