© Borgis - Nowa Stomatologia 2/2005, s. 81-88
Monika Kozarzewska1, Andrzej Wojtowicz1, Jolanta Siemińska2
Rola metaloproteinaz w etiopatogenezie zębopochodnych torbieli kości szczęk
The role of metalloproteinases in detal cyst development
1z Zakładu Chirurgii Stomatologicznej Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: dr hab. n. med. Andrzej Wojtowicz
2z Katedry i Zakładu Fizjologii Doświadczalnej i Klinicznej AM w Warszawie
Kierownik Katedry: prof. dr hab. med. Ewa Szczepańska-Sadowska

WPROWADZENIE
Zębopochodne torbiele kości szczęk stanowią istotny problem w chirurgii stomatologicznej ze względu na częstość ich występowania oraz progresywny charakter wzrostu odbywający się kosztem otaczających tkanek.
W powstawaniu zmian zapalnych dominującym jest czynnik zapalny pochodzący z kanału zęba, którego miazga uległa obumarciu, zakażeniu i zgorzelinowemu rozpadowi oraz obecność w tkankach okołowierzchołkowych przetrwałych komórek Malasseza (1, 2). Zaburzenie procesu organogenezy sprzyja powstaniu zmian rozwojowych (3). Przyczyny te są ogólnie znane i przyjęte ale, jak się wydaje, nie jedyne. Obecnie podkreśla się znaczący udział w powstaniu i wzroście torbieli cytokin, czynników wzrostu, białek i enzymów wydzielanych przez komórki nabłonka, inne komórki ściany torbieli oraz komórki immunokompetentne.
Agresywność wzrostu zmian o charakterze torbieli zależy od stopnia zaburzenia równowagi pomiędzy czynnikami stymulującymi procesy degradacji tkanki kostnej, a czynnikami pobudzającymi procesy jej gojenia.
W powstaniu okołowierzchołkowych ognisk osteolizy i ich wzrostowi bierze udział wiele czynników m.in. enzymy proteolityczne, przede wszystkim metaloproteinazy mające zdolność degradowania elementów macierzy zewnątrzkomórkowej (4-9). Enzymy te są produkowane i wydzielane przez większość typów komórek. Zdolność taką posiadają komórki nabłonka, fibroblasty, keratynocyty, komórki endotelium, osteoblasty, makrofagi i komórki nacieku zapalnego: monocyty, limfocyty jednojądrzaste, leukocyty (8, 10-15).
Metaloproteinazy produkowane i wydzielane są jako nieczynne enzymy a ich aktywacja następuje w środowisku zewnątrzkomórkowym poprzez odłączenie peptydu o masie od 9-10 kDa (np.: MMP-1, MMP-2, MMP-3) do 20 kDa (np.: MMP-8) z N-końcowego regionu enzymu, przy współudziale dwuwartościowych jonów wapnia i cynku (Ca 2+, Zn 2+). Zależności tej enzymy zawdzięczają swoją nazwę (16).
Ze względu na różnice strukturalne, specyfikę substratu oraz mechanizm działania ustalono klasyfikację metaloproteinaz (5, 6, 10, 15, 17):
– KOLAGENAZY MMP-1, MMP-8 – niszczą kolagen typu I, II, III, VII, VIII, X;
– ŻELATYNAZY MMP-2, MMP-9 – degradują kolagen typu IV, V, VII, IX, fibronektynę i elastynę, działają synergistycznie z kolagenazami;
– STROMIELIZYNY MMP-3, MMP-10 – niszczą kolagen błony podstawnej, proteoglikany i glikoproteiny macierzy zewnątrzkomórkowej;
– metaloproteinazy typu błonowego;
– INNE: melastaza, matrylizyna.
Metaloproteinazy są enzymami proteolitycznymi biorącymi udział w degradacji elementów macierzy zewnątrzkomórkowej, w przebudowie tkanki łącznej zarówno w warunkach fizjologicznych (np.: w procesie wyrzynania zębów) jak i w patologicznej degradacji tkanki łącznej. Ich zwiększoną aktywność obserwuje się w wielu chorobach: zmianach pęcherzowych skóry, stwardnieniu rozsianym, reumatoidalnym zapaleniu stawów, chorobach przyzębia, owrzodzeniach błony śluzowej (15, 18-20). Niektóre z tych proteinaz mają znaczenie także w procesie resorpcji tkanki kostnej. Są to MMP-1, MMP-2 oraz MMP-3. Mechanizm ich działania polega na niszczeniu niezmineralizowanych elementów osteoidu i tym samym odsłonięciu części zmineralizowanej na działanie osteoklastów (5, 7, 16, 21-31).
MECHANIZM DZIAŁANIA
MMP-3 niszczy proteoglikany i fibrynogen
MMP-1 niszczy spiralę głównych typów kolagenu eksponując niezmineralizowany osteoid na działanie osteoklastów
MMP-2 usuwa rozszczepiony kolagen
W przypadku powstania i wzrostu torbieli zębopochodnych metaloproteinazy zapoczątkowują resorpcję tkanki kostnej indukowanej poprzez mikroorganizmy, ich toksyny i czynnik zapalny dwoma drogami poprzez:
1. produkty bakteryjne (endotoksyny, enzymy, lipopolisacharyd) stymulujące obecne i napływające komórki do produkcji i wydzielania metaloproteinaz,
2. produkty bakteryjne wywołujące odpowiedź immunologiczną makrofagów i innych komórek nacieku zapalnego uruchamiając kaskady cytokin zapalnych jak TNF a, TGF b, IL-1, IL-6. One indukują produkcję metaloproteinaz na drodze autokrynnej lub parakrynnej, pobudzają do produkcji MMPs także keratynocyty, fibroblasty, komórki nabłonka, osteoblasty (10, 13, 27, 32-35).
Należy podkreślić, że te same cytokiny mogą w odmienny sposób regulować produkcję enzymów przez różne typy komórek, jak również poszczególne cytokiny mogą oddziaływać na siebie synergistycznie bądź antagonistycznie (4, 6, 10, 13, 15, 27, 32, 34, 36-40).
Działanie metaloproteinaz ogranicza również specyficzność substratu – kolagen, pH środowiska (pH neutralne lub lekko zasadowe = 8) oraz tkankowe inhibitory TIMPs (41). Głównym inhibitorem jest niespecyficzna glikoproteina TIMP-1 produkowana przez większość komórek. Drugim jest proteina TIMP-2 wydzielana przez fibroblasty i komórki endotelium specyficzna dla MMP-2. Hamują one aktywność kolagenolityczną MMPs przez trwałe wiązanie części aktywnej enzymu (17, 22, 27, 34, 38, 42, 43). Aktywność tkankowych inhibitorów metaloproteinaz podlega także regulacji przez odpowiednie cytokiny np.: interleukinę 1(IL-1) (7, 35, 44).
Zaburzenie równowagi pomiędzy ekspresją metaloproteinaz a ich tkankowych inhibitorów inicjuje degradację tkanki kostnej i sprzyja agresywnemu wzrostowi zmian patologicznych, także o charakterze torbieli (5, 13, 15, 23).
CEL PRACY
Celem pracy była immunohistochemiczna ocena ekspresji metaloproteinaz MMP-1, MMP-2, MMP-3 oraz ich tkankowego inhibitora TIMP-1 w komórkach nabłonka i komórkach ściany torbieli zębopochodnych oraz porównanie aktywności tych czynników w różnych typach torbieli: zapalnych, zawiązkowych oraz keratocystach.
MATERIAŁ I METODY
Analizie poddano materiał tkankowy zębopochodnych torbieli uzyskany podczas zabiegów wyłuszczenia zmian z jednoczesną ekstrakcją zębów i/lub resekcją wierzchołków korzeni zębów u pacjentów leczonych w Zakładzie Chirurgii Stomatologicznej IS AM w Warszawie.
Pobrany materiał utrwalono w 10% roztworze formaliny. Wykonano parafinowe preparaty histologiczne o grubości 7 mm, które następnie poddano badaniu histopatologicznemu oraz barwieniu immunohistochemicznemu w trybie zgodnym z zaleceniami producenta odpowiednich przeciwciał, z wykorzystaniem techniki odsłaniania epitopów w buforze cytrynianowym, w kuchence mikrofalowej. Barwieniom poddano 50 preparatów torbieli korzeniowych, 32 preparaty torbieli zawiązkowych oraz 6 preparatów keratocyst. W badaniu porównawczym, jako grupę kontrolną, oceniono mieszek zęba zatrzymanego (7 preparatów) oraz zdrową błonę śluzową dziąsła (10 preparatów). W celu uzyskania i uwidocznienia ekspresji wybranych enzymów użyto króliczych przeciwciał poliklonalnych anty- MMP-1, anty-MMP-2, anty-MMP-3 oraz anty-TIMP-1 firmy CHEMIKON. Barwienia wykonano jednoczasowo dla danego przeciwciała z zachowaniem tych samych warunków. Preparaty oceniane były w mikroskopie świetlnym ECLIPSE E-400 i fotografowane cyfrowo w systemie NIKON-COOLPIX.
Ekspresję poszczególnych metaloproteinaz i ich inhibitora w komórkach nabłonka i komórkach ściany torbieli oceniano w przyjętej skali:
+++ (+3) wysoka ekspresja
++ (+2) średnia ekspresja
+ (+1) niska ekspresja
0 brak ekspresji
- (-1) brak danych
Oceniono również wpływ stopnia nasilenia ekspresji poszczególnych, badanych czynników na procesy naprawcze, obronne ze strony otaczającej torbiel tkanki kostnej. Wykorzystano w tym celu, wykonane przed zabiegiem chirurgicznym, badanie radiologiczne (zdjęcia zębowe wykonane techniką kąta prostego oraz pantomogramy). Oceniono obecność zagęszczonej struktury kostnej, w postaci otoczki osteosklerotycznej, w bezpośrednim sąsiedztwie zmiany.
Otrzymane wyniki poddano analizie statystycznej testami t–Studenta oraz c2 przyjmując poziom istotności p<0,05. Wynik p<0,01 uznano za wysoce istotny statystycznie.
WYNIKI
W przeprowadzonych badaniach immunohistochemicznych w zdecydowanej większości przypadków uzyskano wysokie lub średnie nasilenie ekspresji metaloproteinaz (ryc. 1-3).
Ekspresja stromielizyny (MMP-3) odpowiedzialnej za zapoczątkowanie procesu degradacyjnego tkanki kostnej najsilniej manifestowała się w torbielach zawiązkowych. W 33% przypadków stwierdzono silną reakcję w komórkach nabłonkowych, komórkach ściany torbieli, w 27% badanie wykazało średnią ekspresję MMP-3. W przypadkach zapalnych torbieli silną i średnią odpowiedź wykazało 54%. We wszystkich przypadkach torbieli pierwotnej stwierdzono reakcję dodatnią a 1/3 keratocyst ujawniła wzmożoną ekspresję na ten typ enzymu. Brak ekspresji MMP-3 stwierdzono tylko w 10% torbieli zawiązkowych i w 4% korzeniowych. W usuniętych mieszkach zębowych zębów zatrzymanych w 57% przypadków oraz 10% zdrowej błony śluzowej dziąsła badanie wykazało słabą ekspresję. W zdecydowanej większości (90%) zdrowa tkanka dziąsła nie ujawniła ekspresji (ryc. 1).
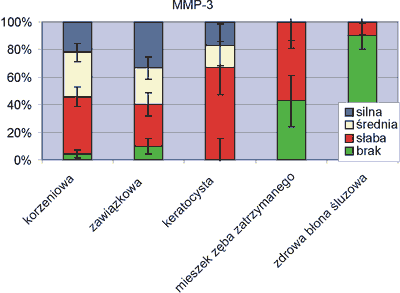
Ryc. 1. Ekspresja czynnika MMP-3.
W zapalnych zmianach korzeniowych silną i średnią ekspresję MMP-1 degradującej kolagen manifestowało ponad 84% przypadków, w torbielach zawiązkowych 74% oraz wszystkie badane przypadki torbieli pierwotnych, keratocyst. Wzmożoną ekspresję stwierdzono w komórkach nabłonka, fibroblastach oraz innych komórkach ściany torbieli, także nielicznych osteoblastach, komórkach napływowych, makrofagach, monocytach oraz w środowisku pozakomórkowym. Reakcja immunohistochemiczna MMP-1 ujawniła się we wszystkich przypadkach badanych zmian niezależnie od rodzaju torbieli (ryc. 2).
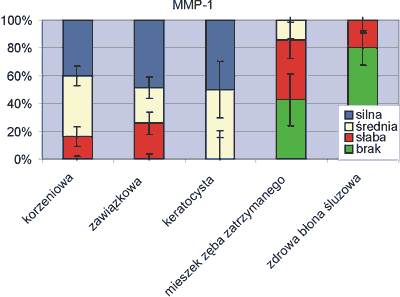
Ryc. 2. Ekspresja czynnika MMP-1.
W przypadkach mieszków zębowych zębów zatrzymanych tylko w 14% stwierdzono średnie nasilenie reakcji, w prawie 86% było ono słabe bądź nieoznaczalne. Zdrowa błona śluzowa właściwie nie wykazała ekspresji czynników proteolitycznych. W 80% przypadków nie stwierdzono reakcji immunohistochemicznej MMP-1, w 20% była ona słaba (ryc. 2).
Ekspresję MMP-2 usuwającej zdenaturowany, rozszczepiony kolagen przedstawia rycina 3. Wzmożoną ekspresję stwierdzono w ponad 60% przypadków zmian patologicznych: w 58% torbieli korzeniowych, 68% zawiązkowych i 67% przypadków keratocyst. Tkanki mieszka zębowego i zdrowej błony śluzowej w zdecydowanej większości nie wykazały reakcji dodatniej.
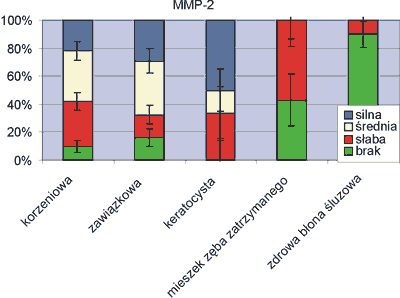
Ryc. 3. Ekspresja czynnika MMP-2.
Naturalnym czynnikiem regulującym czynność metaloproteinaz jest ich tkankowy inhibitor TIMP-1. Przeprowadzone barwienie immunohistochemiczne wykazało silną ekspresję jedynie w 16% torbieli zawiązkowych i 22% zmian korzeniowych. Średnie nasilenie reakcji zaobserwowano w 19% torbieli zawiązkowych i 28% korzeniowych. Torbiele pierwotne nie wykazały wzmożonej reakcji. We wszystkich tych przypadkach stwierdzono słabą odpowiedź lub jej brak. Podobny wynik uzyskano w połowie przypadków torbieli zapalnych oraz w 65% torbieli zawiązkowych.
Komórki mieszka zęba zatrzymanego w 14% ujawniły średnią ekspresję TIMP-1, w 86% słabą lub negatywną. Zdrowa błona śluzowa nie wykazała nasilonej ekspresji inhibitora (ryc. 4).
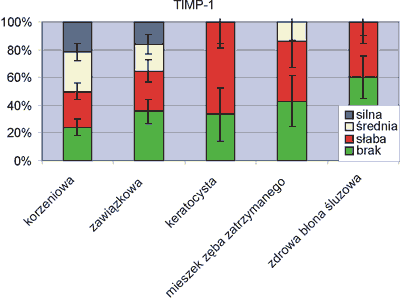
Ryc. 4. Ekspresja czynnika TIMP-1.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Formigli L. et al.: Osteolytic processes in human radicular cysts: morphological and biochemical results. J. Oral. Pathol. Med. 1995, 24: 216-220.2. Lin S.K. et al.: Apical periodontal cyst: a clinicopathologic study of 405 cases. Chin. J. Oral. Maxillofac. Surg. 1993, 4:106-119.3. Shear M.: Cysts of the jaw: recent advances. J. Oral. Pathol. Med. 1985, 14:43-59. 4.Birkedal Hansen H.: Role of matrix metalloproteinases in human periodontal diseases. J. Periodontol. 1993 May 64: 5 Suppl., 474-484.5. Birkedal Hansen H. et al.: Matrix metalloproteinases: a review. Cit. Rev. Oral. Biol. Med. 1993, 4: 2, 197-250. 6. Bord S. et al.: Stromelysin-1 (MMP-3) and Stromelysin-2 (MMP-10) Expression in Developing Human Bone: Potential Roles in Skeletal Development. Bone 1998, 23,1: 7-12. 7.Chambers T.J., Fuller K.: Bone cells predispose bone surfaces to resorption by exposure of mineral to osteoclastic contact. J Cell Sci 1985, 76:155-165.8. Lorenzo J.A. et al.: Production of both 92- and 72-kDa gelatinases by bone cells. Matrix 1992, 12:282-290.9. Teronen O. et al.: Gelatinases? Type IV collagenases in jaw cyst expansion. Ann N Y Acad Sci 1994, 732:486-488. 10.Birkedal Hansen H.: Role of cytokines and inflammatory mediators in tissue destruction. J. Periodontal. Res. 1993, Nov, 28:500-510. 11. Golub L. et al: Treating periodontal diseases by blocking tissue destructive enzymes. J. Am. Dent. Assoc. 1994, 125:163-169.12. Larry M., Corcoran W.: Regulation of Monocyte/Macrophage Metalloproteinase Production by Cytokines. J. Periodontol. 1993, 64:467-473. 13.Lin S.K. et al.: Immunolocalization of interstitial collagenase (MMP-1) and tissue inhibitor of metalloproteinases -1 (TIMP-1) in radicular cysts. J. Oral. Pathol. Med. 1997, 26:458-463. 14.Mundy G.R.: Role of cytokines in bone resorption. J Cell Biochem 1993, 53:296-300.15. Ryan M. et al.: Matrix metalloproteinases and their inhibitor in periodontal treatment. Current Opinion in Periodontology 1996, 3:85-96.16. Kusano K. et al.: Regulation of Matrix Metalloproteinases (MMP-2,-3,-9 and -13) by Interleukin-1 and Interleukin-6 in Mouse Calvaria: Association of MMP Induction with Bone Resorption Endocrin 1998, 139, 3:1338-1345.17. Rifas L. et al.: Expression of Metalloproteinases and Tissue Inhibitors of Metalloproteinases in Human Osteoblast-Like Cells: Differentiation Is Associated with Repression of Metalloproteinase Biosynthesis. Endocrinol 1994, 134, 1:213-221. 18. Beertsen W. et al.: On the role of MT-MMP, a matrix metalloproteinase essential to collagen remodeling, in murine molar eruption and root growth. Eur. J. Oral. Sci. 2002, 110:445-451.19. Golub L.M. et al.: A matrix metalloproteinase inhibitor radiuses bone-type collagen degradation fragments and specific collagenases. Inflamm. Res. 1997, Aug, 46:8, 310-319.20. Marks S.C. Jr., Cahill D.R.: Regional control by the dental follicle of alterations in alveolar bone metabolism during tooth eruption. J. Oral. Pathol. 1987, 16:164-169.21. Aimes R.T., Quigley J.P.: Matrix metalloproteinase-2 is an interstitial collagenase. J. Biol. Chem. 1995, 270:5872-5876. 22.Bord S. et al.: Distribution of matrix metalloproteinases and their inhibitor TIMP-1 in developing human osteophytic bone. J. Anat. 1997, 191:39-48. 23.Cawston T. et al.: Role of TIMP and MMP inhibition in prevening connective tissue breakdown. Ann. N. Y. Acad. Sci. 1994, 732:75-83.24. Delaisse J.M. et al.: (Pro) collagenase (matrix metalloproteinase-1) is present in rodent osteoclasts and in the underlying bone-resorbing compartment. J. Cell. Sci. 1993, 106:1071-1082.25. Fuller K., Chambers T.J.: Localisation of mRNA for collagennase in osteolytic bone surface and chondrocytic cells but not osteoclasts. J. Cell. Sci. 1995, 108:2221-2230. 26.Hill P.A. et al.: The effects of selective inhibitors of matrix metalloproteinases (MMPs) on bone resorption and the identification of MMPs and TIMP-1 in isolated osteoclasts. J. Cell. Sci. 1994, 107:3055-3064. 27.Nędzi-Góra M., Górska R.: Rola metaloproteinaz w chorobach przyzębia. Przegląd literatury. Nowa Stomatologia 2001, 1, 15:46-49.28. Sakamoto S., Sakamoto M.: Isolation and characterization of collagenase synthesized by mouse bone cells in culture. Biomed. Res. 1984, 5:39-46. 29.Teitelbaum S.L. et al.: Cellular and molecular mechanisms of bone resorption. Miner. Electrolyte. Metab. 1995, 21:193-196.30. Teitelbaum S.L. et al.: Molecular mechanisms of bone resorption. J. Cell. Biochem. 1995, 59:1-10. 31.Teronen O. et al.: Characterization of interstitial collagenases in jaw cyst wall. Eur. J. Oral. Sci. 1995, 103: 141-147. 32.Deuren M.V. et al.: Cytokines and the response to infection. J. Pathol. 1992, 168:349-356.33. Golub L.M. et al.: Doxycycline inhibits neutrofil (PMN)-type matrix metalloproteinases in human adult periodontitis gingival, J. Clin. Periodontol. 1995, Feb, 22:2, 100-109. 34.Reynolds J.J., Meikle M.C.: The functional balance of metalloproteinases and inhibitors in tissue degradation: relevance to oral pathologies. J. R. Coll. Surg. Edinb. 1997, Jun, 42:3, 154-160.35. Woessner J.F.: Matrix metalloproteinases and their inhibitors in connective tissue remodelling. FASEB J. 1991, 5:2145-2154.36. Bando Y. et al.: Immunocytochemical localisation of inflammatory cytokines and vascular adhesion receptors in radicular cysts. J. Oral. Pathol. Med. 1993, 22:221-227.37. Page R.C.: The role of inflammarory mediators in the pathogenesis of periodontal diseases. J. Periodontal. Res. 1991, May, 26:3 Pt 2, 230-242. 38.Reynolds J.J.: Collagenases and tissues inhibitors of metalloproteinases: functional balance in tissue degradation. Oral. Dis. 1996, Mar, 2:1, 70-76.39. Walker K. et al.: Cytokine expression in periapical granulation tissue as assessed by immunohistochemistry. Eur. J. Oral. Sci. 2000, 108:195-201.40. Zeng G. et al.: Endogenous TGF â is modified during cellular aging: Effects on metalloproteinase and TIMP-1 expression. Exp. Cell. Res. 1996, 228:271-276.41. Korostoff J.M. et al.: Analysis of in situ protease activity in chronic adult periodontitis patients: expression of activated MMP-2 and a 40-kDa serine protease. J. Periodontol. 2000, Mar, 71:3, 353-360.42. Reynolds J.J. et al.: Connecive tissue degradation in health and periodontal disease and roles of metalloproteinases and their natural inhibitors. Adv. Dent. Res. 1994, Jul, 8:2, 312-319.43. Rifas L. et al.: Human osteoblasts in vitro secrete tissue inhibitor of metalloproteinases and gelatinase but not interstitial collagenase as major cellular products. J. Clin. Invest. 1989, 84:686-694.44. Everts V. et al.: The release of tissue inhibitor of metalloproteinases by calvarial bone and its immunolocalization. Bone and Mineral 1993, 22:43-55. 45.Woessner J.F.: The family of matrix metalloproteinases. Ann. N. Y. Acad. Sci. 1994, 732:11-21.46. Sorsa T. et al.: Type-specyfic degradation of interstitial collagens by human keratocyst capsule collagenase. Med. Sci. Res. 1988, 16:1189-1190.47. Meikle M.C., Hembry R.M., Holley J. et al.: Immunolocalization of matrix metalloproteinases and TIMP-1 in human gingival tissues from periodontitis patients. J. Periodont. Res. 1994, 29:118-26.48. Teronen O. et al.: Identification and chatacterisation of gelatinase? Type IV collagenase in jaw cysts. J. Oral. Pathol. Med. 1995, 24:78-84.





