© Borgis - Nowa Stomatologia 2/2005, s. 98-102
Marcin Kacprzak, Jan Kowalski
Zastosowanie masy płytkowej (Platelet Rich Plasma – PRP) w chirurgicznym leczeniu zapalenia przyzębia – opis przypadku
The use of platelet rich plasma in surgical treatment of aggressive periodontitis – case report
z Zakładu Chorób Błony Śluzowej i Przyzębia Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: prof. Renata Górska

Współczesny rozwój periodontologii podąża w kierunku nie tylko trwałego wyleczenia choroby, ale przede wszystkim przywrócenia prawidłowej bądź możliwie optymalnej budowy i funkcji struktur, które uległy uszkodzeniu czy zniszczeniu w przebiegu procesu zapalnego tkanek przyzębia. Od początku lat siedemdziesiątych prowadzone są nieustanne badania nad regeneracją tkanek przyzębia. Termin regeneracja oznacza odtworzenie tkanek z zachowaniem takiej samej budowy i funkcji (11, 12). W zapaleniach przyzębia mamy do czynienia ze zniszczeniem przyczepu łącznotkankowego, ozębnej i cementu korzeniowego, a wtórnym efektem jest także zniszczenie kości wyrostka zębodołowego. Celem sterowanej regeneracji tkanek (Guided Tissue Regeneration – GTR) jest odtworzenie tych czterech struktur. Proces regeneracji znacznie różni się od reparacji, która najczęściej występuje w procesie naturalnego gojenia, odtwarzając ciągłość tkanek bez przywrócenia im zróżnicowania budowy i funkcji (6, 7, 11, 13). W wyniku zabiegów reparacyjnych dochodzi do spłycenia kieszonek na skutek wytworzenia długiego przyczepu nabłonkowego i blizny łącznotkankowej. Procesy sterowanej regeneracji tkanek zależą od aktywacji kaskady czynników wzrostowych działających najczęściej autokrynnie lub parakrynnie (9,10). Od wielu lat periodontolodzy zadawali sobie pytanie, w jaki sposób najlepiej, najszybciej i najskuteczniej zregenerować tkanki uszkodzone w przebiegu procesu zapalnego. Marx i wsp. oraz Lynch, zaproponowali wykorzystanie autogennej masy płytkowej do wytworzenia żelu płytkowego (8). Płytki są izolowane i zagęszczane z krwi pacjenta na drodze tromboforezy. Nośnikiem dla płytek jest obecna w osoczu fibryna oraz cząstki adhezyjne – adhezyny i integryny warunkujące przyleganie komórek. Badania prowadzone nad osoczem bogatym w płytki krwi (platelet rich plasma – PRP) pozwoliły zidentyfikować trzy ważne czynniki wzrostu występujące w ziarnistościach alfa trombocytów (9):
? PDGF,
? TGFb1,
? TGFb2,
? IGF I.
PDGF jest glikoproteiną wytwarzaną przede wszystkim w płytkach, ale także syntetyzowaną przez inne komórki, jak makrofagi i komórki śródbłonka. PDGF jest złożony z dwóch łańcuchów A i B. Dzięki obecności płytek w skrzepie krwi, PDGF jest pierwszym czynnikiem wzrostu w ranie, stymulującym rewaskularyzację, syntezę kolagenu i regenerację kości. Bierze on także udział w większości procesów gojenia dzięki podwójnej roli płytek będących nie tylko rezerwuarem czynników wzrostu, ale także uczestniczących w procesie powstawania skrzepu. PDGF pozytywnie wpływa na proces gojenia rany poprzez:
? mitogenezę – zwiększenie liczby komórek naprawczych,
? angiogenezę,
? regulację działania innych czynników wzrostu i komórek (5).
TGFb to termin przyjęty dla nadrodziny czynników wzrostu i różnicowania, wśród których znajdują się także morfogenetyczne białka kostne (Bone Morphogenetic Proteins – BMP´s). Wśród TGF obecnych w PRP stwierdzono TGFb1 i TGFb2, które są podstawowymi czynnikami wzrostu i różnicowania w procesach gojenia tkanki łącznej i regeneracji kości. TGFb1 i TGFb2 są glikoproteinami produkowanymi przez trombocyty, choć spotykanymi także w makrofagach i osteoblastach. TGFb1 i TGFb2 uwolnione przez degranulację płytek lub aktywnie wydzielane przez makrofagi działają jako parakrynny czynnik wzrostu na fibroblasty, niezróżnicowane komórki szpiku i preosteoblasty. Ponadto komórki docelowe mają zdolność do syntezy i wydzielania własnego TGFb, który działa para- i autokrynnie, dzięki czemu staje się czynnikiem wzrostu, który nie tylko inicjuje regenerację kości, ale może również podtrzymywać długotrwałe gojenie. Najważniejszą jednak funkcją TGFb wydaje się być chemotaksja i mitogeneza prekursorów osteoblastów, oraz zdolność do stymulowania odkładania kolagenu w procesie gojenia tkanki łącznej i tworzenia kości. TGFb hamuje także powstawanie osteoklastów i resorpcję kości (1, 5), oraz inhibuje wzrost epiteliocytów (8).
Z kolei IGF I i IGF II uważane są za czynniki wzrostu wydzielane przez osteoblasty w procesie formowania kości, co prowadziło do zwiększenia liczby osteoblastów i przyspieszenia odkładania kości. Końcowym efektem IGF jest mitogeneza komórek odpowiedzialnych za tworzenie kości. IGF są ponadto zdeponowane w macierzy kości, zatem kiedy dochodzi do postępującej resorpcji kości IGF są uwalniane w celu połączenia procesów tworzenia i resorpcji kości. Przypuszcza się, że obecność IGF w płytkach działa na osteoblasty i ich prekursory. Dzięki temu IGF działają nie tylko jako czynnik mitogenny dla preosteoblastów, ale także jako stymulator tworzenia kości przez zróżnicowane już osteoblasty. Autogenne PRP jest nietoksyczne i nieimmunizujące, moduluje i reguluje funkcje kolejno oddziałujących czynników wzrostu w procesie tworzenia i dojrzewania tkanek. Naturalne czynniki wzrostu zawarte w masie płytkowej różnią się od rekombinowanych tym, że działają w określonej sekwencji i na zasadzie wzajemnych stężeń wpływając na procesy proliferacji i różnicowania komórek, podczas kiedy pojedynczy, rekombinowany czynnik wzrostu działa tylko na jeden określony proces i nie może funkcjonować prawidłowo w gojącej się ranie (2, 5).
Na podstawie przedstawionych powyżej mechanizmów działania masa płytkowa w połączeniu z materiałem kościozastępczym wydaje się doskonałym połączeniem w sterowanej regeneracji tkanek przyzębia. Od drugiej połowy lat 90-tych ubiegłego stulecia pojawiały się doniesienia o stosowaniu PRP w chirurgii periodontologicznej. Niedawno pojawiły się także doniesienia, w tym autorów polskich, o stosowaniu PRP w leczeniu recesji dziąseł (3) oraz przy elewacji zatoki szczękowej przed planowanym zabiegiem wszczepienia implantu zębowego (4). Nie jest to jednak powszechnie uznana metoda postępowania i nie ma wciąż dowodów na bezsprzecznie korzystny wpływ masy płytkowej na procesy regeneracyjne.

Ryc. 1. Wirówka do frakcjonowania krwi obwodowej.
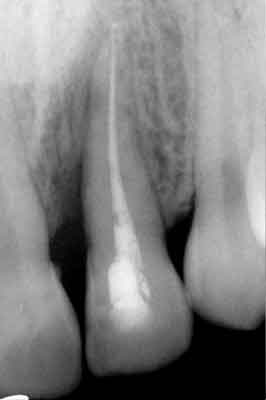
Ryc.2. Ząb 31 – stan po zakończeniu leczenia przyczynowego.
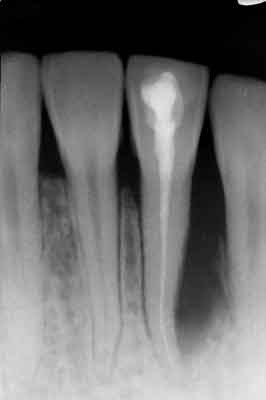
Ryc. 3. Ząb 21 – stan po zakończeniu leczenia przyczynowego.
W Zakładzie Chorób Błony Śluzowej i Przyzębia IS AM w Warszawie prowadzone są badania nad zastosowaniem PRP w połączeniu z preparatem Bio-Oss(r) (Geistlich, Szwajcaria) w chirurgicznym leczeniu agresywnego lub przewlekłego ciężkiego zapalenia przyzębia.
OPIS PRZYPADKU
22-letnia pacjentka została skierowana przez lekarza stomatologa z przychodni rejonowej do Zakładu Chorób Błony Śluzowej i Przyzębia IS AM w Warszawie z powodu zaawansowanego stanu chorobowego przyzębia. W chwili zgłoszenia się do Zakładu w styczniu 2004 roku pacjentka od trzech lat była leczona ortodontycznie.
W trakcie badania klinicznego stwierdzono obecność pionowych ubytków tkanki kostnej w okolicy zębów 21-22 oraz 31-32.
Na podstawie badania klinicznego i radiologicznego rozpoznano agresywne zlokalizowane zapalenie przyzębia. Plan leczenia obejmował fazę przyczynową i fazę korekcyjną choroby przyzębia. We współpracy z ortodontą ustalono założenie szyny retencyjnej na zęby dolne przed zabiegiem chirurgicznym, korzystając z niej jako z czasowego unieruchomienia zębów.
W czasie pierwszego badania klinicznego wskaźnik płytki wynosił 25%, wskaźnik krwawienia 15% badanych powierzchni. W trakcie fazy przyczynowej wykonano motywację pacjentki, instruktaż higieny jamy ustnej, skaling naddziąsłowy i poddziąsłowy z wygładzeniem powierzchni korzeni. W wyniku fazy przyczynowej zredukowano wskaźnik płytki do 10% a wskaźnik krwawienia do 5%. Parametry kliniczne pozwoliły na zakwalifikowanie pacjentki do zabiegu chirurgicznego sterowanej regeneracji tkanek przyzębia z zastosowaniem PRP i preparatu Bio-Oss. W badaniu parametrów klinicznych przed zabiegiem oznaczono głębokość kieszonki (odległość w mm od dna kieszonki do brzegu dziąsłowego) i kliniczną utratę przyczepu łącznotkankowego (odległość w mm od dna kieszonki do połączenia szkliwno-cementowego.
Procedura zabiegowa w obydwu rejonach operowanych przebiegała identycznie. W znieczuleniu nasiękowym artikainą z dodatkiem epinefryny (Ubistesin forte(r)) odwarstwiono płaty śluzówkowo-okostnowe od strony przedsionka i jamy ustnej właściwej. Po dokładnym oczyszczeniu ubytków kostnych z resztek złogów poddziąsłowych, ziarniny i martwiczego nabłonka oraz po wygładzeniu powierzchni korzeni ubytki dokładnie przemyto roztworem sterylnej soli fizjologicznej.
Jednocześnie przy użyciu standardowej wirówki do frakcjonowania osocza przygotowano koncentrat płytek krwi. W tym celu 10 ml krwi pobranej od pacjenta z żyły łokciowej przelano do sterylnej probówki. Procedura otrzymywania PRP przebiega dwuetapowo. W wyniku wstępnego 10-minutowego odwirowania izoluje się osocze z fibryną od koncentratu krwinek czerwonych. Drugie, 15-minutowe wirowanie pozwala na otrzymanie około 1-2 ml koncentratu płytek krwi wraz z tzw. płaszczem fibrynowym – krążkiem nierozpuszczalnego białka tworzącego siatkę stanowiącą zrąb skrzepu. Procedura jest stosunkowo prosta do wykonania, sterylne postępowanie umożliwia specjalny zestaw strzykawek i aspiratorów (tzw. PRP-Kit). Ubytek kostny augmentowano preparatem heterogennym (Bio-Oss) zmieszanym wstępnie z PRP.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Beck L.S. et al.: One systemic administration of transforming growth factor- beta, reverses age or glucocorticoid - impaired wound healing. J. Clin. Invest. 1993, 93:2841-2849.2. Canalis E. et al.: Insuline - like growth factor I mediates selective anabolic effects of parathyroid hormone in bone cultures. J. Clin. Invest. 1989, 83:60-65.3. Dominiak M. et al.: Zagęszczona masa płytek krwi (PRP) w leczeniu recesji dziąsła - badania wstępne. Dent. Med. Prob. 2003, 40:45-55.4. Graziani F. et al.: Maxillary Sinus Augmentation with Platelet-Rich Plasma and Fibrinogen Cryoprecipitate: A Tomographic Pilot Study. Implant. Dent. 2005, 14:63-69.5. Greenlagh D.G.: The role of growth factors in wound healing. J. Trauma. 1996, 41:159-167.6. Gottlow J.: Periodontal regeneration. Proceedings of the 1st European Workshop of Periodontology, Quintessence Publ. London,1994.7. Lindhe J., Nyman S.: Connective tissue reattachment as related to the presence or absence of alveolar bone. J. Clin. Periodontol. 1984, 11;33-40.8. Lynch S. et al.: Tissue engineering applications in maxilofacial surgery and periodontitis. Quintessence Pub. Co. Inc. Chicago 1999.9. Marx R.E. et al.: Platelet - rich plasma: Growth factor enhancement for bone grafts. Oral. Surg., Oral. Med., Oral. Pathol., 1998, 85:638-646.10. Marx R.E. et al.: Clinical applications of bone biology to mandibular and maxillary reconstruction. Clin. Plast. Surg. 1994, 21:377-392.11. Nyman S. et al.: The regeneration potential of the periodontal ligament. An experimental study in the monkey. J. Clin. Periodontol. 1982, 9:257-265.12. Nyman S. et al.: New attachment following surgical treatment of human periodontal disease. J. Clin. Periodontol. 1982, 7:290-296.13. Polson A.M. et al.: Periodontal Regeneration. Current Status and Directions. Quintessence Pub. Chicago 1994.14. Schlegel K.A. et al.: De novo bone formation using bovine collagen and platelet-rich plasma. Biomaterials 2004, 25:5387-5393.15. Wiltfang J. et al.: Effects of platelet-rich plasma on bone healing in combination with autogenous bone and bone substitutes in critical-size defects. An animal experiment. Clin. Oral. Implants. Res. 2004, 15:187-193.




