© Borgis - Nowa Stomatologia 4/2000, s. 40-45
Agnieszka Laskus-Perendyk, Maciej Zaremba, Monika Borakowska, Jan Kowalski
Emdogain w leczeniu chirurgicznym chorób przyzębia
Emdogain in surgical treatment of periodontitis
z Zakładu Chorób Błony Śluzowej i Przyzębia Instytutu Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: prof. dr hab. n. med. Renata Górska

Ukształtowane w ciągu ostatnich lat nowe koncepcje leczenia chorób przyzębia to przede wszystkim mechaniczne usuwanie płytki nazębnej, oraz modyfikacje odpowiedzi immunologicznej gospodarza i regeneracja uszkodzonych w wyniku choroby tkanek przyzębia (2, 8).
Jednym ze sposobów osiągnięcia odbudowy utraconych tkanek przyzębia w fazie korekcyjnej leczenia jest system sterowanej regeneracji kości (GBR), jak również zastosowanie mechanicznej bariery regulującej ruch komórek (GTR) – sterowane odtwarzanie tkanek. Badania histologiczne nad techniką GTR wykazały, że nowy przyczep łącznotkankowy uzyskany pomiędzy zregenerowanym cementem a zębiną korzenia nie jest tak wytrzymały jak przyczep między oryginalnym, bezkomórkowym cementem powstałym podczas rozwoju zęba a tkanką zębiny (10). Dlatego też wprowadzono preparat – Emdogain, który stymuluje regenerację tkanek przyzębia, naśladując swoim mechanizmem działania procesy biologiczne zachodzące podczas odontogenezy (1, 3, 4, 9).
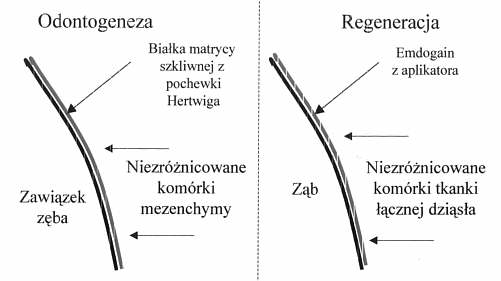
Ryc. 1. Działanie preparatu Emdogain.
Emdogain jest materiałem biologicznym, hydrofobowym skupiskiem białek matrycy szkliwnej, który oddziaływuje na niezróżnicowane komórki mezenchymalne zapewniając pełną regenerację aparatu utrzymującego ząb (6, 7). Główną składową preparatu są białka z frakcji amelogenin w postaci liofilizowanej. Drugim składnikiem jest nośnik – alginian propylenu glikolowego, w postaci półpłynnego żelu, ułatwiający aplikację preparatu. Preparat jest wytwarzany z zawiązków zębów prosiąt. Ponieważ ekspozycja na białka szkliwa ma miejsce podczas rozwoju zębów we wczesnym dzieciństwie – białek tych organizm nie traktuje jako obcych antygenów (ryc. 1). Białka pochodzenia świńskiego w preparacie Emdogain posiadają budowę niemal identyczną z ludzkimi, kodowanymi w chromosomach X i Y (9). Odgrywają one ważną rolę w tworzeniu zęba i tkanek utrzymujących ząb w zębodole, biorą udział w formowaniu cementu (regeneracja bezkomórkowych, zewnętrznych włókien), więzadeł przyzębnych i kości wyrostka zębodołowego. Białka stanowią 90% substancji podstawowej szkliwa, zaś pozostałe 10% obejmuje proteiny bogate w nieamelogeninę, tuftelinę, białka surowicy krwi i jedno białko śliny (9).
Emdogain jest preparatem z nowej grupy tzw. błon biologicznych i może być alternatywą dla innych materiałów stosowanych w regeneracji tkanek przyzębia.
Celem pracy jest kliniczna i radiologiczna ocena wpływu preparatu Emdogain na regenerację uszkodzonych tkanek przyzębia w wybranej grupie pacjentów z rozpoznaniem AP (adult periodontitis) i RPP (rapidly progressive periodontitis).
MATERIAŁ I METODY
Badaniu poddano 25 zębów u 10 pacjentów w wieku 19-52 lat z zaawansowaną chorobą przyzębia, u których na podstawie badania podmiotowego, przedmiotowego i badań radiologicznych rozpoznano AP lub RPP. Do badań zakwalifikowano tylko pacjentów ogólnie zdrowych, nie przyjmujących żadnych leków, oraz niepalących. Diagnostykę różnicową zapaleń przyzębia oraz stan kliniczny przyzębia oceniano w oparciu o pomiar głębokości kieszonek (GK) przy sześciu powierzchniach zębowych, położenie klinicznego przyczepu łącznotkankowego (PŁ) – również przy sześciu powierzchniach, stopień rozchwiania zębów (wg W.B. Halla), wskaźnik krwawienia i wskaźnik płytki (% wg O´Leary). Przeprowadzono diagnostykę radiologiczną (zdjęcia techniką kąta prostego) u wszystkich pacjentów przed rozpoczęciem leczenia, u wszystkich 10 pacjentów po 12 miesiącach od zakończonego leczenia chirurgicznego, a u dwóch także po 30 miesiącach. Punktami odniesienia do pomiarów radiologicznych odbudowy kostnej była odległość od wierzchołka korzenia do połączenia szkliwno-cementowego i od wierzchołka do zakończenia ubytku kostnego, uwzględniając naturalny poziom kości 1 mm poniżej połączenia szkliwno-cementowego.
LECZENIE
We wstępnej fazie leczenia przyzębia przeprowadzono instruktaż higieny jamy ustnej, usunięto złogi nazębne, stosując ultradźwięki i narzędzia ręczne, z wygładzeniem i polerowaniem powierzchni korzeni zębów. U niektórych pacjentów wykonano korektę zwarcia. Do zabiegów chirurgicznych zakwalifikowano ubytki kostne dwu- i trójścienne o głębokości>= 5 mm (w sumie 31 ubytków kostnych).
Leczenie chirurgiczne obejmowało wykonanie zabiegów zmodyfikowanych operacji płatowych wg Widmana (metoda Ramfiorda i Nisslego) przy zębach objętych największą destrukcją tkanek przyzębia (ryc. 2). Zabiegi wykonywano w znieczuleniu miejscowym (2% lignokaina), bez środków obkurczających naczynia. Po wygładzeniu powierzchni korzeni i usunięciu tkanki ziarninowej zastosowano chemiczne opracowanie powierzchni korzeni wersenianem sodu (EDTA) zawartym w preparacie PrefGel, celem usunięcia pozostałości warstwy zębiny mazistej (ryc. 3, 4). Następnie zmieszany z dwóch składników preparatu Emdogain był deponowany na oczyszczone i wytrawione powierzchnie korzeni zębów, zaczynając od dna kieszonki do połączenia szkliwno-cementowego (ryc. 5, 6). Płaty śluzówkowo-okostnowe dokładnie zreponowano i zaszyto, powodując częściowe wypłynięcie preparatu – przewidywane i zalecane przez producenta (ryc. 7). Nie stosowano opatrunków chirurgicznych, pacjenci nie używali nici do czyszczenia przestrzeni międzyzębowych po stronie operowanej, stosując dwa razy dziennie płukanie jamy ustnej 0,2% roztworem chlorheksydyny przez okres 6 tygodni.
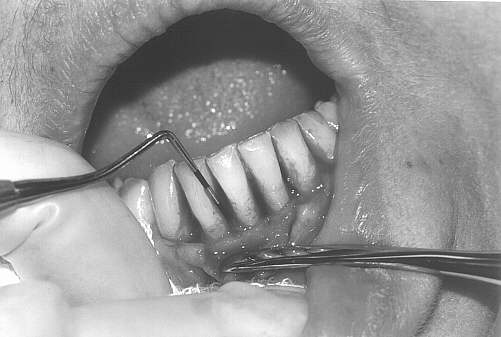
Ryc. 2.

Ryc. 3.
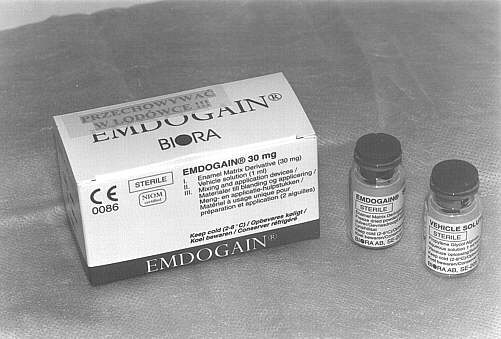
Ryc. 4.
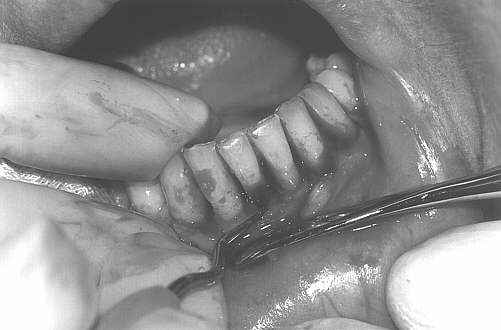
Ryc. 5.
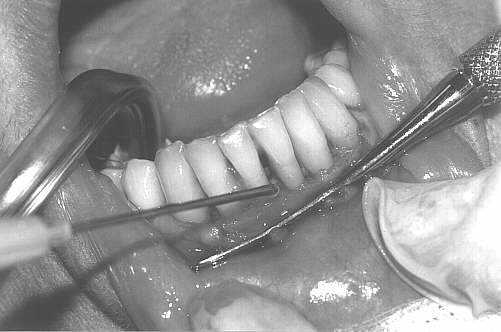
Ryc. 6.
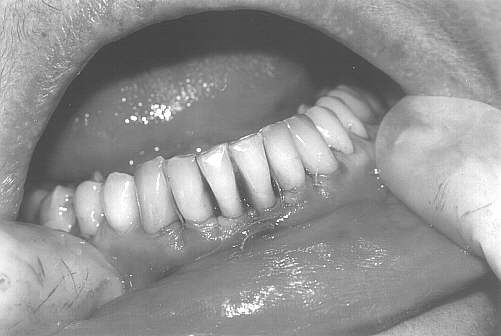
Ryc. 7.
Wszyscy pacjenci w okresie pozabiegowym otrzymali osłonę z antybiotyku (pierwszy dzień – 200 mg doksycykliny, pozostałe dni – 100 mg doksycykliny stosowanej do 3 tygodni). Przez okres pierwszych sześciu miesięcy nie stosowano pomiarów poddziąsłowych, dopiero po okresie roku od zabiegu chirurgicznego powtórzono pomiary kliniczne i radiologiczne. Wyniki poddano analizie statystycznej z użyciem zmodyfikowanego testu t-Studenta dla małej populacji.
WYNIKI I DYSKUSJA
Pomiary kliniczne przedstawione w tabeli 1 obrazują stan przyzębia przy 25 badanych zębach u 10 pacjentów (RPP, AP) przed leczeniem oraz dwanaście miesięcy po wykonanej fazie chirurgicznej leczenia.
Wyraźnej redukcji po fazie chirurgicznej leczenia (w porównaniu z wartościami przed leczeniem, o ponad 50% – z 56,85% do 2,33%) uległ wskaźnik płytki, zaś wskaźnik krwawienia zmniejszył się o ponad 35% (z 36,6% do 1,14%). Stwierdzono redukcję głębokości kieszonek przyzębnych po przeprowadzonym leczeniu chirurgicznym. U wszystkich pacjentów po dwunastu miesiącach od zabiegu zmniejszyła się o ponad 3 mm, w porównaniu do wartości przed leczeniem, zaś średni poziom przyczepu łącznotkankowego uległ redukcji o 2,09 mm. Ocena stopnia rozchwiania zębów (skala Halla) mierzona dla 25 zębów przed leczeniem wykazała ruchomość II° dla 24 zębów i I° dla jednego zęba. Po 12 miesiącach od zakończonego leczenia chirurgicznego I° rozchwiania zaobserwowano przy 16 zębach, a 0° przy 9 zębach. Badania kliniczne wykonane przed rozpoczęciem leczenia i 12 miesięcy po leczeniu chirurgicznym dla średniej głębokości kieszonek, średniego poziomu przyczepu, stopnia rozchwiania zębów i wskaźnika krwawienia przedstawiały wartości, których różnice były znamienne statystycznie (p <0,01), zaś dla wskaźnika płytki różnica ta była na poziomie p <0,05 (tab. 1).
Tabela 1. Średnie wartości pomiarów klinicznych przed leczeniem oraz po leczeniu chirurgicznym.
| | Średnie wartości przed leczeniem | Średnie wartości po leczeniu chirurgicznym | Znamienność statystyczna |
| Średnia głębokość kieszonek (mm) | 6,31 | 3,06 | p<0.01 |
| Średni poziom przyczepu (mm) | 4,51 | 2,42 | p<0.01 |
| Stopień rozchwiania (wg skali Entina) | 24-II 1-I | 16-I 9-0 | p<0.01 |
| Wskaźnik płytki (%) | 56,85% | 2,33% | p<0.05 |
| Wskaźnik krwawienia (%) | 46,60% | 1,14% | p<0.01 |
Ze względu na małą grupę badaną nie przeprowadzono analizy statystycznej wyników leczenia w zależności od rozpoznania (RPP i AP), jednakże szacunkowe porównanie efektów terapii nie wskazuje na istnienie różnic w skuteczności preparatu pomiędzy tymi dwiema postaciami choroby przyzębia.
OPIS PRZYPADKÓW
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Brookes S.J. et al.: Biochemistry and molecular biology of amelogenin proteins of developing enamel. Arch. Or. Biology, 1995, 40:1-14. 2. Caton J.G. et al.: Histometric evaluation of periodontal surgery (II). Connective tissue attachment levels after four regenerative procedures. J. Clin. Periodont 1980, 7:224-231. 3. Gestrelius S. et al.: In vitro studies on periodontal ligament cells and Enamel Matrix Derivative J. Clin. Periodont.1997, 24:685-692. 4. Gestrelius S. et al.: Formulation of Enamel Matrix Derivative for surface coating. Kinetics and cell colonization. J Clin Periodont 1997, 24:678-684. 5. Gottlow J. et al.: New attachment formation in the human periodontium by guided tissue regeneration. Case reports. J. Clin. Periodontol. 1986, 13: 604-616. 6. Hammarstrom L.: The role of enamel matrix in the development of cementum and periodontal tissue. [In:] 1997 Dental enamel. Wiley, Chichester (Ciba Foundation Symposium 205), 1997, 246-260. 7. Hammarstrom L.: Enamel matrix, cementum development and regeneration. J. Clin. Periodont. 1997, 24:658-668. 8. Karring T. et al.: Development of the biological concept of guided tissue regeneration: animal and human studies. Periodont 2000, 1993, 1:26-45. 9. Laskus-Perendyk A., Górska R.: Zastosowanie preparatu Emdogain w leczeniu chirurgicznym przyzębia. Stomat. Współczesna 1998, 6:393-397. 10. Schroeder H.: Biological problems of regenerative cementogenesis: Synthesis and attachment of collagenous matrices on growing and established root surfaces. Int. Rev. Cytol. 1992, 142:59.








