© Borgis - Nowa Stomatologia 2/2001, s. 33-36
Gabriela Cyprysiak1, Wiesław Tadeusiak2
Zastosowanie śliny w diagnostyce medycznej
Application of saliva in medicine
1 z Zakładu Stomatologii Zachowawczej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: dr n. med. Anna Marczak-Wojtyńska
2 z Zakładu Diagnostyki Laboratoryjnej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Zakładu: prof. dr hab. Dagna Bobilewicz

Ślina jest wydzieliną trawienną wytwarzaną przez trzy pary gruczołów ślinowych: przyuszne, podjęzykowe i podżuchwowe oraz liczne mniejsze gruczoły rozsiane w błonie śluzowej warg, podniebienia miękkiego, języka i policzków. Gruczoł ślinowy przypomina w budowie inny gruczoł zewnątrzwydzielniczy, a mianowicie trzustkę. Podstawę gruczołów ślinowych stanowią pęcherzyki gruczołowe połączone rozgałęzionym układem cewek tworzących drogi wprowadzające ślinę do jamy ustnej. Pęcherzyki gruczołowe wraz z całym układem cewek tworzą końcowy odcinek wydzielniczy będący jednostką czynnościową gruczołów ślinowych zwaną „saliwonem”. Saliwon wytwarza wydzielinę pierwotną, skład której zmienia się podczas przepływu przez układ cewek. W cewkach tworzy się ślina ostateczna, wydalana do jamy ustnej. Gruczoły ślinowe unerwione są przez gałązki nerwów czuciowych i dwa rodzaje nerwów autonomicznych współczulnych i przywspółczulnych, które poprzez neuromediatory wywołują reakcję wydzielniczą oraz silnie obkurczają naczynia krwionośne ślinianek. Wydzielanie śliny odbywa się ustawicznie i jest wynikiem pobudzenia autonomicznego układu nerwowego, chociaż pewien efekt wydzielniczy można zaobserwować po zastosowaniu niektórych polipeptydów jak substancja P, bradykinina, czy prostaglandyny. Wydzielanie podstawowe śliny wynosi średnio 0,33-0,55 ml/min. i waha się znacznie u poszczególnych osób nawet w warunkach standardowych. Po silnym pobudzeniu wydzielniczym np. pod wpływem bodźca pokarmowego wydzielanie śliny może wzrosnąć do 1,5-2,3 ml/min., a po działaniu środków farmakologicznych np. pilokarpiny lub metacholiny osiąga wartość 5,0 ml/min. Dobowa objętość wydzielanej śliny zależy od ilości snu, częstości i rodzaju posiłków, działania bodźców emocjonalnych, wynosi przeciętnie 1-2 litry w ciągu doby. Szczegółową właściwością wydzielania śliny jest niewspółmiernie duża jej objętość w stosunku do masy tkanki gruczołowej ślinianek i jej niska osmolalność. 99% śliny stanowi woda, resztę natomiast stanowią składniki nieorganiczne (sód, potas, chlorki, dwuwęglany) i organiczne (białka, mucyny). Osmolalność śliny jest zwykle niższa niż osocza i zależy od stopnia aktywności wydzielniczej (1).
Ślina zebrana na czczo jest hipotoniczna a przy maksymalnym wydzielaniu staje się izotoniczna z osoczem krwi. Objętość i skład śliny zależą także od wieku i płci. Wydzielanie śliny stosunkowo niewielkie u noworodków wzrasta z wiekiem, zwłaszcza między 3 a 5 rokiem życia i osiąga pierwszy szczyt przed końcem 10 roku życia. Między 10 a 30 rokiem życia wzrost wydzielania śliny jest mniejszy, w późniejszym okresie życia zaznacza się tendencja spadkowa w miarę upływu lat. Wpływ płci zaznacza się nieco większym wydzielaniem u mężczyzn niż u kobiet, zaznaczone to jest w objętości śliny i zawartości w niej sodu, wapnia i fosforu. Wysiłek fizyczny powoduje znaczny wzrost stężenia jonów, szczególnie sodu (2).
Generalnie związki występujące w ślinie podzielić można na dwie grupy. Podstawowym kryterium podziału jest fakt, czy związek ten jest wytwarzany wewnątrz gruczołów ślinowych, czy też poza nimi. Zaliczane do pierwszej grupy związki syntetyzowane w gruczołach ślinowych odgrywają tylko drugorzędną rolę w wykorzystaniu śliny jako materiału podstawowego w diagnostyce laboratoryjnej. Jedynym wyjątkowym w tej grupie jest sekrecyjna immunoglobulina A. Zewnątrzgruczołowe związki są wytwarzane poza gruczołem ślinowym i transportowane z osocza do śliny. Zdolność przechodzenia z osocza do śliny zależy od rodzaju mecha- nizmu transportu tego związku między tymi dwoma przedziałami. Może on zachodzić drogą wewnątrzkomórkową lub też drogą zewnątrzkomórkową (ryc. 1) (3). Droga wewnątrzkomórkowa obejmuje transport bierny (dyfuzja lub filtracja) bądź też transport swoisty, w którym wyróżniamy transport z udziałem nośnika, aktywny wymagający energii transport, ułatwioną dyfuzję lub pinocytozę. Droga zewnątrzkomórkowa transportu składników osocza do śliny może zachodzić poprzez ultrafiltrację bądź też przez uszkodzone błony. Do związków przenikających do śliny tylko przez pęknięcia naturalnych przegród z krwią należą tyroksyna i trijodotyronina. Stosunek stężeń między osoczem a śliną wynosi dla tych hormonów 1:5000 i są one przykładem związków, których stężenie w ślinie nie odzwierciedla ich ilości w organizmie. Związki, które możemy oznaczać w ślinie zamiast w surowicy przechodzą do śliny na zasadzie dyfuzji. Dyfuzja ta zależy od trzech czynników: 1. Ciężaru cząsteczkowego (odgrywa on jednak mniejszą rolę pomimo zasady, iż mniejsze cząsteczki łatwiej dyfundują niż większe); 2. Rozpuszczalności związku w wodzie i/lub w lipidach (lipofilowe substancje łatwiej dyfundują niż molekuły lipofobowe); 3. Stopnia jonizacji związku (tylko niezjonizowana frakcja może przejść przez lipidową barierę między trzema przedziałami: osocze, przestrzeń wewnątrzkomórkowa i ślina). Ponieważ wartości pH różnią się w przestrzeniach wewnątrz- i zewnątrzkomórkowych, całkowite stężenie jako suma zjonizowanej i niezjonizowanej frakcji inna jest po obu stronach tej bariery. Leki o pH kwaśnym występują w niższym stężeniu a leki o pH zasadowym w wyższym stężeniu w komórkach i w ślinie niż w przestrzeni wewnątrzżylnej. Odwrotna jest sytuacja jeśli pH śliny jest wyższe niż pH krwi np. po stymulacji wypływu śliny u kóz i krów pH śliny u tych zwierząt wynosi 8,0 i w tych warunkach stosunek stężeń ślina/ osocze dla fenobarbitalu wynosi 3,3 podczas gdy u ludzi ok. 0,3.
Możliwości oznaczania hormonów w ślinie
| Już oznaczane:
Kortyzol (dysfunkcja nadnerczy)
Progesteron (bezpłodność)
Estriol (dysfunkcja jajników)
17-hydroksyprogesteron (CAH, hirsutyzm)
Estriol (dysfunkcja płodu)
Testosteron (androgenizacja)
Nie wystarczająco zbadane:
Androstendion, DHT, aldosterol, estron, DHEAS, insulina, C-peptyd, melatonina.
Przypuszczalnie niemożliwe do oznaczenia:
HCG, tyroksyna, DHEA, prolaktyna, ACTH, STH. |
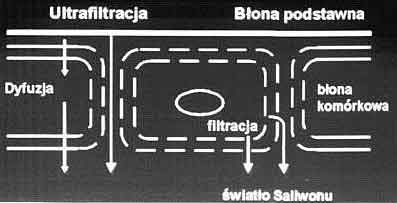
Ryc. 1. Zewnątrz- i wewnątrzkomórkowa droga transferu składników osocza do przedziałów wydzielniczych np. śliny.
Stosunek stężeń ślina/osocze silnych kwasów i zasad zależy od zmian wartości pH śliny, podczas gdy dla słabych kwasów o wartościach pKa powyżej 8,5 lub dla słabych zasad o wartościach pKa poniżej 5,5 stosunek tych stężeń pozostaje prawie niezmieniony po zmianie wartości pH śliny. Wartości pH śliny zależą od czynników psychicznych; ulegają one obniżeniu w warunkach niepokoju. W świetle tego prawa transport takich leków jak digoksyna (4), etanol, antypiryna, teofilina (5) i acetaminofenol jest niezależny od pH śliny i można je oznaczać zamiast we krwi.
Wiązanie leków przez białka jest dodatkowym czynnikiem determinującym stosunek stężeń ślina/osocze. Frakcja leków (i hormonów) związana z białkiem nie może przejść przez błonę komórkową, toteż stężenie tych związków w ślinie odzwierciedla ich wolną frakcję w osoczu. Inne czynniki wpływające na stosunek stężeń ślina/osocze to szybkość wypływu śliny (wpływa on na wartość pH śliny) oraz zjawiska zmieniających się różnic między stężeniami leków we krwi naczyniowej i żylnej. Przez gruczoły ślinowe przepływa duża objętość krwi. Dla swobodnie dyfundujących substancji różnice stężeń we krwi naczyniowej i żylnej są niewielkie. Stężenie leków w ślinie bardziej zbliżone jest do stężeń tych leków we krwi żylnej z przedziałów obwodowych a nie pobranej z żyły łokciowej. Jednak fazy eliminacji leku w tych dwóch przedziałach nie pokrywają się, toteż np. stężenie prednisolonu w osoczu obniża się wolniej niż w ślinie.
Niewątpliwie, najważniejszym zastosowaniem śliny w diagnostyce laboratoryjnej jest oznaczanie w niej leków. Jednym z najczęściej akceptowanych przykładów oznaczania leku w ślinie jest fenytoina. Lek ten aż w 90% związany jest przez albuminy, ale wskaźnik ten ulega zmniejszeniu w przypadku hipoalbuminemii (uszkodzenie nerek, marskość wątroby, ciąża), a także w przypadku przekroczenia dawki leczniczej bądź też braku efektu leczniczego powinno być zastąpione pomiarem fenytoiny w ślinie. Ścisłą korelację między stężeniami w osoczu i w ślinie i niezależność od szybkości wypływu śliny wykazano także dla antypiryny i salicylanów. Aktywnie transportowane do śliny są następujące leki: metotreksat, penicylina, metopropol, pirmentol i lit. Stężenie tych leków w ślinie jest wyższe niż w osoczu, w przypadku litu wynosi średnio 2,17 (6).
OZNACZANIE HORMONÓW W ŚLINIE
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Tadeusiak W., Krawczyński M.J.: Ślina jako materiał wyjściowy w badaniach laboratoryjnych. Post. Nauk Med., 1989, 2:192-196. 2. Tadeusiak W. i wsp.: Effect of incremental exercise until exhaustion on the salivary sodium and potassium and the plasma cortisol concentration. Sport, 2000, 17:47-55. 3. Haeckel.: Saliva, an alternative specimen in clinical laboratory. JIFCC, 1990, 2:208-217. 4. Tadeusiak W. i wsp.: Możliwość zastosowania śliny do terapii monitorowanej digoksyny. Pol. Merk. Lek., 1997, 2:117-118. 5. Tadeusiak W. i wsp.: Ślina jako wyjściowy materiał laboratoryjny do monitorowania leczenia teofiliną. Post. Nauk. Med., 1997, 10:18-20. 6. Tadeusiak W. i wsp.: Możliwość zastąpienia surowicy śliną w monitorowaniu leczenia węglanem litowym. Pol. Tyg. Lek., 1992, 47:1029-1030. 7. Raff H. et al.: Late-night salivary cortisol as a screening test for Cushing´s syndrome. J. Clin. Endocrinol. Metab., 1998, 83:2681-2686. 8. Aardal E., Holm A-Ch.: Cortisol in saliva – reference ranges and relation tocortisol in serum. Eur. J. Clin. Chem. Clin. Biochem., 1995, 33:927-932. 9. Sufi S.B. et al.: Multicenter evaluation of assays for estradiol and progesterone in saliva. Clin. Chem., 1985, 31:101. 10. Lu Y. Et al.: Salivary estradiol and progesterone in conception and nonconception cycles in women: evaluation of a new assay for salivary estradiol. Fertil. Steril., 1999, 71:863-868. 11. Swinkels L.M.J. et al.: Concentrationss of salivary testosterone and plasma total, non-sex-hormone-binding globulin-bound, and free testosterone in normal and hirsute women during administration of dexametasone/synthetic corticotropin. Clin. Chem., 1991, 37:180-185. 12. Heine R.P. et al.: Accuracy of salivary estriol testing compared to traditional risk factor assessment in predictiong preterm birth. Am. J. Obstet Gynecol., 1999, 180:S214-218. 13. McGregor J.A. et al.: Salivary estriol as a risk assessment for preterm labor: a prospectivr trial. Am. J. Obstet Gynecol., 1995, 173:1337-1342. 14. McGregor J.A. et al.: Diurnal variation in saliva estril level during pregnancy: a pilot study. Am. J. Obstet Gynecol., 1999, 180:S223-225. 15. Tadeusiak W., Bobilewicz D.: Oznaczanie mocznika w ślinie w zależności od sposobu jej pobierania. Diagn. Lab., 1996, 32:331-335. 16. Stewart D.J. et al.: Hydrolysis of cocaine in human plasma by cholinesterase. Life Sci., 1977, 20:1557-1564. 17. Tadeusiak W.: Możliwość oznaczania w ślinie przeciwciał przeciwko Helicobacter pylori klasy IgG z zastosowaniem testu scriningowego Helico Test. Farm. Pol., 1999, 55:847-848. 18. Kistula U. et al.: Longitudinal analyssis of human salivary immunoglobulins, monimmune antimicrobial agents and miccroflora after tonsillectomy. Clin. Immunol. Immunopath., 1996, 80:110-115. 19. Marchetti P. et al.: Salivary immunoreactive insulin: a new entry in cliniccal chemistry? Clin. Chem. 1988, 34:1478-1480. 20. Tadeusiak W.: Apteka a oznaczanie etanolu w ślinie. Farm. Pol., 1995, 51:858-860.


