© Borgis - Nowa Stomatologia 4/2009, s. 103-107
*Agnieszka Mielczarek1, Mirosław Kwaśny2, Anna Kwiatkowska1, Maksymilian Włodarski2
Ocena porównawcza wykorzystania fluorescencji różnicowej i systemu ICDAS II w diagnostyce próchnicy – badania in vitro
The essesment of differential fluorescence method in caries diagnosis – in vitro study
1Zakład Stomatologii Zachowawczej Instytutu Stomatologii Warszawskiego Uniwersytetu Medycznego
Kierownik Zakładu:
2Zakład Technologii Optoelektronicznej Wojskowej Akademii Technicznej w Warszawie
Kierownik Zakładu: dr n. tech. Mirosław Kwaśny

Próchnica jest wciąż aktualnym problemem zdrowotnym polskiej populacji. Jak wiadomo wczesne objawy choroby ograniczone do szkliwa mają charakter odwracalny i mogą być leczone metodami nieinwazyjnymi, które nie generują wysokich kosztów terapii. Od lat trwają więc poszukiwania skutecznego narzędzia diagnostycznego, które umożliwiłoby wczesne wykrywanie zmian próchnicowych. Szczególnym zainteresowaniem cieszą się obecnie metody optyczne pozwalające na rejestrację obrazu i monitorowanie ogniska próchnicowego w czasie, w tym metody fluorescencyjne – LIF (1, 2, 3). Intensywnie prowadzone badania nad fotoluminescencją szkliwa pozwoliły na opracowanie jego charakterystyki wzbudzeniowo-emisyjnej. Przy wzbudzeniu fluorescencji długością fali około 400 nm, wygodnym wskaźnikiem zmian obserwowanych w strukturze szkliwa jest stosunek emisji pasm, np. przy 520 i 630 nm. Zmniejszenie fluorescencji szkliwa odwapnionego w zakresie niebiesko-zielonym i jednoczesny wzrost natężenia w zakresie czerwieni stwarzają możliwość zastosowania fluorymetrii różnicowej przy obrazowaniu fluorescencji powierzchni szkliwa bez względu na geometrię pomiaru, zmiany natężenia światła wzbudzającego i inne czynniki. Wstępne wyniki badań opisujące założenia i możliwości wykorzystania fluorescencji różnicowej w diagnostyce stomatologicznej przedstawiono we wcześniejszej publikacji (4).
Jak dotąd dostępne jest na rynku jedno urządzenie pozwalające na obrazowanie fluorescencji wzbudzonej na powierzchni zęba – system QLF. Układ ten nie jest jednak powszechnie dostępny w praktyce klinicznej. Dotychczasowe doniesienia opisują jego zastosowanie w naukowych badaniach eksperymentalnych. Wysoka cena urządzenia oraz konieczność zainstalowania wysoce specjalistycznego oprogramowania do ilościowej analizy obrazu znacznie ogranicza jego zastosowanie. Inny dostępny system diagnostyczny, pracujący w oparciu o metodę fluorescencyjną, laser Diagnodent, umożliwia ilościową ocenę natężenia wzbudzonej fluorescencji, ale bez opcji obrazowania badanego obszaru (5, 6, 7).
W ostatnich latach podjęto próbę opracowania nowego uniwersalnego wskaźnika do wizualnej oceny stopnia zaawansowania zmian próchnicowych. Międzynarodowy komitet koordynujący pracę nad nowym systemem diagnostyki próchnicy zarekomendował w 2005 stosowanie zmodyfikowanego Międzynarodowego System Wykrywania i Oceny Próchnicy – ICDAS II (ang. International Caries Detection & Assessment System). Umożliwia on ocenę wzrokiem stanu twardych tkanek zęba po wcześniejszym ich oczyszczeniu i oświetleniu. Zdaniem autorów, nowy wskaźnik pozwala nie tylko na ujednolicenie metod wykrywania stopnia zaawansowania zmian próchnicowych, ale daje również możliwość oceny ich aktywności. Niewątpliwą jego zaletą jest również przydatność zarówno w badaniach klinicznych, jak i epidemiologicznych (8).
W prezentowanych badaniach in vitro, podjęto próbę wykorzystania metody fluorescencji różnicowej do oceny stopnia zaawansowania zmian próchnicowych. Porównano również jej skuteczność diagnostyczną z oceną wizualną z użyciem systemu ICDAS II.
Materiał i metodyka
Jako materiał do badań in vitro wykorzystano 50 ludzkich zębów usuniętych z różnych wskazań stomatologicznych, w tym również zęby zatrzymane. Zęby po ekstrakcji płukano pod bieżącą wodą, oczyszczano mechanicznie i przechowywano w roztworze wody destylowanej z dodatkiem kryształków tymolu. Oczyszczone i utrwalone zęby wykorzystywano do dalszych badań. Ocenie poddano 80 stycznych powierzchni zębów.
Badanie kliniczne (BW)
Badanie wizualne przeprowadzono w świetle lampy stomatologicznej. Powierzchnie zębów oceniano w warunkach wilgotnych i po osuszeniu stosując sześciostopniowy wskaźnik ICDAS II, w którym poszczególne wartości oznaczają:
0 – szkliwo prawidłowe
1 – matowa plama, biała lub brązowa – zmiana widoczna po osuszeniu powierzchni
2 – matowa plama, biała lub brązowa – zmiana widoczna na wilgotnej powierzchni
3 – miejscowe przerwanie ciągłości szkliwa, bez zmian w obrębie zębiny
4 – podpowierzchniowe zacienienie w obrębie zębiny, bez lub z miejscowym przerwaniem ciągłości szkliwa
5 – niewielki ubytek eksponujący zębinę
6 – rozległy ubytek eksponujący zębinę
Wszystkie badane powierzchnie fotografowano z użyciem aparatu cyfrowego (Nikon COOLPIX 990). Uzyskane obrazy zaprezentowano na rycinie 1.
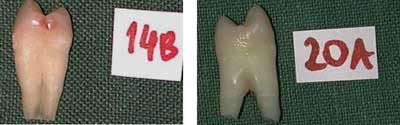
Ryc. 1. Wybrane obrazy badanych powierzchni fotografowane z użyciem aparatu cyfrowego (Nikon COOLPIX 990).
Analiza spektralna z użyciem systemu fluorescencji różnicowej (DF)
Do oceny powierzchni szkliwa zastosowano własny układ obrazowania fluorescencji różnicowej, który po raz pierwszy opisano we wcześniejszej publikacji (4). Omawiany system wyposażono w końcówkę endoskopową, co umożliwia w przyszłości prowadzenie badań w warunkach in vivo. Jako źródło wzbudzenia wykorzystano laser półprzewodnikowy generujący promieniowanie o długości fali 407nm i mocy ciągłej 25 mW (powierzchniowa gęstość mocy około 10 mW/cm2). Promieniowanie ze źródła transmitowano cieczowym światłowodem o średnicy 5 mm do zewnętrznego toru giętkiego endoskopu. Promieniowanie odbite od tkanki i promieniowanie fluorescencji doprowadzano torem centralnym endoskopu do czarno-białej kamery CCD (GP-KS162, Panasonic). Przed kamerą zainstalowano koło filtrów optycznych m.in. z żółtym filtrem pochłaniającym nadmiar odbitego od tkanki promieniowania wzbudzającego. Obraz fluorescencyjny badanego obszaru otrzymywano z użyciem interferencyjnego filtra zielonego (λ=530 nm, δ=15 nm), a następnie czerwonego (λ=625 nm, δ=20 nm), po czym obrazy nakładano na siebie uzyskując wzmocnienie kontrastu. Do analizy obrazów i oceny stopnia natężenia fluorescencji zastosowano program Microscan.
Analiza histopatologiczna (BH)
W kolejnym etapie pracy materiał badawczy przygotowano do analizy histopatologicznej. Zęby zatapiano w masie metakrylanowej i cięto diamentową tarczą w płaszczyźnie policzkowo-językowej, w poprzek zarejestrowanej zmiany próchnicowej. Uzyskane podłużne szlify szkliwne o grubości około 500um polerowano i poddano ocenie w mikroskopie stereoskopowym Nikon Eclipse P 40 przy 16-krotnym powiększeniu. Uzyskane obrazy rejestrowano, zapisywano z użyciem cyfrowego aparatu fotograficznego i analizowano. Przyjęto 5-stopniową skalę do oceny zaawansowania zmian próchnicowych:
0 – szkliwo prawidłowe
1 – zmiana ograniczona do zewnętrznej warstwy szkliwa
2 – zmiana penetrująca do wewnętrznej warstwy szkliwa, ale ograniczona granicą szkliwno-zębinową
3 – zmiana przekraczająca granicę szkliwno-zębinową, ale ograniczona do zewnętrznej warstwy zębiny
4 – zmiana penetrująca do wewnętrznej warstwy zębiny.
Uzyskane wyniki opracowano statystycznie z wykorzystaniem oprogramowania komputerowego STATISTICA V.6.1 (StatSoft, Polska). Dla określenia zależności pomiędzy badanymi parametrami wykonano analizę korelacji i określono współczynnik korelacji Spearmana. Przyjęto 5% błąd wnioskowania i związany z nim poziom istotności p<0,05 wskazujący na istnienie istotnych statystycznie różnic bądź zależności.
Wyniki
Wyniki badania wizualnego zestawiono w tabeli 1. Ocena kliniczna pozwoliła na zakwalifikowanie 20 powierzchni jako zdrowe, 45 z próchnicą ograniczoną do szkliwa i 16 z próchnicą penetrującą do zębiny.
Tabela 1. Zestawienie wyników badania klinicznego(BW).
| Wartość wskaźnika ICDAS II | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| Ilość powierzchni n (%) | 20 (25%) | 26 (33%) | 11 (14%) | 7 (9%) | 10(13%) | 4 (5%) | 2 (2%) |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Zandona AF, Zero DT: Diagnosis tools for early caries detection JADA 2006; 137(12): 1675-1684. 2. Mielczarek A, Kwaśny M: Charakterystyka spektralna i mikroanalityczna szkliwa z wczesnymi zmianami próchnicowymi. Stomat Współczesna 2002; 6: 9-15. 3. Bader JD, Shugars DA: A systematic review of the performance of a laser fluorescence device for detecting caries. [Review]. J Am Dent Assoc 2004; 135(10): 1413-1426. 4. Mielczarek A, Kwaśny M, Włodarski M: Wykorzystanie fluorescencji różnicowej w diagnostyce próchnicy. Nowa Stomatol 2007; 1: 31-35. 5. Lussi A, Hibst R, Paulus R: DIAGNOdent: an optical method for caries detection. J Dent Res2004; 83(Spec C): 80-83. 6. Ando M et al.: Relative ability of laser fluorescence techniques to quantitate early mineral loss in vitro. Caries Res 1997; 31: 125-131. 7. Shi XQ, Tranaeus S, Angmar-Mĺnsson B: Validation of DIAGNOdent for quantification of smooth surface caries, an in vitro study. Acta Odontol Scand 2001; 59: 74-78. 8. Topping GV, Pitts NB: Clinical visual caries detection. Monogr Oral Sci. 2009; 21: 15-41. 9. Ekstrand KR et al.: Lesion activity assessment. Monogr Oral Sci. 2009; 21:63-90. 10. Diniz MB et al.: Reproducibility and accuracy of the ICDAS-II for occlusal caries detection. Community Dent Oral Epidemiol. 2009; 37(5): 399-404. 11. Trenćeus S et al.: Quantification of occlusal caries: An in vitro study with laser fluorescence, electical resistance measurment and histological examination. J Dent Res 1997; 76: 1107. 12. Eggertsson H et al.: Detection of Early Interproximal Caries in vitro Using Laser Fluorescence, Dye-Eenhanced Laser Fluorescence and Direct Visual Examination. Caries Res 1999; 33: 227-233. 13. Hall AF, Deschepper E: In vitro studies of laser fluorescence for detection and quantification of mineral loss from dental caries. Adv Dent Res 1997; 11: 507-514. 14. Mendes FM et al.: Performance of DIAGNOdent for detection and quantification of smooth-surface caries in primary teeth. J Dent 2005; 33(1): 79-84. 15. Aljehani A et al.: In vitro quantification of white spot enamel lesions adjacent to fixed orthodontic appliances using quantitative light-induced fluorescence and DIAGNOdent. Acta Odontol Scand 2004; 62(6): 313-318. 16. Jablonski-Momeni A et al.: Reproducibility and Accuracy of the ICDAS-II for Detection of Occlusal Caries in vitro. Caries Res 2008; 42: 79-87. 17. Rodrigues JA et al.: Performance of Fluorescence Methods, Radiographic Examination and ICDAS II on Occlusal Surfaces in vitro. Caries Res 2008; 42: 297-304. 18. Martignon S et al.: Relationship between ICDAS II Scores and Histological Lesion Depth on Proximal Surfaces of Primary and Permanent Teeth –materiały zjazdowe – 52nd Annual Orca Congress – Caries Res 2005; 39 (4).


