© Borgis - Nowa Pediatria 2/2006, s. 46-50
*Adam J. Sybilski1,2
Rozwój chorób atopowych w okresie prenatalnym i we wczesnym dzieciństwie
Prenatal and postnatal onset of allergic diseases
1z Zakładu Profilaktyki Zagrożeń Środowiskowych, Wydział Nauki o Zdrowiu Akademii Medycznej w Warszawie
Kierownik Zakładu: prof. dr hab. n. med. Bolesław Samoliński
2z Oddziału Chorób Dziecięcych i Noworodkowych, CSK MSWiA w Warszawie
Ordynator Oddziału: lek. med. Aleksandra Łagun
Streszczenie
Atopy defines an inherited tendency for hyperproduction of IgE antibodies to common environmental allergens. Antigens are able to provoke an immune response. Production of IgE antibodies starts in fetus from 11 week of pregnancy. For protection, mother stimulates production cytokines in pathway called "TH2 – depending”. Postnatal environmental risk factors and genetic susceptibility to allergic disease play a significant role in development of allergy. The "allergic march” is a term used to describe an individual´s progress from one clinical manifestation of allergy to another, with age. Not all sensitized children will join the allergic march, but it appears that individuals who do not join the allergic march have a greater risk of displaying symptoms of allergic disease in adulthood.

Procesy odpowiedzialne za rozwój alergii są złożone. By w pełni je zrozumieć należy przypomnieć patomechanizm uczulenia.
Alergia atopowa została zakwalifikowana do typu I reakcji nadwrażliwości przedstawionych przez Gell´a i Coombs´a. Podstawą jej patomechanizmu jest reakcja alergenu (antygenu) z przeciwciałami IgE, dlatego ten typ reakcji alergicznej nazywany jest odpowiedzią IgE-zależną. Czynnikiem niezbędnym do wystąpienia reakcji alergicznej jest obecność alergenu w otoczeniu i jego kontakt z organizmem. Większość alergenów to wielocząsteczkowe białka o masie od 10 do 40 kDa. Drugą, zdecydowanie mniejszą grupę alergenów, stanowią związki chemiczne o charakterze haptenów. Ich efekt alergizujący następuje dopiero po połączeniu z nośnikiem (np. białka surowicy). Kontakt alergenu z organizmem może nastąpić poprzez błony śluzowe przewodu pokarmowego (alergeny pokarmowe) i układu oddechowego (alergeny pyłkowe), skórę (alergeny kontaktowe), spojówki oczu (1, 2, 3, 4, 5, 6).
Po wniknięciu do organizmu alergen jest rozpoznawany przez wyspecjalizowane makrofagi (w błonie śluzowej) i komórki Langerhansa (w naskórku). Rozpoznawszy alergen, makrofagi fagocytują go i doprowadzają do jego fragmentacji wewnątrz komórki. Następnie, fragmentowany alergen jest przyłączany do cząsteczek powierzchniowych (cząsteczki głównego układu zgodności tkankowej – MHC) i prezentowany limfocytom Th0 w węzłach chłonnych. W tym momencie komórki wykonujące to zadanie nazywamy komórkami prezentującymi antygen (APC) (1, 5, 7). Na tym kończy się etap rozpoznania obcego antygenu i jego prezentacji.
Na powierzchni błony komórkowej limfocytów T pomocniczych (Th) umieszczone są receptory wiążące antygen (TCR). By zapoczątkować reakcję nadwrażliwości typu I konieczne są dwa sygnały powodujące aktywację limfocyta Th (tzw. dziewiczego):
1. rozpoznanie przez limfocyt Th (poprzez pobudzenie receptora TCR) właściwego dla niego antygenu, przy współpracy cząsteczki CD 40,
2. proces kostymulacji (współdziałanie cząsteczek CD28 CTLA-4 na powierzchni limfocyta i odpowiadających im cząsteczkom adhezyjnym CD80/CD86 na APC) (1, 2, 5).
Procesy aktywacji dziewiczego limfocytu Th (Th0) powodują różnicowanie się go na dwie subpopulacje: komórki Th1 i Th2. Od tego etapu zależy dalszy przebieg reakcji, gdyż komórki Th1 posiadają właściwości zapalne (powstają po rozpoznaniu antygenów endogennych np.: białek wirusa, komórek nowotworowych), a komórki Th2 są linią regulującą procesy alergiczne.
O kierunku różnicowania decyduje kilka czynników: uwarunkowania genetyczne, sposób prezentacji alergenu w układzie odpornościowym oraz rodzaj alergenu. Różnicowanie się komórek Th0 w subpopulacje Th2 jest warunkowane obecnością interleukiny-4 (IL-4), która uważana jest za podstawową cytokinę w patomechanizmie alergii. Przy dużej ilości IL-4 pochodzącej z innych komórek Th2 i być może komórek tucznych, następuje dojrzewanie limfocytów Th w linię Th2, która warunkuje wystąpienie kolejnych etapów reakcji alergicznej. Interleukina-4 nie tylko wpływa na limfocyt Th2, ale również pobudza limfocyty B do wytwarzania IgE i migrację eozynofilów do tkanek. Limfocyt Th, przechodząc w Th2, nabiera zdolności wytwarzania również innych cytokin niezbędnych do zajścia procesu alergizacji (IL-5, IL-6, IL-8, IL-9, IL-10, IL-13). Gdy mamy do czynienia z procesem zapalnym i różnicowaniem się limfocytów Th0 w linię komórek Th1, produkowany jest inny profil cytokin specyficzny dla tego procesu: IL-2, IFN-g, TNF-b (1, 2, 5, 7).
Kolejnym etapem procesu nadwrażliwości typu I jest pobudzenie limfocytu B do produkcji antygenowo swoistych immunoglobulin klasy E. Początkowo, w rozwoju osobniczym organizmu, limfocyt B wytwarza immunoglobuliny klasy IgM. Do spowodowania zmiany klas syntetyzowanych przeciwciał niezbędne są bezpośrednie związanie specyficznego antygenu z limfocytem B poprzez odpowiedni receptor – BCR na powierzchni komórki oraz intensywna produkcja IL-4 przez linię komórkową Th2 i stymulacje produkcji IgE. Konieczne jest też bezpośrednie połączenie limfocytu B z limfocytem Th2 poprzez cząsteczki CD40 na powierzchni limfocyta B i liganda CD40 (CD40L) na powierzchni Th2.
Ogólnie można więc powiedzieć, że przekształcenie się limfocytu Th0 w linię komórkową Th2 pobudza produkcję IgE i stymuluje proces alergii, natomiast rozwój linii komórkowej Th1 hamuje ten proces (2, 5, 8, 9).
Zsyntetyzowane specyficzne dla danego antygenu IgE są uwalniane, a następnie łączą się z komórkami tucznymi, bazofilami oraz, w mniejszym stopniu, z eozynofilami i komórkami Langerhansa i uczulają je. Gdy alergen dociera do uczulonej komórki, wywołuje wiązanie krzyżowe z IgE znajdującymi się na powierzchni komórek efektorowych. Związanie alergenu z IgE na komórce tucznej powoduje wzrost stężenia wewnątrzkomórkowego wapnia (Ca2+), ich degranulację i uwolnienie w ciągu bardzo krótkiego czasu histaminy i innych mediatorów do przestrzeni międzykomórkowej. Ziarnistości komórek tucznych i bazofilów zawierają trzy grupy mediatorów: mediatory preformowane (najważniejsza histamina), mediatory generowane (prostaglandyny i leukotrieny) i mediatory produkowane de novo (cytokiny NF i IL-4). Połączenie się IgE z komórkami tucznymi, które obecne są w tzw. narządach wstrząsowych (skórze, oskrzelach, przewodzie pokarmowym, błonie śluzowej nosa i oka) powoduje wystąpienie objawów klinicznych alergii z ich strony.
Odpowiedź immunologiczna przebiega w dwóch fazach: reakcja natychmiastowa (anafilaktyczna) i reakcja opóźniona (LPR). Za reakcję natychmiastową odpowiada głównie uwalniana z komórek tucznych histamina. Zespół objawów klinicznych obserwowanych w trakcie tej fazy jest wynikiem działania przede wszystkim histaminy na jej receptory H1 i H2 obecne w różnych narządach. Manifestacja alergii zależy od pobudzenia tych receptorów w narządach wstrząsowych (1, 10).
Reakcja późna odpowiedzi immunologicznej polega na wystąpieniu przewlekłego stanu zapalnego i w konsekwencji trwałego uszkodzenia tkanek oraz narządów. Dzieje się tak w wyniku stałego i długotrwałego kontaktu z alergenem. Przykładem tego procesu może być astma oskrzelowa, w której dochodzi do przebudowy (remodeling) dróg oddechowych.
Choć czasami objawy alergii atopowej mogą dotyczyć jednego narządu, najczęściej stwierdza się obecność objawów wielonarządowych. Czasami można prześledzić zmianę objawów alergii u chorych. Taka ewolucja manifestacji klinicznej alergii jest przede wszystkim uzależniona od wieku człowieka, u którego rozpoczął się proces uczulenia. Ten charakterystyczny przebieg rozwoju objawów klinicznych w różnych narządach w zależności od wieku jest nazwany marszem alergicznym.
Odpowiedź immunologiczna płodu
Od dawna wiadomo o dziedzicznym charakterze alergii i o skomplikowanej naturze rozwoju fenotypu atopowego i uczulenia już w życiu płodowym. Wiele prac na bogatym materiale sugeruje, że płód po kontakcie z alergenami rozpoczyna proces alergizacji. Za takim przebiegiem przemawia fakt wykrycia u płodu i we krwi pępowinowej w różnych stężeniach immunoglobuliny klasy E, która nie przechodzi przez łożysko, a więc jest syntetyzowana przez płód. Proces ten rozpoczyna się od 11. tygodnia ciąży i przebiega w wątrobie i płucach płodu. Kolejnym dowodem potwierdzającym rozpoczęcie procesu uczulenia dziecka już in utro. Jego reakcją na to jest proliferacja komórek jednojądrzastych krwi pępowinowej w obecności różnych alergenów. Potwierdzeniem aktywności układu immunologicznego płodu i jego odpowiedzi na różnorakie czynniki jest potwierdzona licznymi badaniami obecność przeciwciał klasy IgM już w 20-26 tygodniu ciąży w surowicy płodu matek zainfekowanych różyczką. Również przeciwciała klasy M przeciw toksynie tężcowej są oznaczone we krwi pępowinowej, co jest wyrazem odpowiedzi układu immunologicznego płodu na immunizacje, matki w czasie ciąży. Oznaczenie stężenia immunoglobuliny klasy G przeciw wirusowi hepatitis B u płodu i jednocześnie niewykrycie tych przeciwciał u matki jest kolejnym dowodem na intensywną i autonomiczną pracę układu odpornościowego płodu (11, 12, 13, 14).
Wywołanie takiej specyficznej reakcji układu odpornościowego wymaga kontaktu płodu z alergenami. Uważa się, że następuje on na drodze dwóch procesów. Pierwszy polega na kontakcie alergenu przez przewód pokarmowy płodu, który połyka alergeny wraz z płynem owodniowym. Techniki laboratoryjne umożliwiają obecnie oznaczenie istotnych stężeń podstawowych alergenów (np. kurzu domowego) w płynie owodniowym. Zważywszy, że płyn owodniowy zmienia 70% swojego składu dziennie, przyjmuje się, że większość jest połykane przez płód i w ten sposób alergeny mogą kontaktować się z tkanką immunologiczną przewodu pokarmowego płodu. Uważa się, że jest to główna droga wnikania alergenów do organizmu płodu. Potwierdzeniem tego jest wykrycie komórek prezentujących antygen (APC) w jelicie 12-tygodniowego płodu, a u 14-16-tygodniowego dojrzałych komórek dendrytycznych. Drugą drogą przedostawania się alergenów jest bezpośredni transport alergenów przez łożysko. Ostatnio wykryto, że transport ten jest w dużej mierze realizowany przez kompleks antygenu z immunoglobuliną G. Jak się wydaje największy transfer antygeny przy udziale tej drogi odbywa się w trzecim trymestrze ciąży, gdzie mamy do czynienia z aktywnym transportem IgG przez łożysko (11, 12, 13).
Okres ciąży jest pod względem immunologicznym wyjątkowym okresem fizjologii człowieka. Jego specyfika polega na precyzyjnym przestawieniu i regulowaniu odpowiedzi immunologicznej matki umożliwiającej prawidłowe zagnieżdżenie zarodka, wzrost trofoblastu, produkcję hormonów łożyska i w konsekwencji donoszenie ciąży. By uniemożliwić odrzucenie obcego antygenowo zarodka i płodu, organizm matki indukuje powstawanie cytokin linii komórkowej Th2 (IL-4, IL-5, IL-6, IL-10, IL13). Tak więc, w okresie ciąży dominuje produkcja cytokin „ochraniających” ciążę, a zarazem odpowiedzialnych za powstawanie reakcji alergicznych. Poszczególne cytokiny linii komórkowej Th2 odgrywają specyficzną rolę dla prawidłowego przebiegu ciąży. IL-4 jest odpowiedzialna za wzrost i różnicowanie się komórek, hamowanie adhezji, regulację procesu prezentacji antygenów. IL-10 hamuje syntezę IFN-a (czynnik powodujący poronienia poprzez aktywacje komórek NK), promuje odpowiedź Th2 i powoduje supresję odpowiedzi Th1. Jest to bardzo istotne, gdyż cytokiny linii komórkowej Th1 mogą powodować poronienia, porody przedwczesne, uszkodzenie płodu, zahamowanie wzrostu. Konsekwencją tej „ochrony” ciąży poprzez regulację matczynej równowagi odpowiedzi Th1/Th2, jest narażenie płodu na działanie wysokiego stężenia cytokin linii Th2 – proalergicznej. Powstaje zatem pytanie, dlaczego nie u wszystkich płodów rozwija się nasilona reakcja uczuleniowa? Wydaje się, że formę ochrony stanowią tu matczyne immunoglobuliny klasy G przechodzące przez łożysko. Hamują one wchłanianie alergenów z błon śluzowych płodu oraz wpływają na przechodzenie alergenu przez łożysko. Ponadto we krwi pępowinowej stwierdzono duże stężenia przeciwciał IgG anty IgE. Wszystkie te zależności pomiędzy matką, łożyskiem i płodem stwarzają unikalną homeostazę umożliwiającą prawidłowy przebieg ciąży, rozwój płodu i poród (11, 12, 13).
Wszystkie noworodki rodzą się z przewagą produkcji cytokin Th2, czyli predysponującą do rozwoju alergii. Sytuacja ta jest u większości dzieci przejściowa i po pewnym czasie dochodzi do dominacji odpowiedzi linii komórkowej Th1 (ryc. 1).
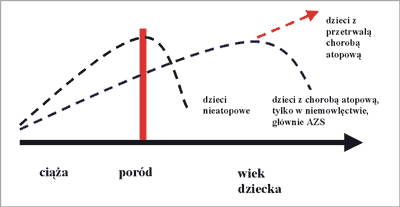
Ryc. 1. Nasilenie odpowiedzi immunologicznej typu Th2 przed i po urodzeniu (14).
U dzieci, u których działają czynniki ryzyka rozwoju alergii (wpływ środowiska, ekspozycja na alergeny, czynniki infekcyjne) oraz predyspozycje genetyczne, odpowiedź komórkowa typu Th2 i produkcja cytokin proatopowych nie kończy się po okresie niemowlęcym i po pewnym czasie objawy alergii się ujawniają (12, 14).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Lasek W.: Nadwrażliwość typu I. w: Immunologia. pod red.: J. Gołąb, M. Jakóbisiak, W. Lasek, PWN, Warszawa, 2002, 372-401. 2. Brostoff J., Hall D.: Nadwrażliwość Typ I. w: Immunologia. pod red.: J. Roit, D. Brostoff, D. Hall. PZWL, Warszawa, 2000, 23. 3. Zawisza E.: Atopia. w: Choroby alergiczne. pod red.: E. Zawisza, B. Samoliński. PZWL, Warszawa, 1998, 44-52. 4. Bosquet P., et al.: Atopy. w: From atopic dermatitis to asthma. pod red.: P. Bosquet, G. Dutau, A. Grimfeld, Y de Prost, Expansion Scientifique Francaise, 2002, 5-21. 5. Gliński W.: Powstawanie swoistej odpowiedzi immunologicznej na alergeny. w: Alergologia dla lekarzy dermatologów. W. Gliński, E. Rudzki, Wydawnictwo Czelej, Lublin, 2002, 37-49. 6. Kowalski M.L.: Odpowiedź immunologiczna. w: Immunologia kliniczna. pod red.: M.L. Kowalski, Mediton, Łódź, 2000, 1-32. 7. Kowalski M.: Immunopatogeneza alergii atopowej. w: Immunologia kliniczna. pod red. M. Kowalski, Mediton 2000, 137-165. 8. Jutel M.: Odpowiedź immunologiczna. w: Choroby alergiczne i astma. pod red.: J. Małolepszego, Volumed, Wrocław, 1996, 2. 9. Grevers G., Rocken M.: Podstawy patomechanizmu chorób alergicznych. w: Ilustrowany poradnik chorób alergicznych. pod red.: G. Grevers, M. Rocken, Urban & Partner, 2002, 1-56. 10. Gliński W.: I mechanizm immunologiczny (alergiczny). w: Alergologia dla lekarzy dermatologów. W. Gliński, E. Rudzki, Wydawnictwo Czelej, Lublin, 2002, 61-75. 11. Warner J.O.: Can We Prevent Allergies and Asthma? Allergy Clin. Immunol. Int., 2004, 16, 186-191. 12. Bręborowicz A.: Alergizacja w życiu płodowym. Alergia Astma Immunologia, 2002, 7 (supl.2), 73-77. 13. Warner J.O.: The early life origins of asthma and related allergic disorders. Arch. Dis. Child, 2004, 89, 97-102. 14. Jones C.A., Holloway J.A., Warner J.O.: Does atopic disease starts in fetal life? Allergy, 2000, 55, 2-10. 15. Vandenplas Y.: Clinical Overview: The Changing Pattern of Clinical Aspects of Allergic Diseases. w: Allergic Diseases and the Environment. pod red.: E. Isolauri, W.A. Walker, Karger, Basel, 2004, 1-25. 16. Wahn U.: What drives the allergic march? Allergy, 2000, 55, 591-599. 17. Laan M.P., Baert M.R.: Markers for early sensitization and inflammation in relation to clinical manifestations of atopic disease up to 2 years of age in 133 high-risk children. Clin Exp Allergy. 2000, 30, 944-53. 18. Cantani A., Micera M.: Epidemiology of atopy in 220 children. Diagnostic reliability of skin prick tests and total and specific IgE levels. Minerva Pediatr. 2003, 55, 129-142.

