© Borgis - Anestezjologia Intensywna Terapia 1/2005, s. 22-27
Jakub Śmiechowicz, Jarosław Terpiński, Andrzej Kübler
Zastosowanie systemu „AnaConDa” do analgosedacji sewofluranem chorych po operacjach kardiochirurgicznych
The use of the Anaesthetic Conserving Device "AnaConDa” for sevoflurane sedation after cardiac surgery
Katedra i Klinika Anestezjologii i Intensywnej Terapii AM we Wrocławiu
kierownik: prof. dr hab. n. med. A. Kübler
Summary
Background. Volatile anaesthetics offer several advantages when used to sedate ICU patients. The Anaesthetic Conserving Device (ACD) "AnaConDa” (Hudson RCI, Upplands, Väsby, Sweden) enables easy and economical administration of sevoflurane and isoflurane during mechanical ventilation with a standard ICU ventilator. The purpose of the study was to evaluate the usefulness of sevoflurane administered via the ACD for sedation after cardiac surgery. Methods. Six patients who had undergone cardiac surgery, received sevoflurane delivered with a syringe pump to the ACD, which was placed between the endotracheal tube and the breathing circuit of a Bennett 7200ae ventilator. Expiratory gas concentrations and vital signs were monitored using the Datex AS/3 system. The depth of sedation was assessed by the modified Ramsay scale and bispectral index (BIS). Results. Adequate sedation was achieved in all patients. Sevoflurane was delivered at a rate of 0.5 to 6.0 ml h-1 over 170 to 410 minutes, producing end-tidal concentrations between 0.2 and 1.9 % (most of the time between 0.4 and 0.9%). Mean sevoflurane consumption during sedation was in the range of 1.18 to 3.17 ml h-1. The Ramsay sedation score varied from 6 to 2. Mean BIS values correlated inversely with the depth of sedation, although the range varied widely. Haemodynamic parameters remained within acceptable limits. Most of the patients could be extubated within 1 hour after sevoflurane had been stopped. Conclusions. Relatively low end-tidal sevoflurane concentrations produced adequate sedation in the majority of patients, without compromising cardiovascular function. The recovery was smooth and the time to extubation depended mainly on the residual effects of opioids. Because of wide fluctuations in BIS values, we do not regard this index as a reliable tool for assessment of sedation in the ICU.

Chorzy po operacjach kardiochirurgicznych, w pierwszych godzinach okresu pooperacyjnego, wymagają stosowania analgosedacji, mającej na celu umożliwienie prowadzenia wentylacji mechanicznej, ułatwienie tolerancji rurki intubacyjnej, stabilizację czynności układu krążenia oraz temperatury ciała. Nowoczesne, wziewne środki anestetyczne, dzięki korzystnym cechom farmakokinetycznym oraz niewielkiemu wpływowi na układ krążenia, stanowią kuszącą alternatywę u tych właśnie chorych dla powszechnie stosowanych, dożylnych leków nasennych i przeciwbólowych.
Podawanie anestetyków wziewnych chorym w oddziale intensywnej terapii (OIT) wiąże się z większym obciążeniem organizacyjnym i sprzętowym w porównaniu z sedacją za pomocą leków dożylnych. Do analgosedacji chorych w oddziale intensywnej terapii stosowano izofluran [1, 2, 3], desfluran [4] oraz ksenon [5]. Podawanie wziewnych środków anestetycznych do układu oddechowego respiratora wymaga zastosowania specjalnych parowników i jest mało ekonomiczne. Wentylacja za pomocą respiratora, w przeciwieństwie do aparatu do znieczulenia, odbywa się w układzie otwartym, co wiąże się z dużym zużyciem drogiego leku anestetycznego. Znaczne zmniejszenie zużycia lotnych środków anestetycznych umożliwia zastosowanie respiratorów wyposażonych w układ zamknięty [5]. Respiratory takie są jednak stosowane obecnie jedynie do badań naukowych. Do długotrwałej wentylacji chorych w OIT można również wykorzystywać nowoczesne aparaty do znieczulenia o rozbudowanych trybach wentylacji. Dzięki możliwości zastosowania niskich przepływów zużycie gazów anestetycznych jest w nich znacznie mniejsze [4]. W praktyce klinicznej jednak takie wykorzystanie aparatów do znieczulenia jest bardzo rzadkie i podlega ograniczeniom związanym z dostępnością tych aparatów w OIT oraz z wymogami prowadzenia złożonej terapii oddechowej u ciężko chorych.
Odmiennym sposobem zmniejszenia zużycia lotnych środków anestetycznych jest umieszczenie za łącznikiem Y w układzie pacjenta specjalnego urządzenia z filtrem pochłaniającym pary anestetyku w czasie wydechu a oddającym go do mieszaniny oddechowej w czasie wdechu. Układ taki został po raz pierwszy zastosowany przez Thomassona i wsp. w 1989 roku i zawierał zeolit, jako materiał adsorpcyjny dla izofluranu. Pozwalał on na zmniejszenie zużycia izofluranu o 51 do 57% w zależności od wielkości przepływu gazów anestetycznych [6]. W 2001 roku Enlund i wsp. przedstawili nowe urządzenie, w którym potencjalnie szkodliwy zeolit został zastąpiony przez filtr węglowy [7]. Po odpowiedniej modyfikacji opracowano Urządzenie Oszczędzające Gazy Anestetyczne (Anesthetic Conserving Device – ACD, AnaConDa, Hudson RCI) będące połączeniem filtra węglowego, filtra przeciwbakteryjnego, wymiennika ciepła i wilgoci oraz parownika gazów anestetycznych. Urządzenie można stosować z dowolnym respiratorem umieszczając je pomiędzy rurką intubacyjną a łącznikiem Y układu oddechowego respiratora. Izofluran lub sewofluran w postaci ciekłej podawany jest za pomocą pompy strzykawkowej do urządzenia, w którym na specjalnym pręcie zachodzi parowanie. Dalej pary anestetyku mieszają się z gazami oddechowymi i dostają się w czasie wdechu do płuc chorego. Recyrkulacji podlega do 90% środka anestetycznego, dzięki czemu tylko niewielka ilość gazu przedostaje się do środowiska.
Celem pracy była ocena przydatności systemu „AnaConDa” do sedacji sewofluranem u chorych w okresie pooperacyjnym po operacjach kardiochirurgicznych.
METODYKA
Badaniem objęto 6 chorych w wieku od 48 do 75 lat operowanych w trybie planowym w Klinice Chirurgii Serca Akademii Medycznej we Wrocławiu. Protokół badań został zaakceptowany przez Komisję Bioetyczną AM we Wrocławiu. U 4 chorych wykonywano zabieg rewaskularyzacji naczyń wieńcowych (w tym u dwóch bez użycia krążenia pozaustrojowego), u jednego chorego zabieg wszczepienia sztucznej zastawki aortalnej oraz u jednej chorej zabieg wszczepienia sztucznej zastawki mitralnej, sztucznej zastawki aortalnej i biologicznej zastawki trójdzielnej. Czas znieczulenia badanych chorych wynosił od 210 do 330 minut.
Przed operacją chorzy otrzymywali jako premedykację midazolam 0,1 mg kg-1 doustnie i morfinę 0,1 mg kg-1 domięśniowo. Śródoperacyjnie chorzy otrzymali od 2,75 do 3,5 mg fentanylu oraz 15-20 mg midazolamu (u jednego chorego zamiast midazolamu stosowano propofol), zwiotczenie mięśni uzyskano za pomocą pankuronium, natomiast sewofluran podawano w stężeniu zależnym od potrzeb klinicznych.
Po zabiegu chorych przewożono do oddziału pooperacyjnego, gdzie kontynuowano wentylację mechaniczną za pomocą respiratora Bennett 7200ae. Pomiędzy rurką intubacyjną a łącznikiem Y układu oddechowego respiratora umieszczano Urządzenie Oszczędzające Gazy Anestetyczne (AnaConDa, Hudson RCI, Upplands, Väsby, Szwecja), do którego rozpoczynano podaż ciekłego sewofluranu za pomocą pompy strzykawkowej. Szybkość podaży nastawiano początkowo na 3-5 ml godz-1 i dostosowywano do stanu klinicznego chorego. Pomiar stężenia sewofluranu w czasie wdechu i wydechu dokonywano za pomocą monitora Datex AS/3 przez próbkowanie mieszaniny oddechowej pobranej przez specjalny port badanego urządzenia. Gazy wydechowe z respiratora i z monitora gazów anestetycznych ewakuowano za pomocą zmontowanego specjalnie układu rur karbowanych na zewnątrz budynku (ryc. 1).
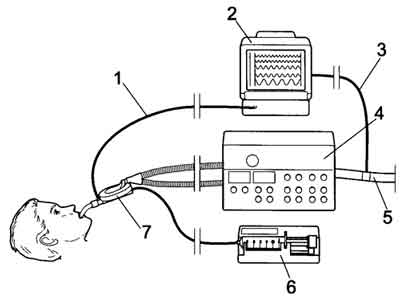
Ryc. 1. System „AnaConDa” w układzie pacjent-respirator.
Stopień sedacji oceniano klinicznie według 6-stopniowej skali Ramsay´a [1] oraz przyrządowo za pomocą monitorowania elektroencefalograficznego wskaźnika bispektralnego (BIS). Celem było utrzymanie sedacji, przynajmniej w początkowym okresie, na poziomie 3 do 5 punktów wg skali Ramsay´a. Wskaźnik BIS monitorowano za pomocą aparatu A-2000XP (Aspect Medical Systems), do którego podłączano specjalny czujnik zawierający 4 elektrody EEG (Zipprep, Aspect Medical Systems), tworzące odprowadzenie dwubiegunowe czołowo-skroniowe z elektrodą odniesienia w punkcie Fpz . Aparat A-2000XP wyposażony jest w algorytm obliczający wartości wskaźnika BIS w warunkach pracy w oddziale intensywnej terapii. Dane liczbowe uzyskiwane za pomocą monitora BIS zapisywano na bieżąco na twardym dysku komputera typu PC. W razie potrzeby stosowano przeciwbólowo ketoprofen w dawce 100 mg we wlewie dożylnym oraz stosowano frakcjonowane dawki morfiny. Wentylację mechaniczną prowadzono do czasu wybudzenia chorego i powrotu zadowalającej funkcji oddechowej.
Monitorowanie parametrów życiowych (EKG, ciśnienie tętnicze metodą bezpośrednią, OCŻ, SatO2 ) prowadzono za pomocą aparatu Datex AS/3. Częstość tętna, wartości ciśnienia tętniczego oraz stopień sedacji notowano co 10 minut przez pierwszą godzinę, a następnie co 30 minut do czasu ekstubacji chorego.
Praca miała charakter wstępnej obserwacji i z uwagi na niewielką liczbę badanych pacjentów nie dokonano statystycznych badań porównawczych.
WYNIKI
W czasie stosowania sewofluranu u wszystkich badanych udało się utrzymać sedację na zadowalającym poziomie. Poziom sedacji oceniany według skali Ramsay´a wynosił od 2 do 6 punktów, a w zdecydowanej większości pomiarów wynosił nie mniej niż 3 punkty. Procentowy udział stopni sedacji w czasie stosowania sewofluranu przedstawiono w tabeli I.
Tab. I. Udział procentowy uzyskanych stopni głębokości sedacji według zmodyfikowanej skali Ramsay´a podczas stosowania sedacji sewofluranem.
| | Stopnie
sedacji w skali Ramsay´a i odsetek czasu prowadzonej sedacji (%) |
| 2 | 3 | 4 | 5 | 6 |
| K.J. | 0 | 44 | 14 | 5 | 37 |
| J.A. | 0 | 0 | 10 | 25 | 65 |
| K.S. | 17 | 53 | 12 | 6 | 12 |
| K.M. | 0 | 36 | 14 | 4 | 46 |
| S.S. | 12 | 66 | 22 | 0 | 0 |
| B.R. | 0 | 0 | 0 | 0 | 100 |
Wartości wskaźnika BIS odpowiadające poziomom sedacji ocenianym klinicznie przedstawiono w tabeli II.
Tab. II. Wartości wskaźnika BIS przy różnych poziomach sedacji.
| | Stopnie sedacji według zmodyfikowanej skali Ramsay´a |
| 2 | 3 | 4 | 5 | 6 |
| Wskaźnik BIS | mediana | 81,4 | 72,5 | 66,5 | 63,2 | 53,7 |
| wartości przeciętne | 63,4-89,1 | 59,9-81,0 | 55,9-80,2 | 44,7-73,3 | 44,9-62,9 |
Podaż sewofluranu prowadzono z szybkością od 0,5 do 6 ml godz-1 Doraźnie w celu szybkiego pogłębienia sedacji podaż zwiększano na krótko do 99 m godz-1. Stężenie sewofluranu w powietrzu końcowo-wydechowym wynosiło od 0,2 do 1,9 vol%, a przez większość czasu sedacji zawierało się w przedziale 0,4-0,9 vol%. Czas sedacji i ilość zużytego sewofluranu przedstawiono w tabeli III.
Tab. III. Czas prowadzenia sedacji i ilość zużytego sewofluranu u poszczególnych chorych.
| K.J. | J.A. | K.S. | K.M. | S.S. | B.R. |
| Czas prowadzenia sedacji (min) | 215 | 305 | 170 | 280 | 410 | 230 |
| Całkowita ilość zużytego sewofluranu (ml) | 10 | 15 | 9 | 5,5 | 17 | 4 |
| Średnia ilość sewofluranu na godzinę sedacji (ml godz-1) | 2,8 | 2,9 | 3,2 | 1,2 | 2,5 | 1,0 |
| Czas do ekstubacji (min) | 45 | 47 | 145 | 40 | 60 | 900 |
Czas od zakończenia podaży sewofluranu do ekstubacji przedstawiono również w tabeli III. Przedłużony czas ekstubacji u chorej B.R. spowodowany był skomplikowanym przebiegiem pooperacyjnym po zabiegu wszczepienia 3 zastawek serca.
W czasie sedacji sewofluranem nie obserwowano znaczących wzrostów ciśnienia tętniczego. Wartości ciśnienia tętniczego i częstości tętna badanych chorych w czasie sedacji sewofluranem przedstawiono w tabeli IV.
Tab. IV. Wartości ciśnienia tętniczego i tętna badanych chorych w czasie prowadzenia sedacji sewofluranem.
| | K.J. | J.A. | K.S. | K.M. | S.S. | B.R.* |
| Częstość akcji serca (ud min-1) | Min. | 94 | 71 | 102 | 72 | 90 | 80 |
| Max. | 139 | 105 | 118 | 90 | 112 | 80 |
| Średnia | 111 | 83 | 112 | 82 | 98 | 80 |
| Ciśnienie skurczowe (mm Hg) | Min. | 107 | 106 | 102 | 87 | 99 | 70 |
| Max. | 130 | 168 | 118 | 130 | 153 | 107 |
| Średnia | 116 | 124 | 112 | 113 | 121 | 94 |
| Ciśnienie rozkurczowe (mm Hg) | Min. | 70 | 56 | 51 | 50 | 56 | 40 |
| Max. | 79 | 94 | 82 | 71 | 80 | 57 |
| Średnia | 72 | 72 | 60 | 62 | 66 | 46 |
*u chorej B.R. stosowano stymulację czasową serca ze względu na całkowity blok serca.
U chorego K.M. zatrzymano podaż sewofluranu na 40 minut ze względu na spadek skurczowego ciśnienia tętniczego poniżej 90 mm Hg (12 kPa) oraz utrzymujący się zbyt głęboki poziom sedacji (6 stopień według skali Ramsay´a). U chorej B.R. (po operacji wszczepienia 3 zastawek serca) obserwowano skłonność do hipotensji w czasie stosowania sewofluranu oraz zbyt głęboki poziom sedacji (6 stopień według skali Ramsay´a), jednak po zatrzymaniu podaży sewofluranu konieczne było włączenie ciągłego wlewu nitrogliceryny ze względu na wysokie wartości ciśnienia tętniczego.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kong KL, Willatts SM, Prys-Roberts C: Isoflurane compared with midazolam for sedation in the intensive care unit. BMJ 1989; 298: 1277-1280.
2. Arnold JH, Truog RD, Rice SA: Prolonged administration of isoflurane to pediatric patients during mechanical ventilation. Anesth Analg 1993; 76: 520-526.
3. McIndoe AK, Stewart P, Wilson IH: Drawover vaporizers for sedation in intensive care. Intensive Care Med 1997; 23: 704-707.
4. Meiser A, Sirtl C, Bellgardt M, Lohmann S, Garthoff A, Kaiser J, Hügler P, Laubenthal HJ: Desflurane compared with propofol for postoperative sedation in the intensive care unit. Br J Anaesth 2003; 90: 273-280.
5. Bedi A, Murray JM, Dingley J, Stevenson MA, Fee JP: Use of xenon as a sedative for patients receiving critical care. Crit Care Med 2003; 31: 2470-2477.
6. Thomasson R, Luttropp HH, Werner O: A reflection filter for isoflurane and other anaesthetic vapours. Eur J Anaesthesiol 1989; 6: 89-94.
7. Enlund M, Wiklund L, Lambert H: A new device to reduce the consumption of a halogenated anaesthetic agent. Anaesthesia 2001; 56: 429-432.
8. Sydow M, Neumann P: Sedation for the critically ill. Intensive Care Med 1999; 25: 634-636.
9. Higgins TL, Yared JP, Estafanous FG, Coyle JP, Ko HK, Goodale DB: Propofol versus midazolam for intensive care unit sedation after coronary artery bypass grafting. Crit Care Med 1994; 22: 1415-1423.
10. Ostermann ME, Keenan SP, Seiferling RA, Sibbald WJ: Sedation in the intensive care unit: a systematic review. JAMA 2000; 283: 1451-1459.
11. Murdoch S, Cohen A: Intensive care sedation: a review of current British practice. Intensive Care Med 2000; 26: 922-928.
12. Herr DL, Sum-Ping ST, England M: ICU sedation after coronary artery bypass graft surgery: dexmedetomidine-based versus propofol-based sedation regimens. J Cardiothorac Vasc Anesth 2003; 17: 576-584.
13. Simmons LE, Riker RR, Prato BS, Fraser GL: Assessing sedation during intensive care unit mechanical ventilation with the Bispectral Index and the Sedation-Agitation Scale. Crit Care Med 1999; 27: 1499-1504.
14. Frenzel D, Greim CA, Sommer C, Bauerle K, Roewer N: Is the bispectral index appropriate for monitoring the sedation level of mechanically ventilated surgical ICU patients? Intensive Care Med 2002; 28: 178-183.
15. Tempia A, Olivei MC, Calza E, Lambert H, Scotti L, Orlando E, Livigni S, Guglielmotti E: The anesthetic conserving device compared with conventional circle system used under different flow conditions for inhaled anesthesia. Anesth Analg 2003; 96: 1056-1061.
16. Loscar M, Conzen P: Volatile Anästhetika. Anaesthesist 2004; 53: 183-197.

