© Borgis - Nowa Pediatria 1/2001, s. 20-26
Leszek Bęc, Maciej A. Karolczak
Rola układowej odpowiedzi zapalnej w krążeniu pozaustrojowym. Część druga: leukocyty
Systemic inflammatory response in cardiopulmonary bypass. Part II: leukocytes
z II Katedry i Kliniki Kardiochirurgii i Chirurgii Ogólnej Dzieci Akademii Medycznej w Warszawie
Kierownik Katedry: prof. dr hab. med. Maciej A. Karolczak
Streszczenie
Post-perfusion syndrome is a complication of cardiopulmonary bypass (CPB). It is associated with activation of immunological systems and inflammatory response of the body. This article reviews pathology and methods of preventing and management of „post-pump” syndrome.

W trakcie układowej odpowiedzi zapalnej spowodowanej użyciem krążenia pozaustrojowego (CPB) dochodzi do aktywacji układów cytokin, dopełniacza, kalikreiny, krzepnięcia i fibrynolizy. Efektem końcowym tego procesu jest gromadzenie się leukocytów w tkankach narządów miąższowych – przede wszystkim w płucach i mięśniu serca. Sekwestracja neutrofilów jest mechanizmem złożonym, który w znaczny sposób wpływa na przebieg pooperacyjny u pacjentów po zabiegach kardiochirurgicznych. Dzięki cząstkom adhezyjnym leukocyty łączą się z komórkami śródbłonka, migrują przez ścianę naczynia do tkanek otaczających i ulegają degranulacji niszcząc strukturę narządu. Nie bez znaczenia pozostaje czas trwania krążenia pozaustrojowego – wraz z jego wzrostem zwiększa się również liczba przylegających leukocytów (4).
Poznanie patofizjologii procesu sekwestracji umożliwia jego minimalizację podczas operacji, a także odpowiednie leczenie w okresie pooperacyjnym.
Cząstki adhezyjne
Cząstki adhezyjne są niezmiernie ważnym ogniwem procesu sekwestracji, warunkują bowiem przyleganie neutrofilów do komórek śródbłonka. Niektóre z nich są obecne w komórkach tylko jednego rodzaju (np. w neutrofilach, trombocytach). Inne występują jednocześnie na powierzchni różnych komórek. Mogą być one również uwalniane do krwi i są wtedy określane mianem frakcji rozpuszczalnej (13). W procesie adhezji leukocytów do ściany śródbłonka każdy z receptorów błony komórkowej neutrofila musi połączyć się ze swoim odpowiednikiem (czyli ligandem) w endothelium. Istotną rolę spełnia także kolejność łączenia się cząsteczek adhezyjnych. Proces przylegania jest procesem dynamicznym, zależnym od wielu czynników (15, 17) i może zachodzić pomiędzy innymi komórkami, jeśli tylko na ich powierzchni obecne są adhezyny.
Podczas operacji kardiochirurgicznych z użyciem krążenia pozaustrojowego (CPB) dochodzi zarówno do zwiększania ilości receptorów na powierzchni komórek, jak i poziomów frakcji rozpuszczalnej. Także aktywacja płytek krwi nasila ekspresję adhezyn na leukocytach i monocytach, prowadząc do powstania w krążeniu kompleksów leukocytarno-płytkowych (17).
Mechanizmy działania cząstek adhezyjnych zostały poznane dzięki zastosowaniu przeciwciał monoklonalnych. W badaniach in vitro i w doświadczeniach na zwierzętach wykazano zmniejszenie obszaru niedokrwiennego i poprawę funkcji mięśnia sercowego na skutek zablokowania receptorów adhezji przeciwciałami (17).
Wyróżnia się 3 rodziny receptorów adhezyjnych: selektyny, integryny oraz cząstki należące do grupy superimmunoglobulin.
Selektyny
P-selektyna swoją nazwę zawdzięcza występowaniu na powierzchni płytek krwi, chociaż jej obecność stwierdza się również na komórkach śródbłonka. Inną jej nazwą jest GMP-140 (granule membrane protein 140). Pod względem biochemicznym jest ona glikoproteiną, magazynowaną głównie w a-ziarnistościach nieaktywnych trombocytów oraz ciałkach Weibel-Palade´a komórek endothelium (2, 15). Najważniejszymi induktorami jej syntezy są: interleukina 1 (IL-1) oraz czynnik martwicy guza (TNFa), a także histamina i trombina. Ekspozycja komórek na wspomniane mediatory zapalne powoduje zlewanie się ciałek Weibel-Palade´a z błoną komórkową. Ekspresja adhezyny na powierzchni śródbłonka lub trombocytów następuje już po 3 minutach od momentu zadziałania czynnika pobudzającego. Po ok. 20-30 minutach jej cząstki są usuwane poprzez wchłonięcie do cytoplazmy komórki. W odróżnieniu od cząstek powierzchniowych frakcja osoczowa P-selektyny pojawia się stosunkowo późno – dopiero w końcowym okresie operacji przeprowadzanej z użyciem krążenia pozaustrojowego (2). GMP-140 powoduje natychmiastową adhezję neutrofilów do śródbłonka. Jej działanie wymaga jednak obecności wolnych jonów Ca++ oraz Mg++. Dowiedziono, że P-selektyna odgrywa znaczną rolę w niedokrwieniu mięśnia sercowego, a jej neutralizacja powoduje poprawę funkcji myocardium (2).
L-selektyna jest składnikiem błony komórkowej leukocytów. Obecność tej cząstki adhezyjnej stwierdza się już we wczesnym okresie odpowiedzi zapalnej organizmu. Badania doświadczalne, w których zastosowano przeciwciała monoklonalne, wykazały upośledzenie przylegania neutrofilów do komórek śródbłonka. W procesie adhezji do endothelium L-selektyna jest odpowiedzialna za tzw. rolling – czyli toczenie się neutrofila po powierzchni ściany naczynia (17). Aktywacja neutrofilów jest jednocześnie początkiem szybkiego zmniejszenia ilości L-selektyny na ich powierzchni (15). Być może jest to mechanizm autoregulacji procesu sekwestracji poprzez upośledzenie przylegania leukocytów.
E-selektyna, zwana również ELAM-1 (endothelial leukocyte adhesion molecule-1) występuje tylko w komórkach śródbłonka. Jest bardzo czułym wskaźnikiem procesu zapalnego, ponieważ w komórkach nieaktywnych jej ilość jest prawie niezauważalna. Ekspresję powierzchniową ELAM-1 powoduje TNFa, a efekt ten nasilany jest przez hipoksję (17). Czynnikiem hamującym pojawienie się adhezyny na powierzchni błony komórkowej jest hipotermia (17). Nie mają nań wpływu IL-6 oraz IL-8 (6). O wzroście liczby receptorów E-selektynowych podczas krążenia pozaustrojowego świadczyć może zwiększenie poziomu mRNA i ELAM-1 w komórkach mięśnia sercowego (2). Maksymalne stężenie selektyny w błonie komórkowej endothelium przypada na 2-4 godz. po zadziałaniu czynnika stymulującego. ELAM-1 pojawia się jednak na powierzchni śródbłonka tylko chwilowo i podlega znacznie nasilonemu zjawisku turn-over (15). Poziom frakcji osoczowej E-selektyny nie wzrasta podczas CPB - być może świadczy to o jej wiązaniu się z aktywowanymi leukocytami. ELAM-1 odgrywa znaczącą rolę w inicjacji procesu adhezji, wspomagając przyleganie neutrofilów do ściany naczynia.
Integryny
Stanowią niewątpliwie największą grupę cząsteczek adhezyjnych. Są to glikoproteiny przezbłonowe, których każda cząsteczka zbudowana jest z jednego łańcucha a i jednego łańcucha b (2, 15, 17). Ze względu na łańcuch b adhezyny te dzielą się na b1 integryny (znane również jako późne antygeny VLA – very late antigens), oraz b2 integryny, które obecne są w błonie komórkowej neutrofilów. Łańcuch b2 określa się także jako podjednostkę CD18. Może ona być połączona z jednym z trzech łańcuchów a (L, M lub X) noszących miano CD11 (odpowiednio a, b lub c). Powstałe zatem kombinacje to CD11a/CD18, CD11b/CD18, CD11c/CD18. Ze względu na różnorodność mianownictwa immunologicznego ich nazwy analogiczne zostały umieszczone w tabeli 1.
Tabela 1. Mianownictwo b2-integryn.
| CD11a/CD18 | aLb2 | LFA-1 lymphocyte function associated antigen-1 |
| CD11b/CD18 | aMb2 | MAC-1 macrophage antigen-1 |
| CD11c/CD18 | aXb2 | p 150,95 |
Najważniejszą rolę w patofizjologii układowej odpowiedzi zapalnej spełniają CD11a/CD18 i CD11b/CD18 (2). Czynnikami stymulującymi ich ekspresję powierzchniową są przede wszystkim: składowa dopełniacza C5a, IL-8 oraz leukotrien LTB4 (9, 15). Działanie tych substancji chemotaktycznych powoduje rekrutację integryn z organelli wewnątrzkomórkowych, takich jak np. ziarnistości neutrofilów. Wskutek fuzji ziarnistości z błoną komórkową dochodzi do zwiększenia ilości receptorów integrynowych na powierzchni granulocyta. Dzięki badaniom biochemicznym i immunologicznym izolowanych łańcuchów a za pomocą przeciwciał monoklonalnych poznano nie tylko funkcje integryn, ale także dynamikę ich zmian podczas operacji w krążeniu pozaustrojowym.
CD11a/CD18 jest zaangażowana w proces migracji neutrofilów przez ścianę naczynia. Z wyjątkiem jednej pracy nie odnotowano jednak bezpośredniego wzrostu jej stężenia podczas CPB (2, 17). Wykazano jednak wzrost odsetka neutrofilów wykazujących obecność podjednostki CD11a z 30% przed operacją do 75% po zakończeniu krążenia pozaustrojowego (18).
CD11b/CD18 odpowiada za wiązanie się neutrofilów z komórkami śródbłonka, cząstkami fibrynogenu i wywiera wpływ na degranulację (2, 11). Jej ekspresja błonowa jest bardzo szybka – pojawienie się na powierzchni komórki jest stwierdzane w przeciągu 2 do 4 minut od momentu zadziałania czynnika stymulującego (12). Wartości maksymalne CD11b/CD18 osiąga jednakże w okresie późniejszym: na błonie komórkowej neutrofilów po 4 godzinach od zakończenia CPB, a w monocytach w 24 godziny po operacji (2), wynosząc 300-350% stężenia sprzed zabiegu (9, 16). Operacja przeprowadzona z oziębieniem organizmu zmniejsza ekspresję integryny, ale tylko do momentu powrotu do normotermii (17).
CD11c/CD18 – zmiany jej stężenia pokrywają się z dynamiką zmian CD11b/CD18.
Rodzina superimmunoglobulin
Zbudowane są z pojedynczego łańcucha glikoproteinowego, występującego na powierzchni komórek śródbłonka. Mogą również występować na wszystkich innych komórkach docelowych dla aktywowanych limfocytów T (15). Wśród immunoglobulin wyróżnić można ICAM (intracellular adhesion molecule) oraz VCAM-1 (vascular adhesion molecule-1). ICAM-1 jest ligandem dla integryny CD11a/CD18. Synteza ICAM-1 następuje pod wpływem TNFa, IL-1 oraz interferonu gamma (IFNg), endotoksyny. Ekspresja ICAM-1 spada po założeniu klemu na aortę – prawdopodobnie poprzez związanie się immunoglobuliny z aktywowanymi leukocytami (2). Adhezyna ta osiąga najwyższe stężenie po 2 godzinach od momentu ekspozycji na cytokiny. Stwierdzono, że po 24 godzinach od operacji jej stężenie pozostaje nadal podwyższone (2, 15).
ICAM-2 łączy się z integryną CD11b/CD18 (17). Jest podstawowym składnikiem błony komórkowej komórek śródbłonka i nie podlega działaniu cytokin (15).
Mechanizm adhezji
W warunkach fizjologicznych prawidłowy przepływ krwi przez łożysko naczyń płucnych jest wypadkową działań stymulujących i hamujących.
Do zwolnienia prądu krwi przyczyniają się przede wszystkim siły tarcia i przylegania, występujące między neutrofilami a komórkami śródbłonka. Nie bez znaczenia pozostaje również możliwość zmiany kształtu leukocytów. Podczas przejścia przez system kapilar płucnych neutrofile przybierają bowiem profil owalny zamiast kulistego. Zjawisko to jest niezbędne do pokonania naczynia o średnicy światła równej 5 mikrometrom, podczas gdy wielkość neutrofila to 7 mikrometrów (17).
Uszkodzenia powodowane przez leukocyty, a powstające w przebiegu układowej odpowiedzi zapalnej, można podzielić na trzy grupy:
1. powstałe na skutek zaburzeń zdolności komórki do zmiany kształtu, prowadzące do zatorów neutrofilowych w świetle naczynia;
2. będące wynikiem aktywacji miejscowej, przebiegającej z degranulacją ziarnistości i uszkodzeniem tkanek otaczających;
3. prowadzące do upośledzenia funkcji tkanek i narządów w mechanizmie reperfuzji (17).
Aktywacja neutrofilów polega nie tylko na możliwości łączenia się z innymi komórkami. Istotną składową pobudzenia neutrofila jest brak możliwości deformacji, będący według niektórych czynnikiem wydłużającym przechodzenie leukocytów przez łożysko płucne i inicjującym proces przylegania do komórek śródbłonka (9, 17). Sugestie te mogą potwierdzać badania, które dowiodły różnic retencji neutrofilów o różnych współczynnikach zmiany kształtu; te o dużej zdolności do deformacji są rzadziej wychwytywane w płucach. Upośledzenie możliwości zmiany kształtu polega na uszkodzeniu właściwości elastycznych błony komórkowej leukocytów i jest najbardziej nasilone w ciągu pierwszej doby po operacji z użyciem CPB (17).
Inni badacze twierdzą, że proces przylegania komórek jest zależny przede wszystkim od obecności na ich powierzchni adhezyn (9). Zwiększenie stężenia osoczowego takich substancji jak trombina, histamina, TNFa, C5a, IL-1, IFNg, LTB4 wzmaga ekspresję powierzchniową integryn, selektyn i superimmunoglobulin (15). Cząstki te łączą się w pary ligandów umożliwiając zatrzymanie krążących neutrofilów przez komórki endothelium (tab. 2).
Tabela 2. Pary ligandów warunkujące adhezję.
| Cząstka adhezyjna neutrofila | Ligand śródbłonkowy |
| Glikoproteidy neutrofila | GMP-140 |
| Glikoproteidy neutrofila | ELAM-1 |
| CD11a/CD18 | ICAM-1, ICAM-2 |
| CD11b/CD18 | ICAM-1, C3bi |
| CD11c/CD18 | C3bi |
Adhezja neutrofilów do komórek śródbłonka jest procesem niezwykle dynamicznym. Jej początkowy okres nie wymaga syntezy nowych receptorów i zachodzi dzięki adhezynom już obecnym w błonie komórkowej oraz uwalnianiu wcześniej zsyntetyzowanych cząstek z ziarnistości komórkowych i ciałek Weibel-Palade´a. GMP140, MAC-1 i p150.95 osiągają powierzchnię komórki w ciągu kilku minut od jej aktywacji. LFA1 przechodzi natomiast zmianę konformacji i wpływa na pobudzenie leukocytów (15).
GMP140 i MAC-1 grają ważną rolę w zainicjowaniu adhezji neutrofilów do endothelium, ale ich działanie jest ograniczone zarówno poprzez spadek ilości receptorów na powierzchni komórki do poziomu podstawowego jak i odwrócenie zmian konformacji w ciągu 30 minut. Wydłużenie czasu przylegania do śródbłonka jest zatem zależne od syntezy nowych receptorów (15).
Proces migracji można podzielić na kolejno następujące po sobie trzy etapy. Pierwszy obejmuje zmianę charakteru i prędkości przepływu leukocytów. Komórki morfotyczne krwi poruszają się w łożysku płucnym z prędkością ok. 1000 mm/s wzdłuż osi długiej naczynia. Dzięki obecności selektyn dochodzi do zwolnienia przepływu do prędkości 30 mm/s i marginalizacji leukocytów w świetle kapilar. To zjawisko znane również jako rolling, czyli toczenie się, jest wstępem do całkowitego zatrzymania neutrofila (ryc. 1). Stąd też niektórzy nazywają je pierwotną adhezją (primary adhesion). Dynamika toczenia jest bardzo różna i zależna od sił tarcia pomiędzy neutrofilem a komórką śródbłonka. Zmniejszenie tarcia sprzyja rollingowi, zwiększenie zaś powoduje plateau tego procesu (14).
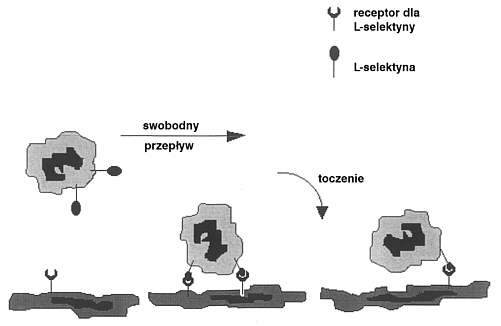
Ryc. 1. Zjawisko toczenia się (rolling).
Drugi etap związany jest z lokalną aktywacją neutrofilów. Czynniki chemotaktyczne takie jak C5a, czynnik aktywujący płytki (RAF) czy też interleukina 8 pobudzają leukocyty do ekspresji kolejnych cząstek adhezyjnych i wywierają wpływ na degranulację.
Podczas trzeciego etapu dochodzi do wtórnej adhezji i migracji neutrofilów poza światło naczynia. Zachodzi ona dzięki integrynom i superimmunoglobuliom (9). Łączenie się tych cząstek powoduje ścisłe przyleganie komórki leukocytarnej do śródbłonka w taki sposób, iż leukocyt nie może się dalej poruszać z prądem krwi (ryc. 2).
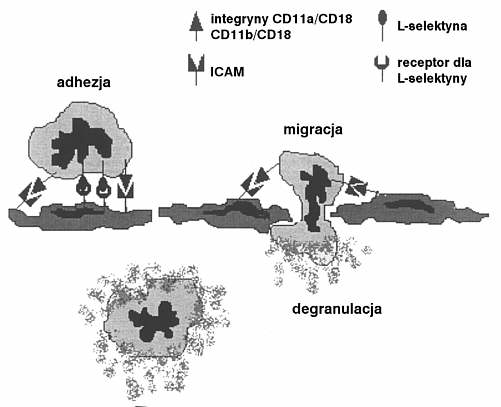
Ryc. 2. Adhezja wtórna, migracja i degranulacja neutrofilów.
W odróżnieniu od neutrofilów limfocyty nie podlegają zjawisku toczenia się po powierzchni komórek endothelium: w tym przypadku adhezja jest procesem natychmiastowym i jednoetapowym (17).
Migracja leukocytów i uszkodzenie otaczających tkanek
Wiązanie tworzone przez układ b2-integryn i superimmunoglobulin jest wiązaniem na tyle silnym, iż uniemożliwia przenikanie leukocytu poza światło naczynia. Interleukina 8, produkowana przez aktywowane komórki śródbłonka, hamuje powstawanie tych połączeń zmniejszając równocześnie przyleganie neutrofilów do endothelium (15) (na drodze zmniejszenia powinowactwa). Wobec zmniejszenia natężenia adhezji neutrofile tworzą wypustki (pseudopodia) szukając miejsc zmniejszonej oporności pomiędzy komórkami śródbłonka. Jest to „działanie uzasadnione”, gdyż mediatory zapalne takie jak histamina, bradykinina czy też leukotrieny, uwalniane podczas układowej odpowiedzi zapalnej, powodują uszkodzenie integralności endothelium i wzrost przepuszczalności naczyń. W powstałe pory między komórkami śródbłonka wciskają się neutrofile (15). Ich aktywacja spowoduje degranulację i uwolnienie enzymów proteolitycznych. W efekcie strawiona zostaje błona podstawna śródbłonka, będąca ostatnią przeszkodą dla neutrofilów w procesie migracji do otaczających tkanek. Proces ten blokowany jest przez antyproteazy (np. przez a1-inhibitor, a2-makroglobulinę, antytrombinę III, C1 antyelastazę czy antychymotrypsynę) syntetyzowane przez śródbłonek. Niezmiernie ważną rolę patogenną odgrywają tu właśnie TNF-a, IL-1 i IFNg, które zwiększając poziom enzymów proteolitycznych zaburzają układ dynamicznej równowagi między proteazami i antyproteazami (15).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Asimakopoulos G. et al.: Lung injury and acute respiratory distress syndrome after cardiopulmonary bypass. Ann Thorac. Surg. 1999, 68:1107-15. 2. Asimakopoulos G., Taylor K.M.: Effects of cardiopulmonary bypass on leukocyte and endothelial adhesion molecules. Ann Thorac. Surg. 1998, 66:2135-44. 3. Bando K. et al.: Leukocyte depletion aneliorates free radical-mediated lung injury after cardiopulmonary bypass. J. Thorac. Cardiovasc. Surg. 1990, 99:873-7. 4. Cameron D.: Initiation of white cell activation during cardiopulmonary bypass: cytokines and receptors. J. Cardiovasc. Pharm. 27 (Suppl 1):S1-5, 1996. 5. Deby-Dupont G., Lamy M.: Mediatory w stanach krytycznych. Aktualności w Anestezji i Intensywnej Terapii, 5, 1:5-10. 6. Diago M.C. et al.: Serum soluble selection in patients undergoing cardiopulmonary bypass. Relationship with circulating blood cells and inflammation - related cytokines. Acta Anaesthesiol Scand. 1997, Jun, 41(6):725-30. 7. Edmunds L.H. Jr.: Inflammatory response to cardiopulmonary bypass. Ann Thorac. Surg. 1998, 66:12-6. 8. Fabbri A. et al.: Use of leukocytes depleting arterial line filter during deep hypothermic cardiopulmonary bypass and circulatory arrest: correlation with pulmonary function. 12th Annual Meeting the European Association for Cardio-Thoracic Surgery Abstract P174. 9. Finn A., Dreyer W.J.: Neutrophil adhesion and the inflammatory response induced by cardiopulmonary bypass. Cardiol. Young 1993, 3:244-250. 10. Gu Y.J. et al.: Leukocyte depletion during cardiac operation: A new approach through the venous bypass circuit. Ann. Thorac. Surg. 1999, 67:604-9. 11. Hill G.E.: Cardiopulmonary bypass – induced inflammation: is it important? J. Cardiothorac. Vasc. Anesth. 1998 Apr, 12 (2 Suppl 1) 21-5. 12. Hill G.E. et al.: The influence of cardiopulmonary bypass on cytokines and cell-cell communication. J. Cardiothorac. Vasc. Anesth 11, 3, 1997, 367-375. 13. Kalawski R. et al.: Soluble adhesion molecules in reperfusion during coronary bypass grafting. Eur. J. Cardiothorac. Surg., 1998 Sep, 14(3):290-5. 14. Lei X. et al.: Influence of cell deformation on leukocyte rolling adhesion in shear flow. J. Biomech. Eng. 1999, Dec, 121(6):636-43. 15. Miller B.E., Levy J.H.: The inflammatory response to cardiopulmonary bypass. J. Cardiothorac Vasc. Anesth 1997, 11, 3:355-366. 16. Murkin J.M.: Cardiopulmonary bypass and the inflammatory response: A role for serine protease inhibitors? J. Cardiothorac Vasc. Anesth 1997, 11, 2:19-23. 17. Royston D.: The inflammatory response and extracorporeal circulation. J. Cardiothorac. Vasc. Anesth 1997, 11, 3:341-354. 18. Toft P. et al.: Changes in adhesion molecule expression and oxidative burst activity of granulocytes and monocytes during open-heart surgery with cardiopulmonary bypass compared with abdominal surgery. Eur. J. Anaesthesiol. 1998 May, 15(3):345-53. 19. Wilson I.C. et al.: Leucocyte depletion in a neonatal model of cardiac surgery. Ann. Thorac. Surg., 1993, 55:12-9.


