© Borgis - Nowa Pediatria 3/2001, s. 14-18
Anna Zawadzka-Krajewska, Wioletta Zagórska, Katarzyna Grzela, Marek Kulus
Pierwotna dyskinezja rzęsek (PCD)
Primary ciliary dyskinesia (PCD)
z Kliniki Pneumonologii Chorób Alergicznych i Hematologii
I Katedry Pediatrii Akademii Medycznej w Warszawie
Kierownik Kliniki: dr hab. med. Marek Kulus
Streszczenie
Primary ciliary dyskinesia (PCD) is an autosomal recessive disorder affecting ciliary motility with an incidence of 1 in 15000 to 1 in 60000. PCD should be suspected in individuals presenting the chronic symptoms of bronchopulmonary disease, otitis media and sinusitis. The diagnosis of PCD is usually based on a clinical ground and confirmed by mucociliary transport investigations, as well as ciliary motility and ultrastructure of cilia studies. Management consists of infected mucus drainage and treatment of coexisting suprainfections.

Pierwotna dyskinezja rzęsek (primary ciliary dyskinesia – PCD) jest zespołem objawów chorobowych wynikających z uwarunkowanej genetycznie nieprawidłowej ruchomości rzęsek. Do głównych objawów PCD należą nawracające zakażenie dolnych dróg oddechowych, zatok przynosowych i nosa, niepłodność męska, w połowie przypadków odwrócenie trzewi. Zostały one po raz pierwszy opisane przez Kartagenera w 1933 roku, który zajmując się patogenezą rozstrzeń oskrzeli, pogłębił wcześniejsze obserwacje Siewerta z 1903 roku. Klasyczną triadę objawów zawierającą odwrócenie trzewi, rozstrzenia oskrzeli i zapalenie zatok obocznych nosa nazwano później zespołem Kartagenera (14). W 1975 roku Camner, Mossberg i Afzelius opisali wrodzoną patologię charakteryzującą się brakiem ruchomości rzęsek, odpowiadającą zespołowi Kartagenera, którą nazwali zespołem nieruchomych rzęsek (immotile cilia syndrome – ICS). Rok później Pedersen i Mygind opisali brak ramion dyneinowych w zespole nieruchomych rzęsek. Od 1981 roku, kiedy to zaproponowano nazwę – pierwotna dyskinezja rzęsek (PCD) – do zespołu zalicza się wszelkie zaburzenia ich ruchomości, poczynając na całkowitym braku ruchomości rzęsek, a kończąc na zaburzeniach synchronizacji ich ruchu przy prawidłowej częstości uderzeń.
Częstość występowania pierwotnej dyskinezji rzęsek oceniana jest od 1:15 000 do 1:60 000 żywych urodzeń. Zespół Kartagenera stanowi około 50% przypadków PCD (3).
PCD jest zespołem uwarunkowanym genetycznie, w większości przypadków dziedziczonym autosomalnie recesywnie. Znacznie rzadziej opisano dziedziczenie autosomalne, dominujące lub sprzężone z płcią (15, 26). PCD charakteryzuje się znaczną heterogennością genetyczną, a do potencjalnych lokalizacji genu PCD należą chromosomy 6 (6p), 7 (7q33-q34) i 14 (14q32) (25, 26).
WYSTĘPOWANIE, FUNKCJA I BUDOWA RZĘSEK
Urzęsione komórki nabłonka, z których każda posiada na swojej powierzchni około 200 rzęsek znajdują się w (14):
– górnych drogach oddechowych (w jamach nosa, zatokach obocznych nosa),
– dolnych drogach oddechowych (od głośni do oskrzelików końcowych),
– w uchu środkowym,
– w wyściółce komór mózgu i kanale rdzenia kręgowego,
– nasieniowodach i jajowodach.
W drogach oddechowych reprezentują one 50-80% wszystkich komórek. Najliczniej występują w tchawicy. Wszystkie rzęski obecne w jamie nosowej i trąbce Eustachiusza, zatokach obocznych nosa i drzewie tchawiczo-oskrzelowym poruszają się w kierunku gardła. Taki kierunek ruchu umożliwia wykrztuszenie lub połknięcie i wydalenie drogą przewodu pokarmowego zainhalowanych cząsteczek pyłu, znajdujących się w warstwie śluzu na powierzchni nabłonka dróg oddechowych. Nabłonek dróg oddechowych pokrywa wydzielina śluzowa o dwufazowej strukturze. Wewnętrzna, międzyrzęskowa warstwa płynu surowiczego o niskiej gęstości (zol) wytwarzana jest przez gruczoły śluzowo-surowicze lub powstaje w wyniku przesączania przez błony komórkowe. Śluz tworzący warstwę zewnętrzną o dużej gęstości i lepkości (żel) produkowany jest przez gruczoły śluzowo-surowicze oraz komórki kubkowe. Jej grubość wynosi od 0,5 do 3,5 mm. Szczyty rzęsek są okresowo zanurzane w zewnętrznej, żelowej warstwie śluzowej na głębokość ok. 0,5 mm. Efektem uderzenia rzęski jest przesunięcie tej warstwy względem zolowej warstwy surowiczej. Ruch rzęsek w obrębie kilkunastu sąsiadujących komórek jest metachroniczny, czego efektem jest niewielkie opóźnienie danej fazy ruchu między sąsiednimi polami rzęsek. Powstaje w ten sposób fala metachronalna, porównywana do falującego łanu zboża. Synchronizacja ruchu jest prawdopodobnie efektem mechanicznego oddziaływania między szczytami rzęsek a warstwą śluzową (11). W ruchu rzęsek występuje faza zamachowa, gdy rzęska odgina się w kierunku przeciwnym do kierunku ruchu warstwy żelu i faza efektywnego uderzenia, w której prostuje się i przesuwa śluzową warstwę zewnętrzną. Między uderzeniami rzęska pozostaje w pozycji zabezpieczającej cofaniu się wydzieliny do obwodowych dróg oddechowych (14). Efektywność transportu warstwy żelu zależy nie tylko od liczby aktywnych rzęsek, prędkości i częstości ich uderzeń, ale także od właściwości fizycznych samego śluzu. Jego nadmierna lepkość (np. w odwodnieniu) wiąże się ze zmniejszeniem częstości uderzeń i spowolnieniem transportu śluzowo-rzęskowego. Podobnie ważna jest grubość warstwy zolu. Jeśli grubość tej warstwy jest większa niż długość rzęsek, ich szczyt nie sięga warstwy żelu, a poruszanie staje się nieefektywne. W odwrotnej sytuacji gdy warstwa zolu jest zbyt mała, rzęski są zanurzone w żelu we wszystkich fazach ruchu, co sprawia, że względne poruszanie się warstw śluzu między sobą jest niemożliwe. Prędkość transportu rzęskowego jest największa w tchawicy (10 mm/min.) i maleje sukcesywnie wraz ze zmniejszaniem się średnicy dróg oddechowych, w oskrzelikach wynosi 2 mm/min. Częstość uderzeń waha się w granicach od 6 na sekundę w oskrzelikach do 22 na sekundę w tchawicy. Przeciętna długość rzęski wynosi 5-7mm (16), średnica 0,3?mm. Prawidłowo rzęski leżą pod kątem 5-25 stopni względem siebie. Każda rzęska składa się z układu dziewięciu par mikrotubul obwodowych i jednej pary położonej centralnie (ryc. 1). Pary mikrotubul obwodowych połączone są mostkami neksynowymi. Szprychy radialne łączą obwodowe mikrotubule z parą mikrotubul centralnych (3). Rzęski posiadają zdolność ruchu dzięki białku dyneinie, zależnej od jonów wapnia i magnezu, wykazującej cechy ATP-azy (3). Tworzy ona zewnętrzne i wewnętrzne ramiona wychodzące z mikrotubuli A obwodowego dubletu. Dłuższe ramiona zewnętrzne mają kształt haczyka, krótsze wewnętrzne stykają się z mostkami neksynowymi. Ramiona rozmieszczone są na całej długości mikrotubul co 24 nm. Podczas hydrolizy ATP uwalnia się energia potrzebna do przemieszczenia się mikrotubul względem siebie. Ramiona dyneinowe jednego dubletu przemieszczają się po sąsiednim dublecie mikrotubul. Mostki neksynowe, szprychy radialne zapewniają elastyczny opór i koordynację między poszczególnymi mikrotubulami (11).
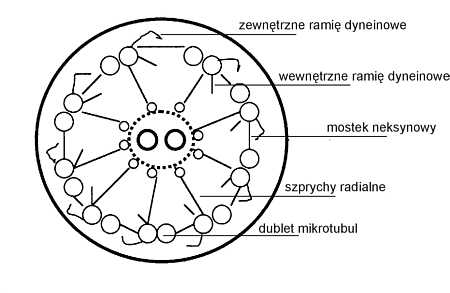
Ryc. 1. Schemat ultrastruktury rzęski.
Tabela 1. Wrodzone zaburzenia funkcjonalno-strukturalne aparatu rzęskowego.
Ramiona dyneinowe
- brak lub zmniejszona ilość zewnętrznych i wewnętrznych ramion dyneinowych
- brak lub zmniejszona ilość zewnętrznych ramion dyneinowych
- brak lub zmniejszona ilość wewnętrznych ramion dyneinowych
Szprychy promieniste
- brak szprych promienistych
- brak głowy szprychy i wewnętrznych ramion dyneinowych
Mikrotubule
- transpozycja mikrotubul
- defekt mikrotubul obwodowych
Mostki neksynowe
- brak wiązań neksynowych i wewnętrznych ramion dyneinowych z dezorganizacją struktury aksonemy
Całkowity brak rzęsek
Nieprawidłowa długość rzęsek
Zaburzenia funkcji z prawidłową strukturą rzęsek
|
ZABURZENIA ULTRASTRUKTURY RZĘSEK
Zaburzenia funkcjonalno-strukturalne aparatu rzęskowego prowadzące do ograniczenia lub braku ruchomości rzęsek przedstawiono w tabeli 1 (2, 10, 16, 22, 26).
Przejściowe zmiany w strukturze wewnętrznej mogą być następstwem ciężkich zakażeń bakteryjnych i wirusowych (22, 24). Zaburzenia ultrastruktury polegają wówczas głównie na nieprawidłowej liczbie i rozmieszczeniu mikrotubul centralnych i obwodowych. Prowadzi to do nieprawidłowego ruchu rzęsek, ponieważ kierunek ruchu określony jest ustawieniem centralnej pary mikrotubul. Przewlekłe zapalenie może prowadzić do zupełnego przejściowego braku rzęsek np. zakażenie wywołane przez Mycoplasma pneumoniae powoduje zaburzenie rzęskogenezy (12). Rzęski w miejscach nie objętych procesem zapalnym nie wykazują zmian w ultrastrukturze. Struktura uszkodzonego nabłonka powraca do normy po upływie około dwóch tygodni po ustąpieniu infekcji (12). Również proces alergiczny może prowadzić do zmian destrukcyjnych w nabłonku rzęskowym. Mediatory eozynofili: eozynofilowe białko kationowe (ECP – eosinofil cationic protein) i główne białko zasadowe (MBP – major basic protein) działają toksycznie na rzęski, już w niewielkim stężeniu powodują hamowanie ruchu rzęsek, a w większym są przyczyną rozległego złuszczania nabłonka oddechowego.
Nabyte uszkodzenie aparatu śluzowo-rzęskowego często jest następstwem zanieczyszczenia środowiska naturalnego. Najistotniejsze znaczenie ma dwutlenek siarki, kwas siarkowy, czynniki fizykochemiczne, głównie wilgotność i temperatura. Optymalna aktywność rzęskowa utrzymuje się w zakresie temperatur 30-40°C i wilgotności względnej większej niż 90%. Do zatrzymania ruchu rzęsek dochodzi powyżej 40-50°C i poniżej 4-7°C. Dobrze tolerowane są zmiany pH w zakresie 2-9 oraz odwodnienie ogólnoustrojowe. Hipoksja powoduje jedynie przejściowe zmniejszenie aktywności rzęsek, gdyż są one zaopatrywane w tlen z dwóch źródeł: przez krew i bezpośrednio z powietrza oddechowego. Anoksja powoduje nieodwracalne zahamowanie transportu (12).
OBRAZ KLINICZNY
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Afzelius B.A.: A human syndrome caused by immotile cilia. Science 1976, 193:317-9. 2. Afzelius B.A. et al.: Abnormal lenght of cilia as a possible cause of defective mucocillary clearence. Eur. J. Resp. Dis. 1985, 66:173-80. 3. Afzelius B.A.: Immotile cilia syndrome: post present and prospects for the future. Thorax, 1998, 53:894-7. 4. Armengot M. et al.: Immotile cilia syndrome: nasal mucociliary function and nasal ciliary abnormalities. Rhinology. 1994, 32:109-11. 5. Holzmann D. et al.: Diagnostic approach to primary ciliary dyskinesia: A reviev.Eur. J. Pediatr. 2000, 159:95-8. 6. Kardag B. et al.: Nasal and liver airway level of nitric oxide in children with primary ciliary dyskinesia. Eur. Respir. J.1999, 13:1402-6. 7. Koh Y.Y. et al.: The effect of regular salbutamal on lung function and bronchial responsiveness in patients with primary ciliary dyskinesia. Chest. 2000, 117:427-33. 8. Liote H. et al.: Role of mucus and cilia in nasal mucociliary clearance in healthy subjects. Am. Rev. Respir. Dis. 1989, 140:132-6. 9. Losa M. et al.: Kartagener syndrome: an uncommon cause of neonatal respiratory distress? Eur. J. Pediatr.1995, 145:236-8. 10. Lungarella G. et al.: Ultrastructural obserwations on based apparatus of respiratory cilia in immotile cilia syndrome. Eur. J. Resp. Dis.1985, 66:165-72. 11. Manasterski J.: Transport śluzowo-rzęskowy w obrębie górnych dróg oddechowych. Otolaryng. Pol. 1992, 46:305-12. 12. Manasterski J.: Wpływ czynników zewnątrz- i wewnątrz-ustrojowych na transport śluzowo-rzęskowy. Otolaryng. Pol.1992, 46:515-20. 13. Manasterski J.: Stany chorobowe związane ze zmienioną budową i czynnością rzęsek nabłonka dróg oddechowych. Otolaryng. Pol. 1992, 46:590-3. 14. Meeks M., Bush A.: Primary ciliary diskinesia. Ped. Pulmonol. 2000, 29:307-16. 15. Narayan D. et al.: Unusual inheritance of primary ciliary dyskinesia (Kartagener´s syndrom). J. Med. Genet.1994, 31:493-6. 16. Niggemann B. et al.: Abnormal lenght of cilia – a cause of primary ciliary dyskinesia – a case report. Eur. J. Pediatr.1992, 151:73-5. 17. Phillips G.E. et al.: Airway response of children with primary ciliary diskinesia to exercise and beta2-agonists challange. Eur. Respir. J.1998, 11:1389-91. 18. Ramet J. et al.: Neonatal diagnosis of the immotile cilia syndrome. Chest. 1986, 90:138-40. 19. Reyes de la Rocha S. et al.: Dyskinetic Cilia Syndrome: clinical, radiographic and scintigraphic findings.Ped. Rad. 1987, 17:97-103. 20. Rutland J. et al.: Nasal brushing and measurement of ciliary beat frequency. Chest.1981, 80:865-7. 21. Schidlow D.V.: Primary ciliary dyskinesia (the immotile cilia syndrome). Ann. Allergy 1994;76:457-68. 22. Sykes D.A. et al.Deleterious effects of purulent sputum sal an human ciliary function in vitro:At least two factors identified. Thorax. 1987, 42:256-61. 23. Whitelaw A.et al.: Immotile cilia syndrome: a new cause of neonatal respiratory distress. Arch. Dis. Child. 1981, 56:432-5. 24. Wilson R.et al.: Effect of bacterial products on human ciliary function in vitro. Thorax.1985, 40:125-31. 25. Witt M. et al.: Exclusion of chromosome 7 for Kartagener Syndrome but suggestion of linkage in families with other formes of primary ciliary dyskinesia. Am. J. Hum. Genet. 1998, 64:313-8. 26. Witt M.: Pierwotna dyskinezja rzęskowa – uwarunkowania genetyczne i anatomiczne. Terapia.1999, 82:25-30.

