© Borgis - Anestezjologia Intensywna Terapia 3/2005, s. 150-154
Bogumiła Wołoszczuk-Gębicka1, Elżbieta Wyska2
Wpływ sewofluranu na ustępowanie zwiotczenia wywołanego przez miwakurium u dzieci*)
The influence of sevoflurane on the recovery from mivacurium-induced neuromuscular block in children
1 Klinika Anestezjologii i Intensywnej Terapii Instytutu „Pomnik-Centrum Zdrowia Dziecka” w Warszawie p.o.
kierownika: dr n. med. B. Wołoszczuk-Gębicka
2 Zakład Farmakokinetyki i Farmacji Fizycznej Collegium Medicum UJ w Krakowie
kierownik: prof. dr hab. n. farm. J. Szymura-Oleksiak
Summary
Background. Sevoflurane may markedly prolong the neuromuscular block caused by mivacurium, and the block may not be completely reversed without discontinuation of sevoflurane. We assessed the clinical course of mivacurium NMT block, comparing sevoflurane with opioid-based anaesthesia. Methods. 24 ASA 1 and 2 children (aged 3-11 years) were randomly allocated to receive 1 MAC nitrous oxide-sevoflurane, (SEVO group, n=12) or nitrous oxide-fentanyl (FENT group, n=12). An intubating dose of mivacurium, 0.2 mg kg-1 was given, and when T1 returned to 5%, muscle relaxation was maintained by continuous infusion of mivacurium, adjusted in a closed loop to maintain a stable 90-99% block. The ulnar nerve was stimulated at the wrist with train-of-four (TOF, 2 Hz repeated every 20s), and electromyographic response was recorded from the adductor pollicis brevis. Results. The results of the study indicated that RF25-75 was significantly longer in the SEVO group (8.8±3.4 vs. 6.1±2.2, p=0.036). However, the maximum time from discontinuation of mivacurium infusion to the time when an endotracheal tube could be safely removed (train-of four ratio TR>80%) was insignificantly longer in the SEVO group and never exceeded 30 minutes. Moreover, RF25-75, which describes an early phase of the recovery of neuromuscular transmission, correlated with the mivacurium requirement (R2 =0.19). Conclusion. Monitoring of neuromuscular transmission during mivacurium infusion and during the recovery phase should be mandatory, because of the large interpatient variability in drug response.

Samoistny powrót przewodnictwa nerwowo-mięśniowego po podaniu miwakurium jest szybki i niezależny od czasu trwania zwiotczenia [1, 2], co umożliwia pominięcie podania inhibitorów esterazy cholinowej w celu przyspieszenia powrotu siły mięśniowej po zakończeniu znieczulenia. Miwakurium rozkładane jest w osoczu przez niespecyficzną pseudoesterazę cholinową (PChE) [3]. U chorych z ciężką niewydolnością wątroby i nerek środek ten działa nieco dłużej niż u osób zdrowych z powodu niższego stężenia PChE [4, 5, 6].
W anestezjologii dziecięcej miwakurium jest często stosowane z wziewnymi środkami znieczulenia ogólnego, które nasilają jego działanie, co prowadzi do zmniejszenia dawki środka, jaką należy podać dla utrzymania właściwego zwiotczenia mięśni i do opóźnienia powrotu przewodnictwa nerwowo-mięśniowego po zaprzestaniu jego podawania [7, 8]. Sewofluran nasila działanie miwakurium bardziej niż halotan czy izofluran [8, 9]. Zauważono, że u niektórych dzieci znieczulonych sewofluranem całkowity powrót przewodnictwa nerwowo-mięśniowego po zaprzestaniu podawania miwakurium następuje dopiero wówczas, gdy przerywa się podawanie sewofluranu.
Celem przeprowadzonych badań była ocena wpływu sewofluranu na samoistny powrót przewodnictwa nerwowo-mięśniowego u dzieci po zakończeniu wlewu miwakurium.
METODYKA
Po uzyskaniu zgody Komisji Bioetycznej Instytutu „Pomnik-Centrum Zdrowia Dziecka” oraz świadomej zgody rodziców, do badań zakwalifikowano dzieci w wieku 3-11 lat, spełniające kryteria stanu fizycznego I i II stopnia wg skali ASA, znieczulanych do planowych zabiegów operacyjnych wymagających intubacji tchawicy i zwiotczenia mięśni. Dzieci z chorobami nerwowo-mięśniowymi, chorobliwie otyłe (z masą ciała>97 centyla wg norm dla dzieci warszawskich), z niewydolnością wątroby lub nerek oraz dzieci otrzymujące leki, które wpływają na przewodnictwo nerwowo-mięśniowe nie zostały włączone do badań.
Dzieci podzielono losowo na dwie grupy, ze względu na dobór środków do znieczulenia. W grupie SEWO znieczulenie przeprowadzono sewofluranem (Sevorane, Abbott, GB) i podtlenkiem azotu z tlenem, w grupie FENT podawano podtlenek azotu z tlenem i fentanyl (Fentanyl, Polfa W-wa, Polska).
Wszystkie dzieci otrzymały premedykację midazolamem (Midanium, Polfa W-wa, Polska), 0,3 mg kg-1 doustnie lub, u dzieci najmłodszych, per rectum.
W grupie SEWO wprowadzenie do znieczulenia przeprowadzone zostało metodą wziewną, z zastosowaniem mieszaniny podtlenku azotu (N2 O) i tlenu (O2 ) oraz sewofluranem w stężeniu 5-7%. Od chwili zniknięcia odruchu rzęsowego znieczulenie podtrzymujące prowadzone było sewofluranem 2,5% w powietrzu końcowo-wydechowym, co odpowiada wartości 1 MAC (w O2 ) dla tej grupy wiekowej [10] i N2 O z O2 (60/40%).
W grupie FENT do wprowadzenia do znieczulenia zastosowano tiopental (Thiopental, Biochemie, Austria) 5 mg kg-1 i fentanyl 1 mg kg-1 oraz N2 O/O2 (60/40%), a znieczulenie podtrzymywane było frakcjonowanymi dawkami fentanylu 1-3 mg kg-1 i N2 O/O2 (60/40%).
Do czasu podania środka zwiotczającego dzieci oddychały spontanicznie przez maskę twarzową. Po podaniu środka zwiotczającego i intubacji tchawicy prowadzono wentylację mechaniczną, utrzymując stężenie ET CO2 w granicach 35-45 mm Hg (4,6-5,9 kPa). Po zakończeniu zabiegu przerywano podawanie sewofluranu i N2 O i po obudzeniu się dziecka oraz stwierdzeniu ustąpienia zwiotczenia, usuwano rurkę z tchawicy.
HR, NIBP, SpO2 , temperaturę ciała (w rectum) i temperaturę ręki, na którą założono elektrody relaksografu oraz stężenie O2 , N2 O, ET CO2 i sewofluranu w gazach wdechowych i wydechowych monitorowano podczas całego znieczulenia. Dzieci ogrzewano materacem w celu utrzymania temperatury w rectum powyżej 36,0°C, a badana ręka była dodatkowo chroniona przed utratą ciepła.
Przewodnictwo nerwowo-mięśniowe monitorowano metodą elektromiograficzną, za pomocą relaksografu (Relaxograph, Datex, Finlandia). Po wprowadzeniu do znieczulenia unieruchamiano badaną rękę i przyklejano skórne elektrody: stymulującą, odbiorczą i uziemiającą. Stosowano stymulację ciągiem czterech impulsów ( train-of-four – TOF, 2 Hz przez 2 s), powtarzanym co 20 s. Dla uzyskania lepszej stabilizacji zapisu elektromiograficznego stymulacja prowadzona była co najmniej przez 10 min przed podaniem środka zwiotczającego [11].
Po ustabilizowaniu się zapisu, podawano miwakurium 0,2 mg kg-1 (Mivacron, Glaxo SmithKline, GB) w postaci szybkiego wstrzyknięcia dożylnego i wykonywano intubację. Następnie miwakurium podawano we wlewie ciągłym, prowadzonym początkowo z szybkością 10 mg kg-1 min-1, a następnie z taką szybkością, aby utrzymać odpowiedź na pierwsze pobudzenie ciągu czterech impulsów (T1 ) w zakresie 1-10% [12, 13]. Szybkość wlewu dobierana była przez komputer pracujący w pętli sprzężenia zwrotnego z relaksografem i pompą infuzyjną.
Powrót przewodnictwa nerwowo-mięśniowego opisano za pomocą trzech wskaźników:
– czasu od podania dawki intubacyjnej do powrotu odpowiedzi na T1 na poziomie 5% wartości kontrolnej,
– RF25-75 – czasu powrotu przewodnictwa liczonego od chwili, gdy odpowiedź na T1 osiąga 25% do chwili gdy odpowiedź na T1 osiąga 75% wartości kontrolnej. Współczynnik ten opisuje wczesną fazę powrotu przewodnictwa nerwowo-mięśniowego,
– T10-TR80 – czasu upływającego od chwili, gdy odpowiedź na T1 osiąga 10% wartości kontrolnej do chwili, gdy współczynnik ciągu czterech (TR=T4 /T1 ) osiąga 80%. Współczynnik ten opisuje powrót przewodnictwa nerwowo-mięśniowego liczony od chwili, gdy odpowiedź mięśnia na stymulację nerwu staje się wykrywalna metodą wzrokową lub dotykiem (T1 =10%) do czasu, gdy spełnione są warunki do bezpiecznej ekstubacji tchawicy (TR=80%).
Jeżeli końcowa wartość T1 różniła się od wartości początkowej o więcej niż 5% przy TR>90%, końcową wartość T1 , której odpowiadało TRł90% przyjmowano za nową wartość referencyjną, względem której obliczano parametry opisujące powrót przewodnictwa [11].
Wszystkie dane liczbowe przedstawiono w postaci średniej, odchylenia standardowego oraz zakresu obserwowanych wartości. Wyniki w grupie SEWO i FENT porównano za pomocą testu t -Studenta, posługując się pakietem STATISTICA, wersja 5,0 (StatSoft, Tulsa, Oklahoma, USA). Korelację pomiędzy poszczególnymi parametrami obliczono za pomocą tego samego pakietu stosując test korelacji liniowej Pearsona.
WYNIKI
Badaniami objęto 24 dzieci, po 12 w każdej grupie. U żadnego nie zaobserwowano objawów ubocznych związanych z uwalnianiem histaminy. U jednego dziecka w grupie SEWO (wiek 6,8 roku, masa ciała 23 kg, wzrost 117 cm), operowanego z powodu choroby Hirschprunga, u którego powrót przewodnictwa nerwowo-mięśniowego był znacznie wolniejszy niż u innych dzieci, stwierdzono obniżenie stężenia pseudocholinesterazy do 2,5 U ml-1 (norma 3,4-6,5 U ml-1). Ponadto, oszacowane w oparciu o model z kompartmentem efektorowym stężenie miwakurium w biofazie, wywołujące 50% efektu maksymalnego (EC50) [14] wynosiło u tego dziecka 6,92 ng ml-1 i było kilkakrotnie niższe niż u innych dzieci znieczulanych sewofluranem, tak więc wszystkie dane dotyczące tego dziecka analizowano oddzielnie. W tabeli I przedstawiono dane demograficzne pozostałych dzieci uczestniczących w badaniu.
Tab. I. Dane demograficzne badanych chorych
| Grupa SEWO (n=11) | Grupa FENT (n=12) | P |
| wiek (lata) | 5,9?2,4 (3-11) | 5,5?2,2 (3-10) | 0,67 |
| wzrost (cm) | 116?16,6 (93-150) | 116?16,6 (93-137) | 0,89 |
| masa ciała (kg) | 22,1?6,6 (12-37) | 21,8?8,1 (12-36) | 0,96 |
Szybkość wlewu miwakurium potrzebna do utrzymania stabilnego bloku przewodnictwa była dwukrotnie mniejsza u dzieci w grupie SEWO w porównaniu do grupy FENT (6,4±2,6 mg kg-1 min-1 vs 13,0±6,5 mg kg-1 min-1, p<0,05).
Sewofluran opóźniał powrót przewodnictwa nerwowo-mięśniowego po podaniu dawki intubacyjnej, jak również po zakończeniu wlewu miwakurium (ryc. 1), jednak istotność statystyczna dotyczyła wyłącznie współczynnika RF25-75.
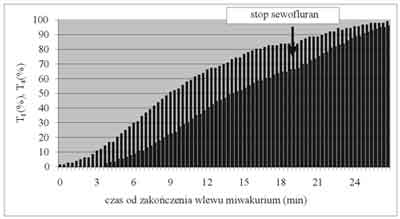
Ryc. 1. Samoistny powrót przewodnictwa nerwowo-mięśniowego u chłopca z prawidłowym stężeniem PChE. Blok przewodnictwa ustąpił dopiero po zaprzestaniu podawania sewofluranu.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Jellish WS, Thalji ZA, Murdoch JR: Recovery from mivacurium-induced neuromuscular blockade after neurosurgical procedures of long duration. J Clin Anaesth 1995; 7: 643-647.
2. Harbut P, Stadtmüller-Bielawska B, Wysoczańska-Harbut J, Kübler A: Kliniczne zastosowanie miwakurium. Anest Inten Terap 1996; 28: 3-7.
3. Cook DR, Stiller RL, Weakly J, Chakravorti S, Brandom BW, Welch RM: In vitro metabolism of mivacurium chloride (BW B1090U) and succinylcholine. Anesth Analg 1989; 68: 452-456.
4. Head-Rapson AG, Devlin JC, Parker CJ, Hunter JM: Pharmacokinetics and pharmacodynamics of the three isomers of mivacurium in health, in end-stage renal failure and in patients with impaired renal function. Br J Anaesth 1995; 75: 31-66.
5. Head-Rapson AG, Devlin JC, Parker CJ, Hunter JM: Pharmacokinetics of the three isomers of mivacurium and pharmacodynamics of the chiral mixture in hepatic cirrhosis. Br J Anaesth 1994; 73: 613-618.
6. Devlin JC, Head-Rapson AG, Parker CJ, Hunter JM: Pharmacodynamics of mivacurium chloride in patients with hepatic cirrhosis. Br J Anaesth 1993; 71: 227-231.
7. Bevan JC, Reimer EJ, Smith MF, Scheppers L deV, Bridge HS, Martin GD, Bevan DR: Decreased mivacurium requirement and delayed neuromuscular recovery during sevoflurane anesthesia in children and adults. Anesth Analg 1998; 87: 772-777.
8. Wołoszczuk-Gębicka B: Mivacurium infusion requirement and spontaneous recovery of neuromuscular transmission in children anaesthetized with nitrous oxide and fentanyl, halothane, isoflurane or sevoflurane. Paediatr Anaesth 2002; 12: 511-518.
9. Wulf H, Hauschild S, Proppe D, Ledowski T: Augmentation of the neuromuscular blocking effect of mivacurium during inhalation anesthesia with desflurane, sevoflorane and isoflurane in comparison with total intravenous anesthesia. Anaesthesiol Reanim 1998; 23: 88-92.
10. Katoh T, Ikeda K: Minimum alveolar concentration of sevoflurane in children. Br J Anaesth 1992; 68: 139-141.
11. Viby-Mogensen J, Engbaek J, Eriksson LI, Gramstad I, Jensen E, Jensen FS, Koúcielniak-Nielsen Z, Skovgaard LT, ¨stergaard D: Good clinical research practice (GCRP) in pharmacodynamic studies of neuromuscular blocking agents. Acta Anesthesiol Scand 1996; 40: 59-74.
12. Wołoszczuk-Gębicka B, Łapczyński T: An algorithm of computerized administration of muscle relaxants. Intl J Art Org 1996: 19, 205.
13. Wołoszczuk-Gębicka B, Łapczyński T, Szreter T: A computerized method of the administration of muscle relaxants. Intl J Art Org 1996; 19: 216.
14. Sheiner LB, Stanski DR, Vozeh S, Miller RD, Ham J: Simultaneous modeling of pharmacokinetics and pharmacodynamics: application to d-tubocurarine. Clin Pharmacol Ther 1979; 25: 358-371.
15. Kaplan RF, Garcia M, Hannallah RS: Mivacurium induced blockade during sevoflurane and halothane anaesthesia in children. Can J Anaesth 1995; 42: 16-20.
16. Lowry DW, Mirakhur RK, Carroll M, McCarthy GJ, Hughes DA, O´Hare RA: Potency and time-course of mivacurium during sevoflurane, isoflurane and intravenous anaesthesia. Can J Anaesth 1999; 46: 29-33.
17. Morita T, Kurosaki D, Tsukagoshi H, Shimada H, Sato H, Goto F: Factors affecting neostigmine reversal of vecuronium block during sevoflurane anaesthesia. Anaesthesia 1997; 52: 538-543.
18. Wołoszczuk-Gębicka B, Wyska E: Mivacurium pharmacokinetic-pharmacodynamic relationship in children under stable mitrous oxide-fentanyl or nitrous oxide-sevoflurane anesthesia. Anesthesiology (Suppl.) 2005, w druku.
19. Lien CA, Belmont MR, Abalos A, Hass D, Savarese JJ: The nature of spontaneous recovery from mivacurium-induced neuromuscular block. Anesth Analg 1999; 88: 648-653.
20. Lejus C, Blanloeil Y, Le Roux N, Soulard D, Mesquish M, Burnat P., Duvalstein P, Pinaud M: Prolonged mivacurium neuromuscular block in children. Paediatr Anaesth 1998; 8: 433-453.
21. Fernández-Rosado B, Vázquez-Fidalgo A, Pensado- Caistineiras A, Figueira-Moure A, Rama-Maceiras P, Pose-Cambreio P: Prolonged neuromuscular blockade caused by mivacurium in a pediatric patient (letter). Rev Esp Anestesial Reanim 1999; 46: 92.
22. Larsen R: Środki zwiotczające mięśnie szkieletowe. w: Larsen R. Anestezjologia. Urban & Partner, Wrocław 2003, 123-161.

