© Borgis - Postępy Fitoterapii 1/2006, s. 23-35
*Bogdan Kędzia
Skład chemiczny i aktywność biologiczna propolisu pochodzącego z różnych rejonów świata
Chemical content and biological activity of propolis from different world regions
Instytut Roślin i Przetworów Zielarskich w Poznaniu
Dyrektor Instytutu: dr hab. n. med. Przemysław M. Mrozikiewicz
Summary
The chemical content and origin of propolis collected from bees in Poland, in countries of temperate climatic zone (poplar propolis), Russia (birch propolis), Mediterranean Region, Canary Islands, Canada, Australia, New Zeland, China, Okinawa, Taiwan and tropic propolis collected in Venezuela, Chile, Brasil has been described. The geopropolis has been regarded also. To the group of chemical compounds occurring in propolis from different world regions belong: aromatic acids, and their esters, flavonoids, coumarins, diterpene acids, benzopyrans, benzofurans, prenylated cinnamic acid, caffeoyl quinicacids, diterpene and triterpene. The biological activity of propolis from different world regions is very similar, independent from the place of origin (the antimicroorganisms, immunostimulating, cytotoxic, antioxidative, hepatoprotective activity).

Skład chemiczny propolisu
W świetle współczesnych badań propolis uważany jest za produkt roślinny będący żywiczną wydzieliną pączków liściowych niektórych drzew lub substancją wysiękową wytwarzaną przez rośliny po ich uszkodzeniu, do której dodawany jest przez pszczoły wosk oraz niewielkie ilości wydzieliny gruczołowej. W propolisie mogą znajdować się ponadto domieszki mechaniczne, takie jak kurz, pyłek kwiatowy, pierzga oraz fragmenty padłych pszczół i konstrukcji ula.
Skład surowego propolisu jest bardzo zróżnicowany. Na ogół składa się on z 50% substancji żywicznych, 30% wosku pszczelego, 10% substancji lotnych, 5% pyłku kwiatowego i 5% domieszek mechanicznych (1). Według polskich danych (2) surowy propolis zawiera średnio 41% żywic, 17% wosku pszczelego, 6% wosku roślinnego, 14% substancji lotnych, 10% substancji garbnikowych i 14% domieszek mechanicznych (w tym 11% pyłku kwiatowego).
Do niedawna sądzono, że propolis pochodzący z różnych rejonów geograficznych różni się składem chemicznym, ale występują w nim pewne określone grupy związków, to znaczy, że różni się on ilościowo, a nie jakościowo. Poglądy te opierano na tym, że propolis pochodzący ze strefy umiarkowanej (Europa, Azja, Ameryka Północna), gdzie źródłem pozyskiwania go przez pszczoły były głównie pączki liściowe różnych gatunków topoli ( Populus sp.), zawierały w swym składzie dużą zawartość kwasów aromatycznych (w tym kwasów fenolowych), estrów aromatycznych i aglikonów flawonoidowych (w tym chalkonów). W niewielkich ilościach w propolisie tym występowały ponadto takie grupy związków, jak kwasy alifatyczne (w tym kwasy tłuszczowe), terpeny (i inne związki lotne), inne związki aromatyczne (w tym alkohole, ketony), węglowodory, aminokwasy, enzymy, cukry, witaminy i biopierwiastki (3, 4).
W tej grupie znajduje się również propolis wytwarzany przez pszczoły w Polsce. Pochodzi on przede wszystkim z pączków liściowych topoli czarnej ( Populus nigra). Wśród kwasów aromatycznych wymienia się: cynamonowy, kawowy, ferulowy (ryc. 1), benzoesowy, salicylowy i 2-amino-3-metoksybenzoesowy.
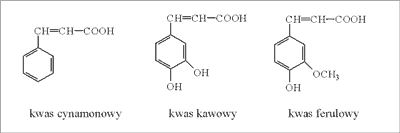
Ryc. 1. Kwas cynamonowy, kawowy, ferulowy (propolis polski).
Do najważniejszych estrów aromatycznych zalicza się estry etylowe kwasu cynamonowego i kawowego oraz fenylometylowe kwasu benzoesowego (5, 6). Najczęściej wykrywano w propolisie takie flawonoidy, jak chryzyna, tektochryzyna, pinostrobina (ryc. 2), apigenina i chalkon pinostrobinowy, rzadziej wzmiankowano o galanginie, kemferolu, genkwaninie i pinobanksynie (7-11).
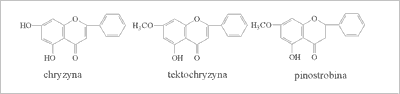
Ryc. 2. Chryzyna, tektochryzyna i pinostrobina (propolis polski).
Z pozostałych związków występujących w polskim propolisie warto wymienić: związki lotne (geraniol, nerol, farnezol, β-eudesmol, kariofilen, patchulen) (5), inne związki aromatyczne (kumaran, wanilinę) (5, 6), węglowodory (eikosan, trikosan, pentakosan, heksadekanol) (12), alkohole triterpenowe (cholinasterol, fukosterol, stigmasterol) (12), enzymy (amylazy, esterazy) (13) i mikroelementy (m.in. mangan, żelazo, krzem, magnez, cynk, selen) (l4, 15).
Propolis typu topolowego występuje poza tym w wielu innych krajach europejskich, takich jak Czechy i Słowacja (16, 17), Węgry (18, 19), Rumunia (20), Bułgaria (21-27), Słowenia (28), Albania (27, 29), Włochy (30, 31), Szwajcaria (31), Austria (3), Niemcy (3, 32, 33), Francja (3, 34, 35), Belgia (34), Wielka Brytania (4, 25, 36), północne i środkowe rejony Hiszpanii (37) oraz Turcji (23, 38, 39).
Obecność propolisu typu topolowego stwierdzono także w Kanadzie (51), Mongolii (22, 27), a nawet w Nowej Zelandii, gdzie występują topole introdukowane (52).
Biorąc pod uwagę powyższe dane z analizy kilkudziesięciu prac wyłania się obraz składu chemicznego propolisu zbieranego przez pszczoły w strefie występowania drzew topolowych. Do najważniejszych grup związków propolisu typu topolowego należą: kwasy aromatyczne, estry aromatyczne i związki flawonoidowe.
Z 25 kwasów aromatycznych występujących w tym propolisie najczęściej występują kwasy: kawowy, benzoesowy, ferulowy, p-kumarowy, 3,4-dimetoksycynamonowy, izoferulowy i cynamonowy.
Wśród 52 estrów aromatycznych najliczniej występują: ester fenetylowy kwasu kawowego – kawoilan fenetylu (CAPE) (ryc. 3), kawoilan benzylu, kawoilan 3-metylo-3-butenylu, kumaran benzylu, kawoilan 3,3-dimetyloallilu, ferulan benzylu, kawoilan cynamylu, ferulan 3-metylo-2-butenylu, cynamonian benzylu i kawoilan 3-metylo-2-butenylu. Wykryto także ferulan i kawoilan pentenylu.
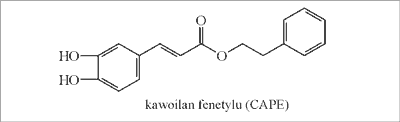
Ryc. 3. Ester fenetylowy kwasu kawowego (propolis topolowy).
W przypadku flawonoidów, występujących w propolisie topolowym w liczbie 79, do najważniejszych zalicza się: chryzynę, pinocembrynę, galanginę, pinobanksynę (ryc. 4), 3-octan pinobanksyny, pinostrobinę, tektochryzynę, kemferol, apigeninę, 3-butanolan pinobanksyny, kwercetynę, naryngeninę i akacetynę.
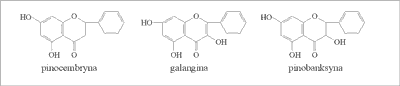
Ryc. 4. Pinocembryna, galangina i pinobanksyna (propolis topolowy).
Powyższe dane oparto na pracach opisujących skład chemiczny propolisu pochodzącego z następujących krajów: Polski (5-11, 40), Słowacji (16, 41-45), Czech (17), Węgier (18, 19, 46), Bułgarii (22-26, 47, 48), Słowenii (28), Chorwacji (49, 50), Albanii (29), Grecji (24), Austrii (3), Niemiec (3, 32), Francji (3, 34, 35), Wielkiej Brytanii (25, 36), Hiszpanii (37), Turcji (23, 38, 39), Kanady (51) i Nowej Zelandii (52).
Warte podkreślenia jest to, że w propolisie hiszpańskim (z rejonu Guadalajary) w puli flawonoidowej występuje dużo chalkonów (głównie 2´,4´,6´-trihydroksychalkon). Ich zawartość dochodzi do 17% (37).
Należy dodać, że na podstawie badań zagęszczonych wyciągów etanolowych z propolisu typu topolowego, pochodzącego z Bułgarii, Albanii, Grecji, Austrii, Niemiec, Francji, Wielkiej Brytanii, Turcji, Hiszpanii i Mongolii można przyjąć, że średnia zawartość kwasów i estrów aromatycznych wynosi 43,2%, związków flawonoidowych 51,5%, a łączna zawartość tych związków wynosi 94,7% (3, 22-26, 37). A zatem można przyjąć, że wyciągi etanolowe, z propolisu typu topolowego prawie w całości składają się z kwasów aromatycznych (głównie kwasów fenolowych), estrów aromatycznych i flawonoidów (w tym chalkonów).
Wśród drzew europejskich, które stanowią źródło propolisu dla pszczół wymienić również należy wierzby ( Salix sp.), wiązy ( Ulmus sp.), jesiony ( Fraxinus sp.), dęby ( Quercus sp.) i kasztanowiec zwyczajny ( Aesculus hippocastanum) (4). Należy przyjąć, że mogą one także w dużym stopniu wpływać na skład propolisu topolowego, podobnie jak inne rośliny występujące na obrzeżach strefy umiarkowanej.
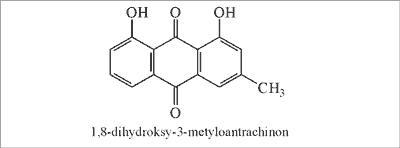
Przykładem może być propolis pochodzący z zachodniej Turcji z prowincji Izmir i Mugla, obfitujące w topole z gatunku P. nigra, który zawiera zarówno niewielką ilość kwasów i estrów aromatycznych (średnio 25,7%), jak i flawonoidów (15,0%). W propolisie tym stwierdzono natomiast znaczną ilość kwasów tłuszczowych (kwas heksadekanowy, kwas olejowy), cukrów prostych (glukoza, fruktoza) i glicerolu (łącznie średnio 57,2%). Dodatkowo propolis z Mugli zawierał kwasy diterpenowe (izopimarowy i abietynowy) (23, 24), Z kolei propolis pochodzący ze wschodniej prowincji Erzurum zawierał średnio 9,6% kwasów i estrów aromatycznych i 3,4% flawonoidów. Próbki propolisu obfitowały natomiast w alkohole aromatyczne i terpeny, głównie w alkohol chryzofanol (ryc. 5) (średnio jego zawartość wynosiła 34,5%) (38). Jeszcze inny skład miał propolis pochodzący ze wschodniej prowincji tureckiej Artvin. Charakteryzował się on niewielką ilością flawonoidów (ok. 2%), podczas gdy kwasy i estry aromatyczne stanowiły znaczną część jego składu, a kwasy p-kumarowy i ferulowy występowały w ilości ok. 10%. Ponadto propolis ten zawierał liczne glicerydy fenolowe. Głównym źródłem propolisu były topole z gatunku P. euphratica (39).
Ryc. 5. Chryzofanol (propolis turecki).
Innym przykładem może być próbka propolisu angielskiego z okolic Oxfordshire, w której stwierdzono tylko 26,2% kwasów i estrów aromatycznych i 15,6% flawonoidów. W próbce stwierdzono ponadto kwasy alifatyczne, kwasy tłuszczowe, węglowodory, seskwiterpeny, cukry i substancje lotne (36).
Skład zbliżony do propolisu topolowego ma także propolis pochodzący ze środkowych i północnych rejonów europejskiej części Rosji, gdzie pszczoły pozyskują go głównie z wydzieliny okrywającej pączki liściowe brzozy brodawkowatej ( Betula verrucosa). Ten typ propolisu występuje w 65% przypadków. Typ topolowy spotykany jest w 15% przypadków, typ brzozowo-topolowy w 15% przypadków i inny typ propolisu spotykany jest w 5% próbek (53).
Wśród kwasów aromatycznych występują głównie: kwas kawowy, kwas p-kumarowy i kwas ferulowy (54). Z estrów aromatycznych wyróżnia się benzoesan p-kumarylu i benzoesan p-koniferylu (55). Flawonoidy reprezentowane są przez akacetynę, kemferyd, ramnocytrynę, ermaninę, 7,4´-dimetoksyapigeninę, 7,4´-dimetoksykemferol, pinostrobinę i 7,4´-dimetoksynaryngeninę (56) oraz luteolinę, kemferol, kwercetynę i robidanol (54). A zatem skład flawonoidowy różni się wyraźnie od składu flawonoidowego propolisu typu topolowego. Poza tym w propolisie brzozowym występują zwykle kumaryny, takie jak eskuletyna, skopoletyna i umbeliferon (ryc. 6), które odróżniają go od propolisu typu topolowego (54).

Ryc. 6. Eskuletyna, skopoletyna, umbeliferon (propolis rosyjski).
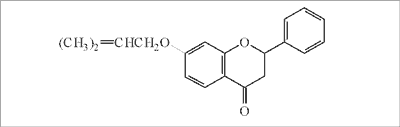
Warto zwrócić uwagę na propolis pochodzący z rejonu Morza Śródziemnego. W propolisie greckim, pochodzącym z północno-zachodniego rejonu Prevezy, zbieranym przez pszczoły prawdopodobnie z wydzieliny drzew szpilkowych ( Pinaceae), stwierdzono po raz pierwszy w Europie pochodne prenylowe flawonoidów, a mianowicie 7-0-prenylostroboponinę i 7-0-prenylopinocembrynę (ryc. 7) oraz związki diterpenowe, takie jak kopalol, izoagatolal, agatadiol, kwas izokupressowy, kwas 13-epi-kupressowy, 13-epi-torulosal i 13-epi-torulosol (57).
Ryc. 7. 7-0-prenylopinocembryna (propolis grecki z rejonu Morza Śródziemnego).
W przypadku próbek propolisu pochodzących z innych rejonów Morza Sródziemnego, rośliny z których jest pozyskiwany przez pszczoły, nie są dotąd dokładnie poznane.
Propolis hiszpański z okolic Murcii zawiera niewielką ilość kwasów i estrów aromatycznych (3,0%) i flawonoidów (2,9%) oraz dużą zawartość węglowodorów nasyconych (alkanów) i wyższych kwasów tłuszczowych (ok. 40%) (37).
Z analiz próbek propolisu tureckiego (z rejonu Mugla i Beytepe) i algierskiego wynika, że zawierają one poza kwasami i estrami aromatycznymi (średnio 21,9%) i flawonoidami (średnio 44,1%), kwasy diterpenowe: pimarowy, izopimarowy, abietynowy, dehydroabietynowy i hydroksyditerpenowy o masie 322, który w ilości średniej 27,7% występował w próbkach propolisu algierskiego (24).
W propolisie egipskim, podobnym do składu propolisu topolowego pod względem kwasów i estrów aromatycznych (22,7%) i flawonoidów (6,8%), stwierdzono dość znaczną zawartość alkoholi triterpenowych (26,3%), takich jak lanosterol, cykloartenol (ryc. 8), β-amyryna, jak również kwasów alifatycznych (16,9%), takich jak mlekowy, bursztynowy, pirogronowy, palmitynowy, olejowy, stearynowy i tetrakozanowy. Charakterystyczne dla propolisu egipskiego okazały się estry kwasu kawowego z długołańcuchowymi alkoholami tłuszczowymi (dodekanolem, tetradecenolem, heksadekanolem) (25).

Ryc. 8. Lanosterol i cykloartenol (propolis egipski).
Na uwagę zasługuje propolis pochodzący z Nowej Zelandii. Okazało się, że w dużym stopniu przypomina on propolis topolowy z tego względu, że pszczoły zbierają materiał do jego wytwarzania z wydzieliny pokrywającej pączki liściowe introdukowanych do tego kraju topoli. Zawiera on średnio 14,5% kwasów i estrów aromatycznych (głównie kwas cynamonowy) oraz średnio 83,9% flawonoidów (głównie pinocembryne, pinobanksynę, 3-octan pinobanksyny i galanginę). Zwraca uwagę obecność w propolisie nowozelandzkim związków aromatycznych nie występujących gdzie indziej, a mianowicie kwasu 5-fenylo-3-pentaenowego i kwasu 5-fenylo-3-pentadienowego (52).
Poza omówionymi powyżej typami propolisu topolowego, wierzbowego i z rejonu Morza Śródziemnego, na świecie występuje wiele innych typów tego produktu, których skład zależny jest od roślin służącym pszczołom do jego pozyskiwania. Każdy z nich odznacza się charakterystycznym składem, wyróżniającym go spośród innych typów propolisu.
W tym kontekście warty omówienia jest propolis pochodzący z Kanady, Wysp Kanaryjskich, Australii, Chin, Urugwaju, Okinawy, Tajwanu, Wenezueli, Chile i Brazylii.
Propolis kanadyjski (z rejonu Ontario) wyróżnia się niewielką ilością kwasów aromatycznych (3,8%), głównie kwasu benzoesowego oraz stosunkowo dużą ilością flawonoidów (28,5%), w tym chryzyną, pinobanksyną, 3-octanem pinobanksyny, galanginą i chalkonami. Chalkony stanowią 66% wszystkich flawonoidów, a głównym składnikiem jest 2´,4´,6´-trihydroksychalkon (ryc. 9) (51). Poza tym propolis kanadyjski obfituje w węglowodory nasycone i wyższe kwasy tłuszczowe oraz cukry. Pod względem ilości chalkonów obecnych w puli flawonoidowej propolis ten przypomina propolis hiszpański z rejonu Guadalajary (37).

Ryc. 9. 2´,4´,6´-Trihydroksychalkon (propolis kanadyjski).
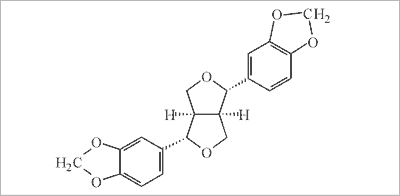
Odmienny typ prezentuje propolis pochodzący z Wysp Kanaryjskich (z wyspy Gran Canaria). Zawiera on śladowe ilości kwasów i estrów aromatycznych (średnio 2,5%), w tym kwas cynamonowy i benzoesan benzylu) i charakteryzuje się całkowitym brakiem flawonoidów. Propolis ten bogaty jest natomiast w lignany furofuranowe. W sumie wyizolowano 11 tych związków, co stanowiło około 40% wszystkich związków, w tym zidentyfikowano sezaminę (ryc. 10), aschantynę, sezarteninę i jongambinę (58). Poza tym w propolisie występowały węglowodory alifatyczne i aromatyczne, monoterpeny i seskwiterpeny, cukry oraz alkohole i kwasy cukrowe (59).
Ryc. 10. Sezamina – lignan furofuranowy (propolis z Wysp Kanaryjskich).
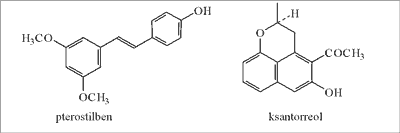
W propolisie australijskim (badania wykonano w 1978 roku) wykryto flawonoidy (pinostrobinę, sakuranetynę, izosakuranetynę i flawanon), pterostilben (związek aromatyczny o strukturze difenyloetylenu) (ryc. 11), ksantorreol (związek piranowy) (ryc. 11) i alkohol 3,5-dimetoksybenzylowy. Prawdopodobnie propolis zbierany był przez pszczoły z drzew z rodzaju Xanthorrhea i Eucalyptus (60).
Ryc. 11. Pterostilben i ksantorreol (propolis australijski).
Chiński propolis charakteryzuje duża zawartość flawonoidów w puli związków fenolowych. Według Bonvehi i wsp. (61) propolis pochodzący ze środkowo-wschodniej prowincji Anhui zawierał 85,2% związków flawonoidowych, w tym w największych ilościach występowały: rutyna, apigenina, izoramnetyna, akacetyna i pinocembryna, w mniejszych ilościach: naryngina, kwercetyna, hesperetyna, pinobanksyna, kemferol, galangina, chryzyna, pinostrobina, tektochryzyna i ramnetyna. Wśród kwasów aromatycznych stwierdzono kwasy: kawowy, ferulowy, synapinowy, m-kumarowy, 4-hydroksycynamonowy i o-cynamonowy. Pulę związków fenolowych uzupełniała wanilina. W badanym chińskim propolisie nie stwierdzono natomiast estrów aromatycznych. Ustalono, że pszczoły zbierały propolis (oceniano 9 próbek propolisu) z takich roślin, jak Robinia pseudoaccacia, Populus sp., Morus sp., Pyrus sp., Prunus sp., Ulmus sp., Salix sp. i Melia azedarach. Warto wspomnieć, że tak wysoką zawartość flawonoidów w puli związków fenolowych wykazywał jeszcze propolis z hiszpańskiej Guadalajary (85,9%), kanadyjskiego Ontario (88,0%) i nowozelandzkiego Waikato (85,3%) (37, 51, 52).
W innych publikacjach dotyczących chińskiego propolisu podano jedynie wyizolowane związki bez żadnych danych ilościowych. Chi i wsp. (62) podają, że w propolisie pochodzącym z Liaoxi stwierdzono obecność flawonoidów: genkwaniny, ramnazyny i 7-0-metylochryzyny oraz estru kawoilanu benzylu, natomiast Usia i wsp. (63) wykryli flawonoidy: 3-0-(S-2-metylobutyrylo)-pinobanksynę, 6-cynnamylochryzynę (ryc. 12), chryzynę, galanginę, izalpininę, apigeninę, tektochryzynę, pinostrobinę i pinocembrynę, kwasy: izoferulowy i 3,4-dimetoksycynamonowy oraz estry: ferulan benzylu, kawoilan benzylu i kawoilan fenetylu.
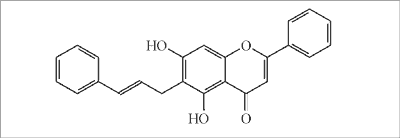
Ryc. 12. 6-Cynnamylochryzyna (propolis chiński).
Badania Bonvehi i wsp. (61) wykazały, że propolis pochodzący z Urugwaju, zbierany przez pszczoły z Eucalyptus globulus, Populus sp., Betula sp. i Salix sp., odznacza się bardzo dużym podobieństwem pod względem jakości i ilości związków fenolowych do propolisu chińskiego. Zawartość flawonoidów w puli związków fenolowych wynosiła 88,2%.
Z propolisu pochodzącego z Tajwanu (64) oraz Okinawy (Japonia) (65) wyizolowano flawonoidy prenylowe. Ustalono, że w obu przypadkach propolis zbierany był przez pszczoły z rośliny o nazwie Hernandia nymphaefolia. Flawonoidy prenylowe z Tajwanu nazwano propolinem A (ryc. 13) i B, a z Okinawy otrzymały nazwy nymphaeol-A (ryc. 13), -B, -C i -D.
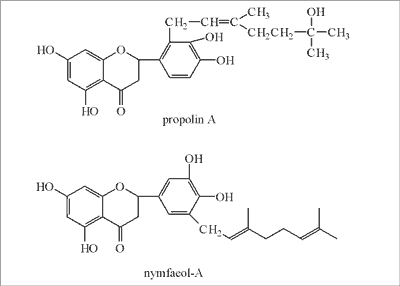
Ryc. 13. Propolin A i nymfaeol-A (propolis z Tajwanu i Okinawy).
W propolisie występującym w Wenezueli, zbieranym przez pszczoły z wydzieliny kwiatów Clusia minor i C. major, wykryto obecność 13 związków flawonoidowych, w tym 3 nowych: hispiduliny, eupatoryny i 5-hydroksy-6,7,3´,4´-tetrametoksyflawonu (66). Ponadto w propolisie pochodzącym z wydzieliny kwiatów Clusia scrobiculata wyizolowano poliizoprenylowane benzofenony – scrobiculatony A (ryc. 14) i B (67).
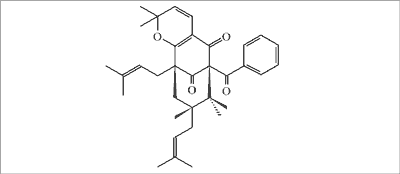
Ryc. 14. Scrobiculaton A (propolis z Wenezueli).
Propolis pochodzący z Chile ma jeszcze bardziej złożony skład. Zawiera on ketony: viscidon (ryc. 15) i octan viscidonu; p-hydroksyacetofenony: trementon i jego pochodne – hydroksylową i octanową; dwie pochodne chromonu; octan koniferylu, ferulan etylu; aldehyd koniferylowy, wanilinę (68) i lignany: dihydrobenzofuranowe w formie aldehydowej i acetyloaldehydowej (ryc. 15), 9,9-bisacetylo-olivil, dwa diastereomery dimerycznego alkoholu koniferylowego i trimer octanu koniferylu (69). Na podstawie analizy pyłkowej stwierdzono, że w propolisie chilijskim dominowały pyłki Eucalyptus globulus, Salix humboldtiana, Baccharis linearis i Buddleja globosa (68).
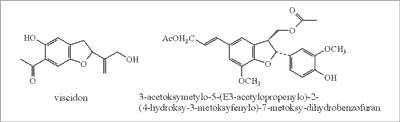
Ryc. 15. Viscidon i lignan dihydrobenzofuranowy (propolis chilijski).
Propolis brazylijski wymaga osobnego omówienia ze względu na jego odmienny i różnorodny skład w porównaniu do wszystkich dotychczas analizowanych propolisów. Jest to propolis tropikalny zbierany przez pszczoły z wielu roślin występujących w strefie ich zamieszkiwania. Najczęściej wymienia się jednak jako źródło propolisu Baccharis dracunculifolia oraz Araucaria heterophylla (70-73).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Burdock G.A.: Review of the biological properties and toxicity of bee propolis (propolis). Food Chem. Toxicol. 1998, 36, 347. 2. Wojtacki M.: Produkty pszczele i przetwory miodowe. PWRiL, Warszawa 1998, 179. 3. Hegazi A.G., Abd El Hady F.K., Abd Allah F.A.M.: Chemical composition and antimicrobial activity of European propolis. Z. Naturforsch. 2000, 55C, 70. 4. Greenaway W., Scaysbrook T., Whatley F.R.S.: The composition and plant origin of propolis: a report of work at Oxford. Bee World 1990, 71, 107. 5. Maciejewicz W., Scheller S., Daniewski M.: Gas chromatography – mass spectrometry investigation of propolis. Analysis of sesquiterpenes. Acta Polon. Pharm. 1983, 40, 251. 6. Maciejewicz W., Daniewski M., Mielniczuk Z.: Gas chromatography – mass spectrometry study of propolis. Chem. Anal. 1984, 29, 421. 7. Pniewska D.Ł.: Poszukiwanie składników propolisu o działaniu biologicznym. Praca magisterska. AM w Poznaniu, Poznań 1979, 8. Żelisławska R.: Chemiczna analiza frakcji propolisu. Praca magisterska. AM w Poznaniu, Poznań 1984. 9. Maciejewicz W.: Skład chemiczny propolisu: najnowsze badania oraz doświadczenia własne. V Międzynar. Symp. Apiterapii, Kraków 1985, 27. 10. Kędzia B., Ellnain-Wojtaszek M., Bylka W. i wsp.: Aktywność mikrobiologiczna różnych frakcji propolisu. V Międzanar. Symp. Apiterapii, Kraków 1985, 18. 11. Maciejewicz W.: Izolacja i identyfikacja związków flawonoidowych z propolisu zebranego na terenie Polski, IV Ogólnopolska Konf. Naukowa, Lublin 1995, P-72. 12. Maciejewicz W., Daniewski M., Mielniczuk Z. i wsp.: Gas chromatography – mass spectrometry investigation of propolis. Analysis of β-steroids. Acta Polon. Pharm. 1982, 39, 277. 13. Kaczmarek F., Dębowski W.J.: Występowanie α- i β-amylazy w propolisie. Acta Polon. Pharm. 1983, 40, 121. 14. Scheller S., Szaflarski J., Tustanowski J. i wsp.: Biological properties and clinical application of propolis. I. Some physico-chemical properties of propolis. Arzneim.-Forsch. 1977, 27, 889. 15. Bogdaszewska-Czabanowska J., Szwarc K., Dembińska B.: Badania alergologiczne nad właściwościami uczulającymi kitu pszczelego (propolis). Przegl. Dermatol. 1980, 67, 747. 16. Suchý V., Nagy M., Grančai D. i wsp.: Constituents of propolis of Czechoslovak origin. Satellite Symp. CPT, Praha 1989, 140. 17. Janeš K., Bumba V.: Beitrag zur Zusammensetzung des Bienenharzes (Propolis). Pharmazie 1974, 29, 544. 18. Pápay V., Solteéz M., Csizmadia B. i wsp.: Chemical and pharmacological study of propolis samples of various locations. Acta Pharm. Hung. 1987, 57, 143. 19. Nagy É., Pâpay V., Litkei G. i wsp.: Investigation of the chemical constituents, particularly the flavonoid components, of propolis and Populi gemma by the GC/MS method. Stud. Org. Chem. (Amsterdam) 1986, 23, 223. 20. Popescu H., Giurgea R., Polinicencu K.: Extractul de propolis standardizat şi medicamentele Candiflor. Centr. Industr. Medicam. Cosm. Color. Lac., Bucureşti 1985. 21. Bankova V.S., Popov S., Marekov N.L.: High-performance liquid chromatographic analysis of flavonoids from propolis. J. Chromatogr. 1982, 242, 135. 22. Bankova V., Dyulgerov A., Popov S. i wsp.: Propolis produced in Bulgaria and Mongolia: phenolic compounds and plant origin. Apidologie 1992, 23, 79, 23. Velikova M., Bankova V., Sorkun K. i wsp.: Chemical composition and biological activity of propolis from Turkish and Bulgarian origin. Mellifera 2001, 1, 57. 24. Velikova M., Bankova V., Sorkun K. i wsp.: Propolis from the Mediterranean region: chemical composition and antimicrobial activity, Z. Naturforsch. 2000, 55C, 790. 25. Christov R., Bankova V., Hegazi A. i wsp.: Chemical composition of Egyptian propolis. Z. Naturforsch. 1998, 53C, 197. 26. Prytzyk E., Dantas A.P., Salomao K. i wsp.: Flavonoids and trypanocidal activity of Bulgarian propolis. J. Ethnopharmacol. 2003, 88, 189. 27. Kujumgiev A., Tsvetkova I., Serkedjieva Y. i wsp.: Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. J. Ethnopharmacol. 1999, 64, 235. 28. Karbavčič A.: Composition of propolis and Peruvian balsam by TLC. III Int. Symp. Apither., Portoroż (Słowenia) 1978, 59. 29. Bankova V., Popov S., Bocari G. i wsp.: Phenolics in Albanian poplar buds and their relationship to propolis. Fitoterapia 1994, 65, 326. 30. Gallo F.R., Savi G.: Propoli: usi e tecniche di rilevazione. Boll. Chim. Farmaceutico 1995, 134, 483. 31. Popova M., Bankova V., Butorska D. i wsp.: Validated methods for the quantification of biologically active constituents of poplar-type propolis. Phytochem. Anal. 2004, 15, 235. 32. Langner E., Schilcher H.: Qualitat und Wirkungen von Propolis bzw. Propoliszubereitungen. Dtsch. Apoth. Ztg. 1999, 139, 3447. 33. Schneidewind E.M., Kala H., Linzer B. i wsp.: Zur Kenntnis der Inhaltsstoffe von Propolis. Pharmazie 1975, 30, 803. 34. Vanhaelen M., Vanhaelen-Fastre R.: Propolis. II. Identification par chromatographies haute-performance (liquide, gaz-liquide et sur couches minces) des constituants. Bioautographie des chromatogrammes des composes antibacteriens. J. Pharm. Belg. 1979, 34, 317. 35. Vennat B., Arvouet-Grand A., Gross D. i wsp.: Qualitative and quantitative analysis of flavonoids and identification of phenolic acids from a propolis extract, J. Pharm. Belg. 1995, 50, 438. 36. Greenaway W., Maj J., Scaysbrook T. i wsp.: Identification by gas chromatography – mass spectrometry of 150 compounds in propolis. Z. Naturforsch. 1991, 46C, 111. 37. Garcia-Viguera C., Greenaway W., Whatley F.R.: Composition of propolis from two different Spanish Regions. Z. Naturforsch. 1992, 47C, 634. 38. Silici S., Kutluca S.: Chemical composition and antibacterial activity of propolis collected by three different races of honeybees in the same region. J. Ethnopharmacol. 2005, 99, 69. 39. Popova M., Silici S., Kaftanoglu 0. i wsp.: Antibacterial activity of Turkish propolis and its qualitative and quantitative chemical composition. Phytomedicine 2005, 12, 221. 40. Ellnain-Wojtaszek M., Bylka W., Skrzypczak L. i wsp.: Badania fitochemiczne i biologiczne czynnych frakcji propolisu. V Miedzynar. Symp. Apiterapii, Kraków 1985, 28. 41. Čižmarik J., Matel I.: Examination of the chemical composition of propolis. I. Isolation and identification of 3,4-dihydroxycinnamic acid (caffeic acid) and propolis. Experientia 1970, 26, 713. 42. Čižmarik J., Matel I.: Examination of the chemical composition of propolis. 2. Isolation and identification of 4-hydroxy-3-methoxycinnamic acid (ferulic acid) from propolis. J. Apicult. Res. 1973, 12, 63. 43. Suchý V., Tekelova D., Petrovic P. i wsp.: Study of the constituents of propolis of Chechoslovak origin. Part 1. Derivatives of flavone and aromatic acids. Farm. Obz. 1981, 50, 543. 44. Suchý V., Tekelovâ D., Grančai D. i wsp.: Studium obsahových lâtek propolisu Československé provenience. III. Derivâty flavononu. Česk. Farm. 1985, 34, 405. 45. Suchý V., Nagy M., Tekelovâ D. i wsp.: Štűdium obsahových lâtok propolisu Slovenskej proveniencie. Derivâty dihydroflavonolu a kyseliny kâvovej. Farm. Obz. 1993, 62, 411. 46. Soltész M.: Testing of chemical materials of propolis samples taken from various places and identification of newer materials. Gyógyszerészet 1988, 32, 483.47. Bankova V.S., Popov S.S., Marekov N.L.: A study of flavonoids of propolis. J. Nat. Prod. 1983, 46, 471. 48. Bankova V.S., Popov S.S., Marekov N.L.: Isopentenyl cinnamates from poplar buds and propolis. Phytochem. 1989, 28, 871. 49. Pepeljnjak S., Jalšenjak I., Maysinger D.: Growth inhibition of Bacillus subtilis and composition of various propolis extracts. Pharmazie 1982, 37, 864. 50. Oršolić N., Terzić S., Mihaljevic Ž. i wsp.: Effects of local administration of propolis and its polyphenolic compounds on tumor formation and growth. Biol. Pharm. Bull. 2005, 28, 1928. 51. Garcia-Viguera C., Ferreres F., Tomâs-Barberân F.A.: Study of Canadian propolis by GC-MS and HPLC. Z. Naturforsch. 1993, 48C, 731. 52. Markham K.R., Mitchell K.A., Wilkins A.L. i wsp.: HPLC and GC-MS identification of the major organic constituents in New Zealand propolis. Phytochem. 1996, 42, 205. 53. Popravko S.A.: Chemické zloţenie propolisu jako povod a otâscky štandarizacie. I Medinar. Symp. o propolisie. Bratislava 1972, 23. 54. Tichonow A.I., Jarnych T.G., Czernych W.P. i wsp.: Teoria i praktyka wytwarzania leczniczych preparatów propolisowych. Wyd. Apipol-Farma, Myślenice 2005. 55. Popravko S.A., Sokolov J.V., Torgov J.V.: Derivatives of unsaturated aromatic alcohols in propolis and gum benzoin. Khim. Prirod. Soedin. 1984, Nr 2, 152. 56. Poprawko S.A., Gurewicz A.I., Kołosow M.N.: Flawonoidnyie komponenty propolisa. Chim. Prirod. Soedin. 1969, 6, 476. 57. Melliou E., Chinou I.: Chemical analysis and antimicrobial activity of Greek propolis. Planta Med. 2004, 70, 515. 58. Christov R., Bankova V., Tsvetkova I. i wsp.: Antibacterial furofuran lignanes from Canary Islands propolis. Fitoterapia 1999, 70, 89, 59. Bankova V.S., Christov R.S., Tejera A.D.: Lignans and other constituents of propolis from the Canary Islands. Phytochem. 1998, 49, 1411. 60. Ghisalberti E.L., Jeffries P.R., Lanteri R. i wsp.: Constituents of propolis. Experientia 1978, 34, 157. 61. Bonvehi J.S., Coll F.V.: Study on propolis quality from China and Uruguay. Z. Naturforsch. 2000, 55C, 778. 62. Chi J.P., Chen H.S., Xue B.W.: Isolation and identification of a new cinnamate ester from Liaoxi propolis. Acta Pharm. Sin. 1996, 31, 558. 63. Usia T., Banskota A.H., Tezuka Y. i wsp.: Constituents of Chinese propolis and their antiproliferative activities. J. Nat. Prod. 2002, 65, 673. 64. Chen. C.-N., Wu C.-L., Shy H.-S. i wsp.: Cytotoxic prenylflavonones from Taiwanese propolis. J. Nat. Prod. 2003, 66, 503. 65. Kumazawa S., Goto H., Hamasaka T. i wsp.: A new prenylated flavonoid from propolis collected in Okinawa, Japan. Biosci. Biotechnol. Biochem. 2004, 68, 260. 66. Tomâs-Barberân F., Garcia-Viguera C., Vit-Olivier P. i wsp.: Phytochemical evidence for the botanical origin of tropical propolis from Venezuela. Phytochem. 1993, 34, 191. 67. Trusheva B., Popova M., Naydenski H. i wsp.: New polyisoprenylated benzophenones from Venezuelan propolis. Fitoterapia 2004, 75, 683. 68. Valcic S., Montenegro G., Mujica A.-M. i wsp.: Phytochemical, morphological, and biological investigations of propolis from Central Chile. Z. Naturforsch. 1999, 54C, 406. 69. Valcic S., Montenegro G., Timmermann B.N.: Lignans from Chilean propolis. J. Nat. Prod. 1998, 61, 771. 70. Marcucci M.C., Bankova V.: Chemical composition, plant origin and biological activity of Brazilian propolis. Curr. Top. Phytochem. 1999, 2, 115. 71. Banskota A., Tezuka Y., Prasain J.K. i wsp.: Chemical constituents of Brazilian propolis and their cytotoxic activities. J. Nat. Prod. 1998, 61, 896. 72. Boudaurova-Krasteva G., Bankova V., Sforcin J.M. i wsp.: Phenolics from Brazilian propolis. Z. Naturforsch. 1997, 52C, 676. 73. Marcucci M.C., Ferreres F., Custôdio A.R. i wsp.: Evaluation of phenolic compounds in Brazilian propolis from different geographic regions. Z. Naturforsch. 2000, 55C, 76. 74. Tazawa S., Warashina T., Noro T. i wsp.: Studies on the constituents of Brazilian propolis. Chem. Pharm. Bull. 1998, 46, 1477. 75. Tazawa S., Warashina T., Noro T.: Studies on the constituents of Brazilian propolis. II. Chem. Pharm. Bull. 1999, 47, 1388. 76. Banskota A.H., Tezuka Y., Adnyana I.K. i wsp.: Hepatoprotective and anti- Helicobacter pylori activities of constituents from Brazilian propolis. Phytomedicine 2001, 8, 16. 77. Marcucci M.C., Rodriguez J., Ferreres F. i wsp.: Chemical composition of Brazilian propolis from Sao Paulo State. Z. Naturforsch. 1998, 53C, 117. 78. Kumazawa S., Yoneda M., Shibata I. i wsp.: Direct evidence for the plant origin of Brazilian propolis by the observation of honeybee behaviour and phytochemical analysis. Chem. Pharm. Bull. 2003, 51, 740. 79. Furukawa S., Takagi N., Ikeda T. i wsp.: Two novel long-chain alkanoic acid esters of lupeol from Alecrim-propolis. Chem. Pharm. Bull. 2002, 50, 439. 80. Ito J., Chang F.-R., Wang H.-K. i wsp.: Anti-AIDS agents. 48. Anti-HIV activity of moronic acid derivatives and the new malliferone-related triterpenoid isolated from Brazilian propolis. J. Nat. Prod. 2001, 64, 1278. 81. Marcucci M.C., Ferreres F., Garcia-Viguera C. i wsp.: Phenolic compounds from Brazilian propolis with pharmacological activities. J. Ethnopharmacol. 2001, 74, 105. 82. Aga H., Shibuya T., Sugimoto T. i wsp.: Isolation and identification of antimicrobial compounds in Brazilian propolis. Biosci. Biotech. Biochem. 1994, 58, 945. 83. Hayashi K., Komura S., Isaji N. i wsp.: Isolation of antioxidative compounds from Brazilian propolis: 3,4-dihydroxy-5-prenylcinnamic acid, a novel potent antioxidant. Chem. Pharm. Bull. 1999, 47, 1521. 84. Matsuno T., Saito M., Matsumoto Y. i wsp.: A new benzo-γ-pyran derivative isolated from propolis. Z. Naturforsch. 1998, 53C, 1037. 85. Hirota M., Matsuna T., Fujiwara T. i wsp.: Enhanced cytotoxicity in a Z-photoisomer of a benzopyran derivative of propolis. J. Nat. Prod. 2000, 63, 366. 86. Pereira A.S., Ramos M.F.S., Poças E.S.C. i wsp.: Study of propolis by High Temperature Resolution Gas Chromatography – Mass Spectrometry. Z. Naturforsch. 1999, 54C, 395. 87. Bankova V., Nikolova N., Marcucci M.: A new lignan from Brazilian propolis. Z. Naturforsch. 1996, 51B, 375. 88. Nafady A.M., El-Shanaway M.A., Mohamed M.H. i wsp.: Cyclodextrin-enclosed substances of Brazilian propolis. Chem. Pharm. Bull. 2003, 51, 984, 89. Mishima S., Yoshida C, Akino S. i wsp.: Antihypertensive effects of Brazilian propolis: identification of caffeoylquinic acids as constituents involved in the hypotension in spontaneously hypertensive rats. Biol. Pharm. Bull. 2005, 28, 1909. 90. Basnet P., Matsushige K., Hase K. i wsp.: Potent antihepatotoxic activity of dicaffeoyl quinic acids from propolis. Biol. Pharm. Bull. 1996, 19, 655. 91. Basnet P., Matsushige K., Hase K. i wsp.: Four di-0-caffeoyl quinic acid derivatives from propolis. Potent hepatoprotective activity in experimental liver injury models. Biol. Pharm. Bull. 1996, 19, 1479. 92. Tatefuji T., Izumi N., Ohta T. i wsp.: Isolation and identification of compounds from Brazilian propolis which enhance macrophage spreading and mobility. Biol. Pharm. Bull. 1996, 19, 966. 93. Bankova V., Boudourova-Krasteva G., Sforcin J.M. i wsp.: Phytochemical evidence for the plant origin of Brazilian propolis from Sao Paulo State. Z. Naturforsch. 1999, 54C, 401. 94. Bankova V., Marcucci M.C., Simova S. i wsp.: Antibacterial diterpenic acids from Brazilian propolis. Z. Naturforsch. 1996, 51C, 277. 95. Matsuno T., Matsumoto Y., Saito M. i wsp.: Isolation and characterization of cytotoxic diterpenoid isomers from propolis. Z. Naturforsch. 1997, 52C, 702. 96. Mitamura T., Matsuno T., Sakamoto S. i wsp.: Effects of a new clerodane diterpenoid isolated from propolis on chemically induced skin tumors in mice. Anticancer Res. 1996, 16, 2669. 97. Pereira A.S., Silva J.F.M., Klitzke R. i wsp.: Pentacyclic triterpenoid alkanoates in propolis. Z. Naturforsch. 1999, 54C, 1115. 98. Furukawa S., Takagi N., Ikeda T. i wsp.: Two novel long-chain alkanoic acid esters of lupeol from Alecrim-propolis. Chem. Pharm. Bull. 2002, 50, 439. 99. Claus R., Kinscherf R., Gehrke C. i wsp.: Antiapoptotic effects of propolis extract and propol on human macrophages exposed to minimally modified low density lipoprotein. Arzneim. -Forsch. 2000, 50, 373. 100. Marcucci M.C., Camargo F.A., Lopes C.M.A.: Identification of amino acids in Brazilian propolis. Z. Naturforsch. 1996, 51C, 11. 101. Bankova V., Christov R., Marcucci C. i wsp.: Constituents of Brazilian propolis. Z. Naturforsch. 1998, 53C, 402. 102. Murad J.M., Calvi S.A., Soares A.M.V.C. i wsp.: Effects of propolis from Brazil and Bulgaria on fungicidal activity of macrophages against Paracoccidioides brasiliensis. J. Ethnopharmacol. 2002, 79, 331. 103. Sforcin J.M., Orsi R.O., Bankova V.: Effect of propolis, some isolated compounds and its source plant on antibody production. J. Ethnopharmacol. 2005, 98, 301. 104. Banskota A.H., Tezuka Y., Adnyana I.K. i wsp.: Cytotoxic, hepatoprotective and free radical scavenging effects of propolis from Brazil, Peru, the Netherlands and China. J. Ethnopharmacol. 2000, 72, 239. 105. Banskota A.H., Tezuka Y., Kadota S.: Recent progress in pharmacological research of propolis. Phytother. Res. 2001, 15, 561.















