© Borgis - Postępy Fitoterapii 1/2007, s. 32-38
*Agata Jabłońska-Trypuć, Romuald Czerpak
Aktywność biologiczna i terapeutyczna poliamin
Biological and therapheutical activity of polyamines
Zakład Nauk Biologicznych Wyższej Szkoły Kosmetologii i Ochrony Zdrowia w Białymstoku
Kierownik Zakładu: prof. dr hab. Romuald Czerpak
Summary
The diamine – putrescine and the polyamines – spermidine and spermine are aliphatic compounds which commonly occur in all living organisms. They may bind to other macromolecules, such as nucleic acid and proteins, and stimulate DNA replication, transcription and translation. They act together with plant and animal hormones activating the growth and metabolism of organisms. Biosynthesis of putrescine and spermidine is almost identical in bacteria nad plants; in fungi and mammals biosynthesis of putrescine, spermidine and spermine is also very similar, probably due to their heterotropism. In plants under influence of various stresses, the content and physiological and biochemical activity of polyamines change and enzymes immediately connected with their biosynthesis. Mechanisms of the activity of polyamines in adaptation to stress are recognized the best in plants. Polyamines play important role in cell proliferation, tumor progression and carcinogenesis. The cellular level of polyamines and their metabolic enzymes is higher in tumors than in surrounding normal tissue. High level of polyamines has been detected in a wide range of tumors, including: breast, stomach, lung and prostate cancer and leukemia. Polyamine analogues are used in anticancer therapy, but mechanisms of their action are still not enough known on a molecular level.

Wstęp
Poliaminy są związkami biogennymi powstającymi we wszystkich komórkach i organizmach pro- i eukariotycznych w wyniku dekarboksylacji niektórych aminokwasów, głównie zasadowych. Są to powszechnie występujące polikationowe związki azotowe, alifatyczne, należące do specyficznej grupy substancji regulujących wzrost, rozwój i metabolizm na poziomie molekularnym komórek, współdziałających z hormonami. Komórki prokariotyczne w porównaniu do eukariotycznych posiadają znacznie więcej putrescyny niż spermidyny i nie zawierają sperminy. Natomiast u eukariontów spotyka się głównie sperminę i spermidynę oraz niewielkie ilości putrescyny. U roślin występują przeważnie: putrescyna, spermidyna, spermina i agmatyna. Z kolei kadaweryna spotykana jest głównie u zwierząt i wytwarzana jest w dużych ilościach podczas rozkładu obumarłych organizmów.
W komórce poliaminy zlokalizowane są głównie w ścianie komórkowej, wakuolach, chloroplastach, mitochondriach oraz w jądrze komórkowym i jąderku. Umożliwiają one prawidłowy przebieg procesów fizjologiczno-metabolicznych i utrzymanie żywotności komórek. W komórce wchodzą w interakcje z makrocząsteczkami, takimi jak DNA, RNA, fosfolipidy i niektóre białka o charakterze kwaśnym, oddziaływując na replikację, transkrypcję, translację, podziały komórkowe i transport aktywny metabolitów przez błony komórkowe. Występują w formie wolnej lub w formie koniugatów; w przypadku roślin najczęściej z kwasami hydroksyfenylopropenowymi. Zaliczane są do lokalnie działających regulatorów procesów biochemiczno-metabolicznych, różniących się w swoim działaniu z typowymi hormonami.
U wielu gatunków roślin poliaminy nadają zapach kwiatom, który przyciąga owady zapylające albo nadają nieprzyjemny zapach roślinom z rodzaju obrazkowatych ( Arum), który odstrasza owady lub inne roślinne szkodniki. Poliaminy szczególnie u roślin aktywnie uczestniczą w adaptacji do różnych czynników stresowych. Poza tym działają stabilizująco na chromatynę jądrową, cytoszkielet, błony lipoproteinowe, a także biorą udział w aktywacji podziałów komórkowych. W komórkach zwierzęcych uczestniczą między innymi w procesie kancerogenezy oraz proliferacji i różnicowaniu się erytrocytów i keratynocytów (1-3).
Budowa chemiczna i biosynteza poliamin
Aminy biogenne można podzielić na: aminy alifatyczne, które różnicują się na monoaminy i poliamidy oraz cykliczne o pierścieniach aromatycznych i heterocyklicznych. Kationowe grupy aminowe łatwo tworzą wiązania chemiczne z ujemnie naładowanymi grupami fosforanowymi, karboksylowymi i siarkowodorowymi, które występują w kwasach nukleinowych i białkach, niektórych lipidach i kwaśnych cukrach. Im więcej jest grup aminowych w poliaminie tym większa jest jej aktywność biochemiczno-metaboliczna.
Największą aktywność biologiczną wykazuje spermidyna, która ma trzy grupy aminowe i spermina o czterech grupach aminowych, zaś najmniejszą agmatyna z jedną grupą aminową. Putrescyna, spermidyna i spermina są pospolitymi alifatycznymi polikationowymi aminami, odpowiednio z 2, 3 i 4 ładunkami dodatnimi przy grupach aminowych w warunkach fizjologicznego pH komórek (4, 5).
Do najbardziej znanych poliamin alifatycznych należą: diaminopropan, putrescyna, kadaweryna, spermina, spermidyna, agmatyna, homoagmatyna, urokaina, norspermina i norspermidyna, a ich wzory chemiczne przedstawia rycina 1.
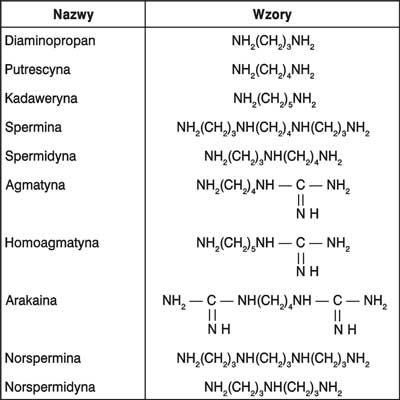
Ryc. 1. Wzory strukturalne najbardziej znanych poliamin alifatycznych.
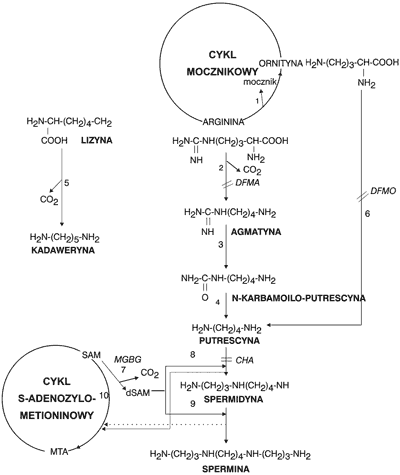
Ryc. 2. Szlaki biosyntezy poliamin u roślin i możliwości ich regulacji za pomocą inhibitorów enzymatycznych. DFMO – a-difluorometyloornityna, DFMA – a-difluorometyloarginina, MGBG – metyloglioksalo-bis-guanylohydrazon, CHA – cykloheksyloamina; objaśnienia nazw enzymów: 1 – arginaza, 2 – dekarboksylaza argininowa, 3 – iminohydrolaza agmatynowa, 4 – aminohydrolaza N-karbamoiloputrescynowa, 5 – dekarboksylaza lizynowa, 6 – dekarboksylaza ornitynowa, 7 – dekarboksylaza dekarboksylazy-adenozylo-metioninowa, 8 – syntaza spermidynowa, 9 – syntaza sperminowa, 10 – syntaza ACC (ACC-kwas 1-aminocyklopropano-1-karboksylowy); SAM – S-adenozylometionina, dSAM – dekarboksylowana SAM, MTA – metylotioadenozyna (2).
Dotychczas wykazano, że pod wpływem wielu hormonów, np. u roślin pod działaniem auksyn, giberelin i cytokinin, następuje aktywacja biosyntezy poliamin. Biosynteza putrescyny i spermidyny u bakterii i roślin jest prawie identyczna, z tą różnicą, że rośliny potrafią dodatkowo wytwarzać sperminę ze spermidyny. Istnieje również duże podobieństwo w biosyntezie putrescyny, spermidyny i sperminy u grzybów i ssaków, być może ze względu na ich heterotrofizm. U ssaków istnieje dodatkowa możliwość wielokierunkowych przemian biochemicznych poliamin, na przykład z udziałem acetylo-koenzymu A następuje przekształcenie spermidyny lub sperminy do putrescyny. Bakterie i grzyby dysponują znacznie większymi możliwościami katabolizowania poliamin w porównaniu do roślin i zwierząt. W ten sposób potrafią lepiej wykorzystać azot zawarty w poliaminach do syntezy innych związków organicznych niezbędnych do życia (6, 7).
Występowanie
Putrescyna, spermina i spermidyna oraz ich pochodne występują powszechnie w organizmach zwierzęcych, roślinnych i drobnoustrojach. Dowodem na to jest fakt, że wiele drobnoustrojów i organizmów o wyższym poziomie rozwoju wymaga obecności poliamin do normalnego wzrostu i metabolizmu. Putrescyna okazała się czynnikiem istotnym dla wzrostu m.in.: pałeczki Haemophilus influenzae, grzybów z gatunków: Aspergillus nidulans i Neurospora crassa. Pałeczka okrężnicy ( Escherichia coli) zawiera duże ilości poliamin i ma dobrze zbadane drogi ich biosyntezy. Drożdże ( Saccharomyces cerevisiae)zawierają znaczne ilości sperminy, natomiast nie wykryto jej w grzybach drożdżoidalnych ( Physarium polycephalum), pleśni wodnej ( Blastocladiella emersoni)i u rdzy źdźbłowej ( Puccinia graminis). Poziom sperminy i spermidyny u grzybów jest regulowany fizjologicznie i zależy od warunków środowiska, głównie temperatury, stężenia magnezu i manganu (8-12).
U roślin wyższych di- i poliaminy występują powszechnie i współdziałają przeważnie z fitohormonami w aktywacji procesów wzrostu i metabolizmu. Eukarionty roślinne są zasobne w sperminę i spermidynę, a niektóre w agmatynę, zaś ubogie w putrescynę. Kadaweryna najczęściej występuje u glonów i niektórych grzybów, a u roślin naczyniowych sporadycznie, np. w rodzaju obrazkowych ( Arum sp.). Duże ilości sperminy i spermidyny zawierają nowotwory roślinne. U roślin najwięcej di- i poliamin występuje w komórkach tkanek intensywnie rosnących, zwłaszcza twórczej, rozrodczej i miękiszowej. Putrescyna, spermidyna i spermina w niewielkich ilościach występują u plechowców z grupy glonów i grzybów oraz roślin naczyniowych, szczególnie należących do rodzin: trawy ( Graminae) i psiankowate ( Solanaceae) oraz roślin z grupy warzyw, drzew i krzewów owocowych. Natomiast agmatyna powszechnie występuje u roślin kwiatowych (13).
U człowieka i zwierząt kadaweryna jest produktem metabolizmu bakterii przewodu pokarmowego i rozkładu obumarłych organizmów. Kadaweryna jest związkiem o właściwościach trujących i stanowi powszechny produkt wytwarzany przez bakterie gnilne o bardzo nieprzyjemnym zapachu. Spermina i spermidyna są alifatycznymi polikationami azotowymi, które asocjują odwracalnie z wewnątrzkomórkowymi polianionami, zwłaszcza DNA, RNA, peptydami i białkami o funkcji regulującej procesy biochemiczno-fizjologiczne. Poliaminy te wpływają na proliferację, wzrost, różnicowanie się i metabolizm komórek drobnoustrojów, roślin, zwierząt i człowieka (2, 14, 15).
Aktywność biologiczna
Aktywność biologiczna poliamin charakteryzuje się dużą różnorodnością oddziaływania na wiele procesów metabolicznych. Poliaminy aktywnie uczestniczą w procesach replikacji, transkrypcji i translacji, których intensywność zależy w dużym stopniu od ich stężenia. Jako związki polikationowe oddziaływując z DNA, RNA, białkami, fosfolipidami i innymi polianionami, stymulują w komórkach biosyntezę kwasów nukleinowych i białek. Wpływają przez to na wzrost, proliferację i różnicowanie komórek oraz stymulują agregację rybosomów podczas translacji. Poprzez swoje działanie poliaminy zapewniają prawidłowe funkcjonowanie aparatu genetycznego komórki. Są składnikami błon cytoplazmatycznych, korzystnie oddziaływują na transport przez nie metabolitów, a także przeciwdziałają ich degradacji. Mogą działać również jako „zmiatacze” wolnych rodników (16-20).
Poliaminy poprzez udział w sieciowaniu białek cytozolowych stabilizują cytoszkielet komórek. Odgrywają dużą rolę w polimeryzacji filamentów aktynowych cytoszkieletu. Przy braku poliamin komórki nie są zdolne do replikacji, a wiązki filamentów aktynowych i mikrotubule w cytoszkielecie zanikają (21). Poliaminy są także niezbędne w końcowym etapie różnicowania się keratynocytów ludzkich. Putrescyna zapobiega między innymi sieciowaniu białek tworzących otoczkę w końcowym etapie tworzenia się ludzkich keratynocytów. W procesie tym, przebiegającym z utworzeniem zrogowaciałej otoczki komórkowej, uczestniczą wiązania glutamylolizynowe, a także wiązania bis-(g-glutamylo)spermidynowe, których w zdrowej skórze jest o połowę mniej niż tych pierwszych. Gdy proporcje te ulegną zmianie pojawia się stan patologiczny, charakteryzujący się zaburzeniami w różnicowaniu keratynocytów z podniesionym poziomem poliamin w tkance.
W keratynocytach u osób chorych liczba wiązań bis-(g-glutamylo)spermidynowych wzrasta kilkakrotnie przy niezmienionym poziomie wiązań glutamylolizynowych. Ten stan chorobowy nazywa się łuszczycą i dotyczy przede wszystkim tkanki skórnej (22, 23). Poliaminy spełniają istotną rolę w procesach proliferacji i różnicowania komórek krwi ludzkiej i zwierzęcej. Wywołują efekt inhibicyjny na procesy proliferacji i dojrzewania prekursorowych komórek erytrocytów, co zostało stwierdzone u pacjentów z anemią i poddawanych ciągłej hemodializie krwi (24-26).
Aktywność poliamin w adaptacji do stresów
Rola biochemiczna poliamin w adaptacji do stresów została najlepiej poznana u roślin. Rodzaje stresów u roślin, z którymi w procesie adaptacji współuczestniczą poliaminy, przedstawia rycina 3. Pod działaniem czynników stresowych, biotycznych, bądź abiotycznych, dochodzi do zmian w strukturze błon komórkowych, a także w procesach biochemiczno-fizjologicznych składających się na metabolizm komórkowy. W konsekwencji u organizmów powoduje to zmiany w ekspresji wielu genów, a wiec w syntezie białek i innych metabolitów, które są odpowiedzią o charakterze adaptacyjnym na niekorzystne działanie czynników stresowych środowiska.
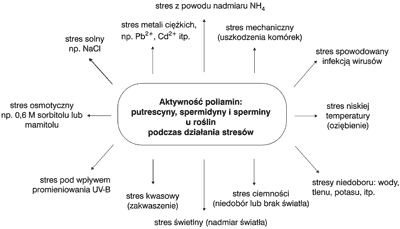
Ryc. 3. Rodzaje stresów u roślin, z którymi w procesie adaptacji aktywnie współuczestniczą poliaminy (2).
Na biosyntezę i kumulację poliamin w organizmie roślinnym istotny wpływ mają stresowe czynniki biotyczne i abiotyczne środowiska. Aktywność działania poliamin, takich jak putrescyna, spermidyna i spermina, wzrasta w komórkach roślinnych pod wpływem infekcji wirusowych i działania takich stresów, jak osmotyczny, solny, nadmiar światła bądź ciemność, kwasowy, alkaliczny, oziębieniowy, metale ciężkie, promieniowanie UV-B, uszkodzenia mechaniczne, niedobór wody, tlenu, potasu itp. Badania empiryczne wykazały, że u roślin zbożowych pod działaniem czynników stresowych następował wzrost zawartości: putrescyny, spermidyny i sperminy, a także aktywności enzymów katalizujących ich syntezę, szczególnie dekarboksylazy argininowej (ADC) bezpośrednio odpowiedzialnej za syntezę putrescyny.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Bajguz A., Czerpak R.: Metabolizm poliamin. Kosmos 1999, 48, 1, 67. 2. Czerpak R., Bajguz A.: Aktywność fizjologiczno-biochemiczna poliamin w adaptacji roślin do stresów. Post. Biol. Kom. 1999, 26, 523. 3. Niklas A., Butowi R., Jażdżewska E. i wsp.: Poliaminy w komórce roślinnej: synteza, mechanizmy działania i funkcje. Post. Biol. Kom. 1998, 25, 1, 33. 4. Slita A.V., Kasyanenko N.A., Nazarova O.V. i wsp.: DNA-polycation complexes effect of polycation structure on physico-chemical and biological properties. J. Biotechnol. 2007, 127, 4, 679. 5. D´Agostino L., di Pietro M., Di Luccia A.: Nuclear aggregates of polyamines. IUBMB Life. 2006, 58, 2, 75. 6. Kazuei Igarashi: Physiological functions of polyamines and regulation of polyamine content in cells. Yakugaku Zasshi 2006, 126, 455. 7. Chattopadhyay M.K., Tabor C.W., Tabor H.: Methylthioadenosine and polyamine biosynthesis in a Saccharomyces cerevisiae meu1delta mutant. Biochem. Biophys. Res. Commun. 2006, 343, 1, 203. 8. Tkachenko A.G., Pozhidaeva O.N., Shumkov M.S.: Role of polyamines in formation of multiple antibiotic resistance of Escherichia coli under stress conditions. Biochemistry (Mosc). 2006, 71, 9, 1042. 9. Tkachenko A.G., Shumkov M.S., Akhova A.V.: Putrescine as a modulator of the level of RNA polymerase sigma S subunit in Escherichia coli cells under acid stress. Biochemistry (Mosc). 2006, 71, 2, 185. 10. Jin Y., Bok J.W., Guzman-de-Pena D., Keller N.P.: Requirement of spermidine for developmental transitions in Aspergillus nidulans. Mol. Microbiol. 2002, 46, 3, 801. 11. Hoyt M.A., Williams-Abbott L.J., Pitkin J.W.: Davis RH. Cloning and expression of the S-adenosylmethionine decarboxylase gene of Neurospora crassa and processing of its product. Mol. Gen. Genet. 2000, 263, 4, 664. 12. Chattopadhyay M.K., Tabor C.W., Tabor H.: Methylthioadenosine and polyamine biosynthesis in a Saccharomyces cerevisiae meu1delta mutant. Biochem. Biophys. Res. Commun. 2006, 343, 1, 203. 13. Czerpak R.: Aminy, betalainy i nitrozoaminy. Czerpak R.: Biochemia ogólna, FUW w Białymstoku, Białystok 1993, 569. 14. Seiler N.: Catabolism of polyamines. Amino Acids. 2004, 26, 3, 217. 15. Thomas T., Thomas T.J.: Polyamine metabolism and cancer. J. Cell Mol. Med. 2003, 7, 2, 113. 16. Nakano S.I., Kirihata T., Fujii S. i wsp.: Influence of cationic molecules on the hairpin to duplex equilibria of self-complementary DNA and RNA oligonucleotides. Nucleic Acids Res. 2006 Dec 14; (Epub ahead of print). 17. D´Agostino L., di Pietro M., Di Luccia A.: Nuclear aggregates of polyamines are supramolecular structures that play a crucial role in genomic DNA protection and conformation. FEBS J. 2005, 272, 15, 3777. 18. Kuramochi H., Yonezawa Y.: Formation of large DNA aggregates induced by spermidine. J. Biosci. Bioeng. 2001, 92, 183. 19. Hyvonen M.T., Uimari A., Keinanen T.A. i wsp.: Polyamine-regulated unproductive splicing and translation of spermidine/spermine N1-acetyltransferase. RNA. 2006, 12, 8, 1569. 20. Bachrach U.: Naturally occurring polyamines: interaction with macromolecules. Curr. Protein. Pept. Sci. 2005, 6, 6, 559. 21. Coburn R.F., Labelle E.F., Baron C.B.: Polyamines, PI(4,5)P2, and actin polymerization. J. Cell Physiol. 2006, 209, 2, 405. 22. Pietila M., Pirinen E., Keskitalo S. i wsp.: Disturbed keratinocyte differentiation in transgenic mice and organotypic keratinocyte cultures as a result of spermidine/spermine N-acetyltransferase overexpression. J. Invest. Dermatol. 2005, 124, 3, 596. 23. Lan L., Hayes C.S., Laury-Kleintop L. i wsp.: Suprabasal induction of ornithine decarboxylase in adult mouse skin is sufficient to activate keratinocytes. J. Invest. Dermatol. 2005, 124, 3, 602. 24. Maeda T., Wakasawa T., Shima Y. i wsp.: Role of polyamines derived from arginine in differentiation and proliferation of human blood cells. Biol. Pharm. Bull. 2006, 29, 2, 234. 25. Yoshida K., Yoneda T., Kimura S. i wsp.: Polyamines as an inhibitor on erythropoiesis of hemodialysis patients by in vitro bioassay using the fetal mouse liver assay. Ther. Apher. Dial. 2006, 10, 3, 267. 26. Wagner M.C., Eckman J.R., Wick T.M.: Histamine increases sickle erythrocyte adherence to endothelium. Br. J. Haematol. 2006, 132, 4, 512. 27. Alcazar R., Marco F., Cuevas J.C. i wsp.: Involvement of polyamines in plant response to abiotic stress. Biotechnol. Lett. 2006, 28, 23, 1867. 28. Wi S.J., Kim W.T., Park K.Y.: Overexpression of carnation S-adenosylmethionine decarboxylase gene generates a broad-spectrum tolerance to abiotic stresses in transgenic tobacco plants. Plant Cell Rep. 2006, 25, 10, 1111. 29. Yamaguchi K., Takahashi Y., Berberich T. i wsp.: The polyamine spermine protects against high salt stress in Arabidopsis thaliana. FEBS Lett. 2006, 580, 30, 6783. 30. Buehlmeyer K., Doering F., Daniel H. i wsp.: Exercise associated genes in rat colon mucosa: Upregulation of ornithin decarboxylase-1. Int. J. Sports Med. 2006, Nov 16; (Epub ahead of print). 31. Grabon W.: (Arginine as a crucial amino acid in carcinogenesis and tumor growth) Postepy Hig. Med. Dosw. (Online). 2006, 60, 483. 32. Kano Y., Soda K., Nakamura T. i wsp.: Increased blood spermine levels decrease the cytotoxic activity of lymphokine-activated killer cells: a novel mechanism of cancer evasion. Cancer Immunol. Immunother. 2006 Sep 14; (Epub ahead of print). 33. Samejima K.: (Regulation of polyamine and cancer). Yakugaku Zasshi. 2006, 126, 8, 529. 34. Palavan-Unsal N., Aloglu-Senturk S.M., Arsan D.: The function of poliamine metabolism in prostate cancer. Exp. Oncol. 2006, 28, 3, 178. 35. Niziolek M., Korytowski W., Girotti A.W.: Nitric oxide-induced resistance to lethal photooxidative damage in a breast tumor cell line. Free Radic. Biol. Med. 2006, 40, 8, 1323. 36. Tian H., Huang Q., Li L. i wsp.: Gene expression of ornithine decarboxylase in lung cancers and its clinical significance. Acta Biochim. Biophys. Sin. Shanghai 2006, 38, 9, 639. 37. Mangold U.: Antizyme inhibitor: mysterious modulator of cell proliferation. Cell. Mol. Life Sci. 2006, 63, 18, 2095. 38. Basuroy U.K., Gerner E.W.: Emerging concepts in targeting the polyamine metabolic pathway in epithelial cancer chemoprevention and chemotherapy. J. Biochem. Tokyo 2006, 139, 1, 27. 39. Wojtkowiak D., Podhajska J.A., Łukasiak J.: Efekty oddziaływania promieniowania elektromagnetycznego - rola kosmetyków, część 1.c.d. Zjawiska zachodzące w komórkach skóry pod wpływem promieniowania świetlnego. Pol. J. Cosm. 1999, 1, 2, 84. 40. Holst C.M., Frydman B., Marton L.J. i wsp.: Differential polyamine analogue effects in four human breast cancer cell lines. Toxicology. 2006, 223, 1-2, 71. 41. Wang J.F., Su R.B., Wu N. i wsp.: Inhibitory effect of agmatine on proliferation of tumor cells by modulation of polyamine metabolism. Acta Pharmacol. Sin. 2005, 26, 5, 616. 42. Hu X., Washington S.,Verderame M.F., Manni A.: Interaction between polyamines and the mitogen-activated protein kinase pathway in the regulation of cell cycle variables in breast cancer cells. Cancer. Res. 2005, 65, 23, 11026. 43. Sol V., Lamarche F., Enache M. i wsp.: Polyamine conjugates of meso-tritolylporphyrin and protoporphyrin IX: potential agents for photodynamic therapy of cancers. Bioorg. Med. Chem. 2006, 14, 5, 1364. 44. Garcia G., Sol V., Lamarche F. i wsp.: Synthesis and photocytotoxic activity of new chlorin-polyamine conjugates. Bioorg. Med. Chem. Lett. 2006, 16, 12, 3188.



