© Borgis - Postępy Fitoterapii 3-4/2002, s. 64-69
Grzegorz Grynkiewicz1, Maria Gadzikowska2
Metabolity wtórne i aktywność biologiczna złocienia maruny (Tanacetum parthenium L.)
Secondary metabolites and biological activity of feverfew (Tanacetum parthenium L.)
1 Instytut Farmaceutyczny, Warszawa
2 Wydział Farmaceutyczny Akademii Medycznej, Lublin
Summary
A short review of Tanacetum parthenium as a phyto-chemical raw material and possible source of individual active constituents is presented. Traditional applications of feverfew, culminating with modern clinical trials of migraine treatment and prophylaxis, are discussed in juxtaposition to current results in biochemistry and molecular pharmacology of the principal sesquiterpenoid component – parthenolide.

Złocień maruna, bylina pochodząca z Azji Mniejszej, znana jako roślina ozdobna, obecnie mniej popularna, rośnie także dziko w całej Europie. Osiąga wysokość kilkudziesięciu centymetrów. Gałązki na rozkrzewionej, krótko omszonej łodydze mają jajowate, zielonożółtawe, pierzastosieczne liście. Na szczytach pędów białe kwiaty języczkowe brzeźne i żółte kwiaty rurkowe wewnętrzne tworzą kwiatostan podobny do kwiatów rumianka pospolitego. Owocem jest niełupka. Roślina kwitnie od czerwca do września. W całym okresie wegetacji wydziela silny, charakterystyczny aromat. Obecnie sklasyfikowana jako Tanacetum parthenium (L.) Schulz Bip., bywa także określana jako Chrysanthemum parthenium (L.) Bernh. W przeszłości stosowano dla tej samej rośliny także nazwy: Matricaria parthenium (L.), Leucanthemum parthenium (L.) Gren. Gordon, oraz Pyrethrum parthenium (L.) Sm., (4). Roślina ta jest uznawana za leczniczą od czasów starożytnych. Wśród znanych zastosowań w medycynie ludowej, najbardziej ugruntowane jest użycie naparów ze świeżych lub suszonych liści jako środka przeciwgorączkowego, z czym wiąże się także potoczną nazwę anglosaską ziela: feverfew. Tradycja etnofarmakologiczna obszaru wysp brytyjskich wskazuje także na stosownie w przypadkach chorób reumatycznych i migreny. Współcześnie, roślina ta i jej składniki aktywne budzą duże zainteresowanie ale status surowca farmaceutycznego osiąga raczej regionalnie (25). W aktualnych wydaniach niemieckich opracowań fitochemicznych (42, 47), które uznawane są za najbardziej profesjonalne, brak jest monografii Tanacetum parthenium. Źródła polskie natomiast, zawierają podstawowe informacje o roślinie, jej składnikach i zastosowaniach (14, 28).
Tradycje zastosowań medycznych
Podrodzina Anthemideae (rodziny Compositeae, obecnie Asteraceae) zawiera wiele roślin o działaniu leczniczym, głównie w obrębie rodzajów Artemisia, Achillea i Tanacetum. Ten ostatni składa się, według aktualnych ocen, ze 150-200 gatunków flory kontynentu euroazjatyckiego z których część została rozprzestrzeniona na Amerykę i Australię. Klasyfikacja botaniczna nastręcza tu jednak wielu trudności, a poszczególne rośliny przypisywane są często zamiennie do gatunków w obrębie Tanacetum, Chrysanthemum lub Pyrethrum. Nową szansę uporządkowania tego stanu rzeczy stwarza chemotaksonomia, ale zgromadzone dotychczas dane nie osiągnęły jeszcze, jak się wydaje, odpowiedniej masy krytycznej (1, 10). Przyjęta powszechnie w anglosaskim obszarze językowym dla Tanacetum parthenium nazwa feverfew pochodzi od staroangielskiego „febrifuge”, które ma źródłosłów łaciński (febrifugia) wskazujący na aktywność przeciwgorączkową. Jeden z pierwszych źródłowych opisów zastosowań medycznych tej rośliny w Europie znajdujemy w dziele „De materia medica” Dioskuridesa (ok. 50 r.n.e.). Późniejsze opracowania, aż do końca XVII w., jedynie cytują zawarte tam wiadomości (16). Całość europejskiej tradycji etnofarmakologicznej zastosowań złocienia maruny można podsumować w formie dwu grup wskazań medycznych: przeciwbólowego (stany gorączkowe, bóle reumatyczne, artretyczne, gastryczne oraz bóle głowy i zębów) i ginekologicznego (m.in. w zagrożeniu poronieniem oraz w regulacji cyklu menstruacyjnego). Bardziej sporadyczny charakter mają doniesienia o ochronie przeciw owadom i łagodzeniu skutków ich ukąszeń. Na niektórych obszarach Wysp Brytyjskich, szczególnie w Walii, złocień marunę stosowano nieprzerwanie i powszechnie, od czasów najdawniejszych do współczesności, w profilaktyce migrenowych bólów głowy, oczywiście poza oficjalną medycyną. Wiadomości o niezwykłej skuteczności takiej „terapii” zaowocowały falą artykułów w brytyjskiej prasie codziennej w 1978 roku. Reakcja czytelników przeszła wszelkie oczekiwania: jedna tylko z gazet, zanotowała ok. 25 tysięcy próśb o szczegółowe wskazania, po jednej ze swych publikacji. Rezultatem tej kampanii prasowej było pojawienie się, na słabo regulowanym brytyjskim rynku wyrobów zielarskich, dziesiątków produktów handlowych na bazie feverfew, w postaci tabletek i kapsułek oraz surowca roślinnego (suszone części naziemne rośliny lub same liście, o różnym stopniu rozdrobnienia). W dalszej kolejności surowiec roślinny i jego ekstrakty stały się przedmiotem standaryzacji oraz intensywnych badań fitochemicznych o charakterze zarówno analitycznym jak i badań strukturalnych (16, 27).
Składniki złocienia i ich aktywność biologiczna
Krytyczny przegląd najnowszej literatury fitochemicznej wyraźnie wskazuje na to, że główną cechą chemotaksonomiczną rodzaju Tanacetum jest aktywność dwu odrębnych szlaków metabolicznych biorących swój początek w produktach glikolizy: dających związki wywodzące się z kwasu mewalonowego (terpenoidy) (1) oraz z kwasów szikimowego i malonowego (fenylopropanoidy) (7).

Tanacetum parthenium L. Złocień maruny.
Złocień maruna określany jest jako roślina silnie aromatyczna o charakterystycznym, korzennym zapachu, przypominającym rumianek lub wrotycz. Wśród substancji lotnych odpowiedzialnych za tę cechę przedmiotem specyfikacji farmakognostycznej najczęściej były terpeny (19). Głównym składnikiem monoterpenowym naziemnych części rośliny jest kamfora (1), a w znacznie mniejszych ilościach występują pochodne estrowe chryzantenolu (4), werbenolu (3) i borneolu (2). Węglowodory seskwiterpenowe: germakren D (5) i b-farnezen (6) również należą do typowych składników frakcji olejków eterycznych. Wzory strukturalne tych związków przedstawia rycina 1.
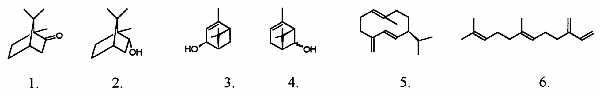
Ryc. 1. Węglowodory terpenowe występujące w Tanacetum parthenium L.: 1. kamfora; 2. borneol; 3. ciswerbenol; 4. izomeryczne chryzantenole; 5. germakren D; 6. b-farnezen.
Obecnie powszechnie uznaje się, że dla aktywności biologicznej i potencjalnych zastosowań medycznych najważniejsza jest frakcja seskwiterpenoidów (germakrany, guajany, eudesmany), które występują w znacznych ilościach w liściach rośliny. Szczególnie istotna jest zawartość nienasyconych laktonów seskwiterpenowych (6) a główny przedstawiciel tej grupy, który może stanowić nawet 85% jej składu, partenolid (7), należący do klasy germakranolidów, uznano za marker (minimalny poziom tego składnika określa się zwykle granicą 0,2%) kwalifikujący przydatność surowca roślinnego. Jest to o tyle istotne, że stwierdzono zasadnicze różnice w składzie metabolitów wtórnych tej rośliny w zależności od lokalizacji geograficznej. Uważa się nawet, że istnieją trzy „chemotypy” Tanacetum parthenium, z których dwa nie zawierają partenolidu. Wnikliwą analizę fitochemiczną surowca europejskiego przeprowadził Bohlmann (6), który zidentyfikował, oprócz dominującego partenolidu (7) (CAS nr. 20554-84-1), kilkanaście dalszych składników o budowie laktonów seskwiterpenowych, a w sumie blisko pięćdziesiąt związków terpenoidowych. Natomiast badania przeprowadzone na roślinach środkowo- i południowo-amerykańskich wskazują, że głównym składnikiem seskwiterpenowym jest santamaryna (9), a obecności partenolidu nie stwierdzono. Struktury głównych składników Tanacetum parthenium (L.) Schulz. Bip. w tej kategorii strukturalnej przedstawiono na rycinie 2.
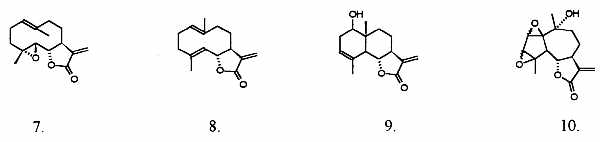
Ryc. 2. Nienasycone laktony seskwiterpenowe występujące w Tanacetum perthenium L.: 7. partenolid; 8. kostunolid; 9. sanatamaryna; 10. artekanina (a,a), kanina (b,b).
Zagadnieniu standaryzacji surowców roślinnych Tanacetum, poprzez ilościowe oznaczanie zawartości partenolidu, poświęcono wiele uwagi. W uzupełnieniu testu biologicznego (hamowanie uwalniania serotoniny z płytek krwi (31)), opracowano metody chromatograficzne (HPLC, kolumny RP-18) oparte na bezpośredniej detekcji nienasyconego laktonu w ultrafiolecie, lub w wersji o wyższej czułości, na oznaczeniu adduktu (7) z 9-tiometyloantracenem (2, 9, 12, 17, 21, 50). Opracowano też warunki dla ilościowej analizy partenolidu i jego analogów metodą chromatografii gazowej (20, 44). Dzięki tym osiągnięciom, możliwa jest wiarygodna ocena zawartości partenolidu w surowcach roślinnych i produktach farmaceutycznych, a także śledzenie zmian dystrybucji tkankowej w zależności od warunków hodowli i fazy wegetacji, oraz badania metabolizmu. Ustalono, że partenolid występuje głównie w naziemnych częściach roślin (w liściach i pędach) a jego zawartość jest najwyższa w okresie kwitnienia. W wielu przypadkach obserwowano znaczne obniżenie zawartości składnika aktywnego (7) w suchych, rozdrobnionych liściach, w trakcie przechowywania.
Partenolid, jako niskocząsteczkowy związek organiczny o umiarkowanym stopniu utlenienia i nie zawierający polarnych grup funkcyjnych, daje się łatwo wyodrębnić z materiału roślinnego przez ekstrakcję typowymi rozpuszczalnikami (chloroform, aceton, octan etylu – ew. w mieszaninach z węglowodorami) (8, 44). Jeszcze bardziej skuteczna jest ekstrakcja dwutlenkiem węgla w stanie nadkrytycznym, którą stosuje się do tego celu na skalę techniczną (5). Otrzymany w ten sposób ekstrakt (instalacja techniczna działa w Niemczech) (13) może być poddawany bezpośrednio formulacji w miękkich kapsułkach żelatynowych i stosowany do leczenia stanów migrenowych, reumatycznych i astmatycznych.
Charakterystyczną cechą strukturalną biologicznie aktywnych metabolitów wtórnych Tanacetum jest obecność ugrupowania pięcioczłonowego laktonu ze sprzężonym wiązaniem podwójnym, tworzącym egzocykliczną grupę metylenową. Laktony seskwiterpenowe, których wyodrębniono ze źródeł naturalnych ponad 3 tysiące, uchodzą za związki obdarzone różnorodną aktywnością biologiczną (22, 37, 39). Niewątpliwie te z nich, które zawierają (tak jak partenolid) układ sprzężonych wiązań podwójnych C = O i C = C stanowią najbardziej interesującą, pod względem aktywności, podgrupę. Układ taki charakteryzuje się specyficzną reaktywnością chemiczną, która wynika z łatwości przyłączenia reagentów nukleofilowych (reakcja Michaela) z utworzeniem wiązania kowalencyjnego w pozycji 4 – w stosunku do karbonylowego atomu tlenu (16).
Ostatnio, interdyscyplinarna grupa badawcza z uniwersytetu Yale (New Haven, CT, USA) dowiodła w doświadczeniach in vitro oraz in vivo, że partenolid, który hamuje kaskadę sygnalizacyjną procesu zapalnego, wiąże się bezpośrednio z kinazą IkB poprzez resztę cysteinową 179 tego enzymu, co jest bezpośrednią przyczyną zatrzymania procesu fosforylacji cytokin (30). Tym samym można przyjąć, że dowiedzione (i zależne od stężenia badanego związku) działania hamujące laktonów seskwiterpenowych na inne enzymy mają analogiczny charakter – kowalencyjnej modyfikacji strukturalnej, która skutkuje utratą aktywności katalitycznej biopolimeru. Pozostaje do wyjaśnienia bardzo interesujący problem – co stanowi o selektywności działania reaktywnych akceptorów Michaela typu laktonów sekwiterpenowych (a niektóre z nich charakteryzują się zupełnie odmiennym działaniem kierunkowym; np. bardzo bliski analog strukturalny partenolidu: (8) – kostunolid – jest nieszkodliwym repelentem owadów a posiadający to samo ugrupowanie diterpen: forbol jest, przynajmniej w formie zestryfikowanej, agresywnym kancerogenem) w środowisku biologicznym, bogatym w różnorodne donory z wolnymi grupami tiolowymi. Partenolid, którego aktywność, obserwowalna jako efekty przeciwzapalne i przeciwmigrenowe (ale także cytotoksyczne i przeciwbakteryjne) in vivo, jest dobrze ugruntowana (23, 29, 37, 39), wydaje się być odpowiednim związkiem wiodącym dla programu poszukiwania nowego leku, w którym rozstrzygnięte zostałyby problemy biodostępności, biodystrybucji i farmakokinetyki, a także zagadnienie selektywności działania wobec takich grupowych celów biomakromolekularnych jak kinazy proteinowe, czynniki wzrostu i czynniki transkrypcyjne.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Abed M.J., Bermejo P., Villar V.: Phytother. Res., 1995, 9, 79. 2. Awang D.V.C. i wsp.: J. Nat. Prod., 1991, 54, 1516. 3. Banthorpe D.V., Brown G.D.: Biotechnology in Forestry and Agriculture, 1993, v. 24, 361 (Medicinal and Aromatic Plants, Springer Verlag, Berlin). 4. Berry M.I.: Feverfew, Pharm. J., 1994, 253, 806. 5. Beuscher N., Willigmann I.: 1995, US Patent 5, 466, 451. 6. Bohlmann F., Zedro C.: Phytochemistry, 1982, 21, 2543. 7. Bohm A., Stuessy T.F.: Flavonoids of the sunflower family (Asteraceae), Springer Verlag, Wien, 2001. 8. Brown A.M.G. i wsp.: Phytochem. Anal., 1996, 7, 86. 9. Brown A.M.G. i wsp.: Plant Science, 1996, 116, 223. 10. Burford M.D., Smith R.M.: Anal. Proc., 1989, 26, 339. 11. De Weerdt C.J., Bootsma H.P.R., Hendricks H.: Phytomedicine, 1996, 3, 225. 12. Dolman D.M. i wsp.: Phytochem. Anal., 1992, 3, 26. 13. Drug discovery from Nature (red., S. Grabley, R. Thiericke), Springer Verlag Berlin, 2000, 110. 14. Encyklopedia zielarstwa i ziołolecznictwa (red., H. Strzelecka i J. Kowalski), PWN Warszawa, 2000. 15. Fukuda K. i wsp.: Biochem. Pharmacol., 2000, 60, 595. 16. Groenewegen W.A., Knight D.W., Heptinstall S.: Progr. Med. Chem., 1992, 29, 217. 17. Gromek D. i wsp.: J. Pharmacol. Pharm., 1991, 43, 213. 18. Hehner S.P. i wsp.: J. Immunol., 1999, 163, 5617. 19. Hendriks H. i wsp.: Flav. Fragr. J., 1996, 11, 367. 20. Hendriks H. i wsp.: Planta Medica, 1997, 63, 356. 21. Heptinstall S. i wsp.: J. Pharm. Pharmacol., 1992, 44, 391. 22. Heptinstall S. i wsp.: J. Pharm. Pharmacol., 1987, 39, 459. 23. Hewlett M.J. i wsp.: J. Chem. Soc. Perkin Trans. 1, 1996, 1979. 24. Johnson E.S. i wsp.: Brit. Med. J., 1985, 291, 569. 25. Johnson S.: Feverfew. A traditional herbal remedy for migraine and arthritis, Sheldon Press, London, 1984. 26. Kisiel W., Stojakowska A.: Phytochemistry, 1997, 46, 515. 27. Knight D.W.: Nat. Prod. Rep., 1995, 12, 271. 28. Kohlmünzer S.: Farmakognozja, PZWL Warszawa, 2001. 29. Kulkarni S.K., Jain N.K.: Feverfew: ancient remedy for multiple disorders, Drugs of the Future, 1999, 24, 1339. 30. Kwok B.H.B. i wsp.: Chem. & Biol., 2001, 8, 759. 31. Marles R. J., Kaminski J.: J. Nat. Prod., 1992, 55, 1044. 32. Murch S.J., Simmons C.B., Saxena P. K.: The Lancet, 1997, 350, 1598. 33. Murphy J.J., Hepinstall S., Mitchell J.R.A.: The Lancet, 1988 (8604, July 23) ii., 189. 34. Palevitch D., Earon G., Carasso R.: Phytother. Res., 1997, 11, 508. 35. Patel N. M. i wsp.: Oncogene, 2000, 19, 4159. 36. Pattrick M.S. i wsp.: Ann. Rheum. Dis., 1989, 48, 547. 37. Picman A.K.: Biochem. Systemat. Ecol. 1986, 14, 255. 38. Pugh W. J., Sambo K.: J. Pharm. Pharmacol., 1988, 40, 743. 39. Robles M. i wsp.: Planta Medica, 1995, 61, 199. 40. Rogers K.L., Grice I.D., Griffiths L.R.: Eur. J. Pharmac. Sci., 2000, 9, 355. 41. Ross J.J., Aranson J.T., Birnboim H.C.: Planta Medica, 1999, 65, 126. 42. Rośliny lecznicze w fitoterapii (red., B. Borkowski), IRiPZ, Poznań, 2000. 43. Rüngeler P. i wsp.: Med. Chem., 1999, 7, 2343. 44. Smith R.M., Burford M.D.: J. Chromatogr., 1992, 627, 255. 45. Stojakowska A., Kisiel W.: Plant Cell, Tissue and Organ Culture, 1997, 47, 159. 46. Stojakowska A., Kisiel W.: Polish J. Chem., 1997, 71, 509. 47. The Complete German Commission E Monographs (red., M. Blumenthal), Amer. Botan. Council, Austin, TX, USA, 1998. 48. Vogler B.K., Pittler M.H., Ernst E.: Cephalalgia, 1998, 18, 704. 49. Williams C.A. i wsp.: Phytochemistry, 1999, 52, 1181-182; ibid. 51, 417. 50. Zhou J. Z. i wsp.: J. Agr. Food Chem., 1999, 47, 1018.



