© Borgis - Postępy Fitoterapii 2/2004, s. 71-76
Wojciech Cisowski, Adam Kowalczyk, Joanna Jamontt
Kłącze imbiru – zastosowanie lecznicze oraz składniki czynne
Ginger root – medical application and active ingredients
Katedra i Zakład Farmakognozji Akademii Medycznej we Wrocławiu
Kierownik Katedry i Zakładu: prof. dr hab. Wojciech Cisowski
Summary
The article presents ginger (Zingiber officinale Roscoe, Zingiberaceae) – a plant employed in natural medicine from ages and now more often used in pharmaceutical and cosmetic industry. We present the appearance of the plant and the stock, chemical composition (with regard to biological active compounds) and indications. A lot of interest is induced lately by the beneficial effect of ginger extract on the progress of osteoarthritis, but there are different opinions. In the article we present the mechanism of antiphlogistic and analgesic activity of ginger extract. This mechanism consists in repression of the arachidonic acid cascade and inhibition of production of cytokines like TNF-a and IL-1b, but also on agonistic influence on vanilloid receptor VR-1. We are talking also about performed clinical trials, side effects, contraindications and possible interactions.
Key words: Ginger,
Zingiber officinale,
gingerol,
osteoarthritis,
kłącze,
imbir,
zastosowanie,
leczenie,
składnik,
czynny,
zioła,
ziołolecznictwo.

Imbir lekarski (Zingiber officinale Roscoe, Zingiberaceae = imbirowate, synonimy: Amomum zingiber L., Zingiber blancoi Massk.) jest rośliną zielną, o silnym kłączu podzielonym na bulwiaste odcinki (ryc. 1). Ma pędy płone o wysokości do 1,5 metra z równowąskolancetowatymi liśćmi o długości 5-30 cm i szerokości 8-20 cm. Kwiatostany osadzone są na łuskowatych bezlistnych pędach o wysokości około 30 cm. Przysadki są zgrubiałe, zielone, o górnym brzegu trochę jaśniejszym. Kwiaty jasnożółte, warżka purpurowa, jasno punktowana (25, 36). Gatunek nie jest znany w stanie naturalnym; wywodzi się prawdopodobnie z południowo-wschodniej Azji; jest uprawiany w wielu rejonach tropikalnych (Afryka, Chiny, Indie, Jamajka).

Ryc. 1. Ilustracja pochodzi z książki: Köhler´s Medizinal – Pflanzen in naturgetreuen Abbildungen mit kurz erläuterndem Texte. Herausgegeben von G. Pabst. GERA. Friedrich von Zezschwitz vormals Fr. Eugen Köhler´s Botanischer Verlag. Band I, S. 171.
Surowcem jest kłącze imbiru Zingiberis rhizoma, stanowiące nieokorowane (tzw. czarny imbir) lub okorowane wysuszone kłącza Zingiber officinale Roscoe o charakterystycznym aromatycznym zapachu i ostrym smaku. Kłącze imbiru znane jest pod wieloma nazwami potocznymi, stosowanymi w innych krajach, przytoczonymi w monografii WHO (16). Są to m.in. adrak, ajenjibre, ata-le jinja, gengibre, ginger root, Ingwer, kan chiang, shengiang, zingibil.
Kłącze imbiru zawiera 0,6-3% olejku eterycznego oraz substancje nielotne – żywice. Skład olejku jest zróżnicowany w zależności od pochodzenia surowca; stałe są jednak główne komponenty odpowiedzialne za aromat, do których należą węglowodory seskwiterpenowe, takie jak zingiberen, kurkumen, b-bisabolen (8, 26) (ryc. 2).
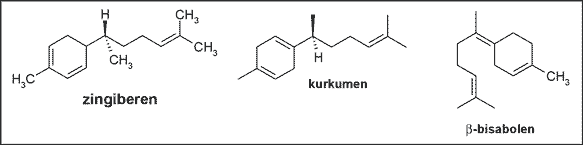
Ryc. 2. Węglowodory seskwiterpenowe występujące w kłączu imbiru.
Obecne są także aldehydy, alkohole i węglowodory monoterpenowe: cytral (formy cis i trans), a- i b-felandren, limonen, linalol, kamfen, a- i b-pinen (ryc. 3).
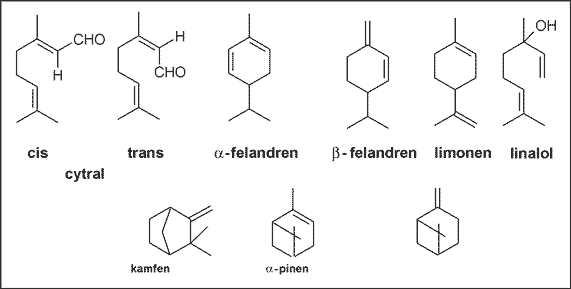
Ryc. 3. Aldehydy, alkohole i węglowodory monoterpenowe występujące w kłączu imbiru.
Za główny nośnik zapachu uważany jest zingiberol będący mieszaniną izomerów cis i trans b-eudesmolu. Głównymi składnikami aktywnymi biologicznie wśród ostrych substancji nielotnych są gingerole – połączenia typu złożonych pochodnych fenylopropanu – zidentyfikowane jako 1-(3´-metoksy-4´-hydroksyfenyl)-5-hydroksyalkan-3-ony (16). Podczas przeróbki i przechowywania kłącza powstają produkty dehydratacji gingeroli – shogaole (ryc. 4).
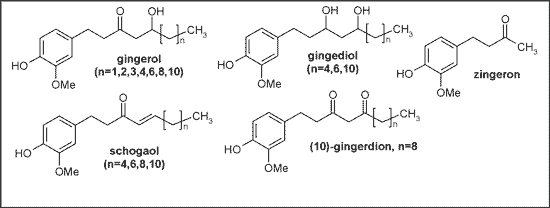
Ryc. 4. Gingerole, gingediole, zingeron, schogaol i gingerdiony występujące w kłączu imbiru.
Gingerole w zależności od długości łańcucha bocznego, zawierające 7-10, 12, 14 lub 16 atomów węgla określane są jako (3-6), (8), (10) lub (12) – gingerole (16). Inne substancje ostre to: gingediole, gingerdiony oraz zingeron (ryc. 4). Skład chemiczny kłącza imbiru może być łatwo rozpoznany za pomocą ghromatografii HPLC, która pozwala także na wyizolowanie poszczególnych substancji (8). W piśmiennictwie została opisana także stabilność wyciągów imbiru przy różnych wartościach pH (10).
Imbir jest rośliną znaną i cenioną od tysięcy lat, stosowaną jako lek, przyprawa oraz afrodyzjak, opisywaną w medycynie chińskiej, tybetańskiej oraz w Ayurwedzie. W tradycyjnej japońskiej medycynie Kampo wyróżnia się Zingiberis rhizoma = Shokyo o działaniu przeciwymiotnym i przeciwgorączkowym oraz Zingiberis siccatum rhizoma = Kankyo, który hamuje kaszel, upłynnia wydzielinę i ma działanie rozgrzewające (41). Suszone kłącze znajduje uwarunkowane tradycją zastosowanie w różnych dolegliwościach dyspeptycznych, przy złym trawieniu, braku apetytu, wzdęciach, przewlekłym zapaleniu jelit, a także w schorzeniach dróg moczowych (25, 26). Imbirowi przypisuje się wiele właściwości; niektóre z nich zostały potwierdzone badaniami laboratoryjnymi oraz klinicznymi:
l Działanie przeciwzapalne.
l Działanie żółciopędne oraz pobudzające motorykę przewodu pokarmowego przypisywane jest aktywnym składnikom olejku eterycznego zidentyfikowanym jako (6)-shogaol oraz (6)-, (8)-, (10)-gingerol (38, 39).
l Działanie profilaktyczne w chorobie lokomocyjnej (w Polsce preparat Avioplant, Lokomotiv); badania nad zastosowaniem w nudnościach pooperacyjnych, a także w porannych nudnościach u ciężarnych (16).
l Działanie przeciwbólowe (5, 23), przeciwmigrenowe (19), przeciwwirusowe, przeciwbakteryjne, przeciwgrzybicze.
l Zapobieganie agregacji płytek krwi przez hamowanie aktywności syntazy tromboksanu oraz zmniejszenie uwalniania serotoniny przez płytki (2, 15, 29, 30).
l Obniżanie poziomu cholesterolu w surowicy, zmniejszanie oksydacji frakcji LDL i wynikające z tego działanie przeciwmiażdżycowe (7).
l Działanie napotne, wykrztuśne.
l Działanie przeciwwrzodowe (40).
l Działanie przeciwrakowe – indukcja apoptozy przez (6)-paradol (11), działanie chemoprewencyjne (6)-gingerolu wynikające z działania antyoksydacyjnego oraz przeciwzapalnego (22, 34), blokowanie transformacji komórek indukowanej przez EGF (Epidermal Growth Factor) (4).
l Działanie immunosupresyjne związane z hamowaniem syntazy IL-2 wykazane w badaniach in vitro, potencjalne zastosowanie w transplantologii (37).
l Wykorzystywane w kosmetykach działanie przeciwzmarszczkowe.
Na rynku światowym pojawiło się wiele preparatów zawierających wyciągi z kłącza imbiru. Coraz większą popularność zdobywa preparat Zinaxin stosowany wspomagająco w leczeniu chorób reumatycznych, a w szczególności w regeneracji chrząstki kostno-stawowej. Kapsułka dostępnego w Polsce preparatu zawiera 255 mg Ev. Ext 35 – standaryzowanego wyciągu z kłącza imbiru1. Wcześniej dostępna była również maść zawierająca wyciągi z dwóch gatunków Zingiberaceae: Zingiber officinale oraz Alpinia galanga.
Wiele ośrodków naukowych na całym świecie prowadzi badania nad skutecznością preparatów imbiru w leczeniu choroby zwyrodnieniowej stawów i kręgosłupa oraz reumatoidalnego zapalenia stawów. Choroby te leczy się głównie objawowo, a stosowane leki charakteryzują się znaczną liczbą działań niepożądanych, dlatego konieczne jest poszukiwanie nowych rozwiązań.
Już na początku badań nad wyciągiem z imbiru stwierdzono, że hamuje on proces zapalny oraz kaskadę kwasu arachidonowego, zmniejszając ilość produktów jego utlenienia. Kwas arachidonowy jest utleniany przez cyklooksygenazę COX oraz lipooksygenazę LOX. W kaskadzie powstają prostaglandyny oraz leukotrieny, z których PGE2 oraz LTB4 są najważniejszymi mediatorami stanu zapalnego (12, 31, 33). Początkowo donoszono o inhibicji syntetazy prostaglandyn oraz 5-LOX (13). Następnie pojawiły się dowody na hamowanie COX-2 przez składniki imbiru (8)-paradol oraz (8)-shogaol (University of Sydney, Australia) (35). Badania przeprowadzone na uniwersytecie w Regensburg (Niemcy) wykazały przeciwzapalne działanie acetonowego wyciągu z kłącza imbiru, przy czym nie została ustalona zależność między tym działaniem, a poszczególnymi składnikami. Wyciągnięto wniosek, że działanie przeciwzapalne uzależnione jest od kompleksowego składu wyciągu, a poszczególne substancje mogą wykazywać efekt synergistyczny (27). Za główny mechanizm działania wyciągu z kłącza imbiru uznaje się hamowanie COX-2 bez wpływu na COX-1 oraz inhibicję wytwarzania prozapalnych cytokin TNF-a oraz IL-1ß.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Altman R.D., Marcussen K.C.: Effects of a ginger extract on knee pain in patients with osteoarthritis. Arthritis Rheum. 2001, 44, 2531-2538. 2. Bacon J.: Ginger: inhibition of thromboxane synthetase and stimulation of prostacyclin: relevance for medicine and psychiatry. Med. Hypotheses 1986, 20, 271-278. 3. Bliddal H., et al.: A randomised, placebo-controlled, cross-over study of ginger extract and ibuprofen in osteoarthritis. Osteoarthritis-Cartilage 2000, 8, 9-12. 4. Bode A.M., et al.: Inhibition of epidermal growth factor-induced cell transformation and activator protein 1 activation by (6)-gingerol. Cancer Res. 2001, 61, 850-853. 5. Dedov V.N., et al.: Gingerols: a novel class of vanilloid receptor (VR1) agonists. Br. J. Pharmacol. 2002, 137, 793-798. 6. Frondoza C.G., et al.: Inhibitory effect of NSAIDS and ginger extract on the expression of TNF-a, NF-kB and IkB-a in human synoviocytes and chondrocytes. OARSI World Congress on Osteoarthritis, Sydney 2002. 7. Fuhrman B., et al.: Ginger extract consumption reduces plasma cholesterol, inhibits LDL oxidation and attenuates development of atherosclerosis in atherosclerotic, apolipoprotein E-deficient mice. J. Nutr. 2000, 130, 1124-1131. 8. He X., et al.: High-performance liquid chromatography - electrospray mass spectrometric analysis of pungent constituents of ginger. J. Chromatogr. A 1998, 796, 327-334. 9. Hodges P.J., Kam P.C.: The peri-operative implications of herbal medicines. Anaesthesia 2002, 57, 889-899. 10. Young H.-Y., et al.: Analytical and stability studies of ginger preparations. J. Food Drug Anal. 2002, 10, 149-153. 11. Keum Y.S., et al.: Induction of apoptosis and caspase-3 activation by chemopreventive (6)-paradol and structurally related compounds in KB cells. Cancer Lett. 2002, 177, 41-47. 12. Kiuchi F., et al.: Inhibitors of prostaglandin biosynthesis from ginger. Chem. Pharm. Bull. 1982, 30, 754-757. 13. Kiuchi F., et al.: Inhibition of prostaglandin and leukotriene biosynthesis by gingerols and diaryloheptanoids. Chem. Pharm. Bull. 1992, 40, 387-391. 14. Kohlmünzer S.: Farmakognozja. Podręcznik dla studentów farmacji. Wyd. Lek. PZWL, Warszawa 2000. 15. Koo K.L., et al.: Gingerols and related analogues inhibit arachidonic acid - induced human platelet serotonin - release and aggregation. Thromb. Res. 2001, 103, 387-397. 16. Mahady G.B., et al.: WHO monographs on selected medicinal plants. Vol. I. Rhizoma Zingiberis. WHO Geneva, 1999. 17. Marcus D.M., Suarez-Almazor M.E.: Is there a role for ginger in the treatment of osteoathritis? Arthritis Rheum. 2001, 44, 2461-2462. 18. Miller L.G.: Herbal medicinals: selected clinical considerations focusing on known or potential drug-herb interactions. Arch. Intern. Med. 1998, 158, 2200-2211. 19. Mustafa T., Srivastava K.C.: Ginger (Zingiber officinale) in migraine headache. J. Ethnopharmacol. 1990, 29, 267-273. 20. Nakamura H., Yamamoto T.: Mutagen and anti-mutagen in ginger, Zingiber officinale. Mutat. Res. 1982, 103, 119-126. 21. Nakamura H., Yamamoto T.: The active part of the (6)-gingerol molecule in mutagenesis. Mutat. Res. 1983, 122, 87-94. 22. Nihal A., et al.: Antioxidants in chemoprevention of skin cancer. Curr. Probl. Dermatol. 2001, 29, 128-139. 23. Onogi T., et al.: Capsaicin-like effect of (6)-shogaol on substance P - containing primary afferents of rats: a possibile mechanism of its analgesic action. Neuropharmacol. 1992, 31, 1165-1169. 24. Quaiser-Rehman M.D., et al.: When to try COX-2 specific inhibitors. Med. po Dypl. 2000, 9, Nr 5. 25. Schaffner W.: Rośliny lecznicze: chemizm, działanie, zastosowanie. Oficyna Wyd. Multico, Warszawa 1996, 294-295. 26. Schneider G.: Pharmazeutische Biologie. Wissenschaftsverlag. Bibliographisches Institut Mannheim-Wien-Zürich 1985, 324, 363-364. 27. Schuhbaum H., et al.: Anti-inflammatory activity of Zingiber officinale extracts. Pharm. Pharmacol. Lett. 10, 82-85. 28. Sharma J.N., et al.: Suppressive effects of eugenol and ginger oil on arthritic rats. Pharmacology 1994, 49, 314-318. 29. Srivastava K.C.: Aqueous extracts of onion, garlic and ginger inhibit platelet aggregation and alter arachidonic acid metabolism. Biomed. Biochim. Acta 1984, 43, S335-S346. 30. Srivastava K.C.: Isolation and effects of some ginger components on platelet aggregation and eicosanoid biosynthesis. Prostagl. Leukotr. Med. 1986, 25, 187-198. 31. Srivastava K.C., Mustafa T.: Ginger (Zingiber officinale) and rheumatic disorders. Med. Hypotheses 1989, 29, 25-28. 32. Srivastava K.C., Mustafa T.: Ginger (Zingiber officinale) in rheumatism and musculoskeletal disorders. Med. Hypotheses 1992, 39, 342-348. 33. Suekawa M., et al.: Pharmacological studies on ginger. I. Pharmacological actions of pungent constituents, (6)-gingerol and (6)-shogaol. J. Pharmacobiodyn. 1984, 7, 836-848. 34. Surh Y.J.: Anti-tumor promoting potential of selected spice ingredients with antioxidative and anti-inflammatory activities: a short review. Food. Chem. Toxicol. 2002, 40, 1091-1097. 35. Tjendraputra E., et al.: Effect of ginger constituents and synthetic analogues on cyclooxygenase-2 enzyme in intact cells. Bioorg. Chem. 2001, 29, 156-163. 36. Weidner M.S., Sigwart K.: Investigation of the teratogenic potential of a Zingiber officinale extract in the rat. Reprod. Toxicol. 2001, 15, 75-80. 37. Wilasrusmee C., et al.: In vitro imunomodulatory effects of herbal products. Am. Surg. 2002, 68, 860-864. 38. Yamahara J., et al.: Cholagogic effect of ginger and its active constituents. J. Ethnopharacol. 1985, 13, 217-225. 39. Yamahara J. et al.: Gastrointestinal motility enhancing effect of ginger and its active constituents. Chem. Pharm. Bull. 1991, 38, 430-431. 40. Yoshikawa M., et al.: 6-Gingesulfonic acid, a new anti-ulcer principle, and gingerglycolipids A, B and C, three new monoacyldigalactosylglycerols, from Zingiberis rhizoma originating in Taiwan. Chem. Pharm. Bull. 1992, 40, 2239- 2241. 41. Yumiko H., et al.: Pharmacognostic studies on ginger and related drugs. Part 1. Five sulfonated compounds from Zingiberis rhizome (Shokyo). Phytochem. 2003, 62, 613-617.




