¬© Borgis - Postńôpy Fitoterapii 3/2004, s. 126-137
Justyna Makowska-WńÖs, Zbigniew Janeczko
BiodostńôpnoŇõńá polifenoli roŇõlinnych
Bioavailability of plant polyphenols
Katedra Farmakognozji Collegium Medicum Uniwersytetu JagielloŇĄskiego w Krakowie
Kierownik: prof. UJ dr hab. Zbigniew Janeczko
Summary
Flavonoids comprise the most common group of plant polyphenols. More than 4000 different flavonoids have been described so far. The six major classes of flavonoids include flavones (e.g. apigenin, luteolin, diosmetin), flavonols (e.g. kaempferol, quercetin, myricetin), flavanones (e.g. naringenin, hesperedin), flavanols (e.g. catechin, gallocatechin), anthocyanidins (e.g. pelargonidin, cyanidin) and isoflavones (e.g. daidzein, genistein). Flavonoids occur in food primarily as glycosides and polymers. The daily consumption of total flavonoids, mainly in vegetables, fruits and beverages is described as 1-2g. Flavonoids are poorly absorbed from the gut and are subjected to degradation by intestinal microorganism to various phenolic acids. Phenolic acids are a subclass of polyphenols. Their metabolism is very similar to flavonoids.

Flawonoidy naleŇľńÖ do zwińÖzk√≥w polifenolowych, szeroko rozpowszechnionych w Ňõwiecie roŇõlinnym. WystńôpujńÖ w nadziemnych czńôŇõciach roŇõlin, niejednokrotnie nadajńÖc barwńô kwiatom czy owocom w zakresie od Ňľ√≥Ňātej (flawonoidy) do czerwonej i fioletowej (antocyjany). Dotychczas opisano budowńô ponad 4 000 zwińÖzk√≥w z tej grupy.
Struktura flawonoid√≥w oparta jest na ukŇāadzie flawanu, skŇāadajńÖcego sińô z trzech pierŇõcieni A, B i C (ryc. 1). Modyfikacje w obrńôbie heterocyklicznego pierŇõcienia C prowadzńÖ do powstania r√≥Ňľnych zwińÖzk√≥w flawonoidowych, takich jak flawony (np. apigenina, luteolina, diosmetyna) (ryc. 2), flawonole (np. kemferol, kwercetyna, myrycetyna) (ryc. 3), flawanony (np. naryngenina, hesperydyna) (ryc. 4), flawanole (np. katechina, galokatechina) (ryc. 5), antocyjanidyny (np. pelargonidyna, cyjanidyna) (ryc. 6), czy izoflawony (np. daidzeina, genisteina) (ryc. 7) (70). Dodatkowa r√≥ŇľnorodnoŇõńá tych zwińÖzk√≥w wynika z moŇľliwej obecnoŇõci ugrupowaŇĄ hydroksylowych, metoksylowych, izoprenylowych, cukr√≥w prostych powińÖzanych wińÖzaniem O- lub C-glikozydowym, czy tworzeniem struktur dimerycznych (2, 66). Zalicza sińô tu takŇľe poŇāńÖczenia, takie jak: flawonolignany (pochodne flawanonolu – sylibina), czy estry katechiny (galusan epigalokatechiny) (32).
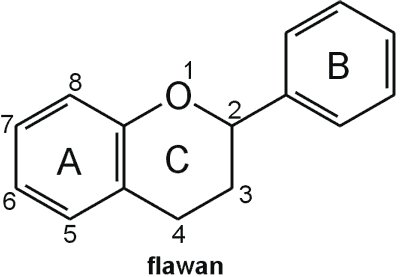
Ryc. 1. Wzór chemiczny flawanu.
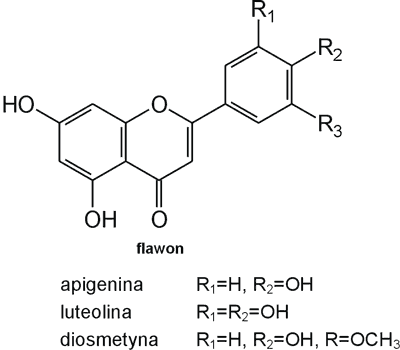
Ryc. 2. Pochodne flawonu.
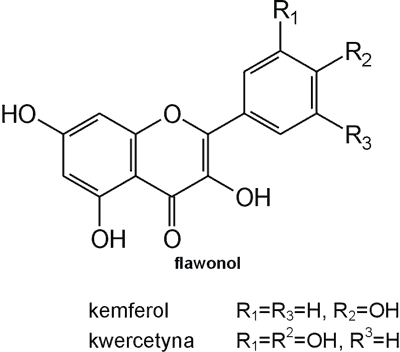
Ryc. 3. Pochodne flawonolu.
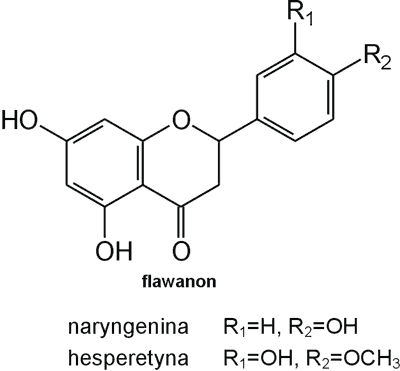
Ryc. 4. Pochodne flawanonu.
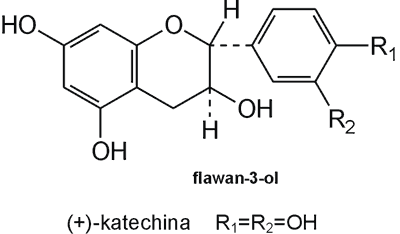
Ryc. 5. Pochodna flawanolu – (+)-katechina.
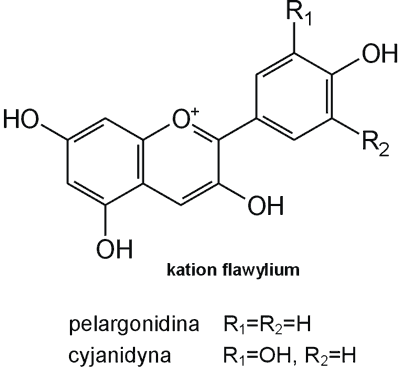
Ryc. 6. Pochodne antocyjanidyn.
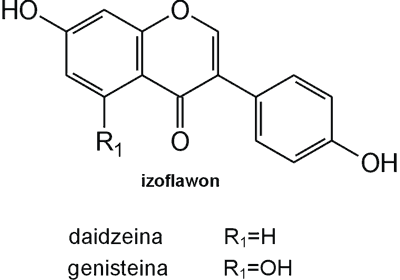
Ryc. 7. Pochodne izoflawonu.
WińôkszoŇõńá flawonoid√≥w w roŇõlinach wystńôpuje, obok wolnych aglikon√≥w, w postaci poŇāńÖczeŇĄ glikozydowych (gŇā√≥wnie O-glikozydy). W czńôŇõci cukrowej zazwyczaj wystńôpuje glukoza, takŇľe galaktoza, ramnoza, ksyloza, arabinoza. Cukry najczńôŇõciej przyŇāńÖczone sńÖ do grupy hydroksylowej w pozycji C-7 we flawonach i izoflawonach; pozycji C-3 i C-7 w strukturach flawonoli oraz C-3 i C-5 w przypadku antocyjanidyn (66).
ZwińÖzki flawonoidowe sńÖ skŇāadnikiem codziennej diety; Ňļr√≥dŇāa najczńôŇõciej spotykanych przedstawicieli poszczeg√≥lnych klas przedstawiono w tabeli 1. Dzienne spoŇľycie pochodnych flawonoidowych, gŇā√≥wnie pod postacińÖ warzyw, owoc√≥w i napoj√≥w, okreŇõla sińô na poziomie 1-2 g (30).
JuŇľ w latach 30. ubiegŇāego wieku laureat Nagrody Nobla Albert Szent-Györgyi odkryŇā wyraŇļnńÖ aktywnoŇõńá antyoksydacyjnńÖ flawonoid√≥w (32). P√≥Ňļniejsze badania okreŇõliŇāy mechanizmy warunkujńÖce kierunki dziaŇāania zwińÖzk√≥w flawonoidowych: „wymiatanie” wolnych rodnik√≥w, hamowanie peroksydacji lipid√≥w, czy obniŇľenie aktywnoŇõci enzym√≥w. StńÖd wynika ich zastosowanie jako Ňõrodk√≥w ograniczajńÖcych czńôstoŇõńá wystńôpowania chor√≥b serca, wńÖtroby i pewnych typ√≥w nowotwor√≥w (32). Szeroko zakrojone badania epidemiologiczne dowiodŇāy, Ňľe regularne spoŇľywanie zwińÖzk√≥w flawonoidowych moŇľe zmniejszańá ryzyko ŇõmiertelnoŇõci z powodu chor√≥b serca i ukŇāadu krńÖŇľenia (31, 40), a takŇľe wystńôpowania niekt√≥rych typ√≥w nowotwor√≥w (41). Polifenole, jako czynniki redukujńÖce, wsp√≥lnie z innymi zwińÖzkami o podobnej aktywnoŇõci, jak witamina C, E i karoten, wykazujńÖ wpŇāyw ochronny na tkanki wobec czynnik√≥w stresu oksydacyjnego.
ZwińÖzki o strukturze flawonoidowej obecne sńÖ w diecie, a takŇľe wchodzńÖ w skŇāad preparat√≥w leczniczych stosowanych w chorobach serca i naczyŇĄ, zaburzeniach krńÖŇľenia, gŇā√≥wnie obwodowego (rutozyd, diosmina, hesperydyna), schorzeniach wńÖtroby (sylimaryna), czy profilaktyki i Ňāagodzenia objaw√≥w menopauzalnych (izoflawony sojowe). NaleŇľy wińôc, w kontekŇõcie ich dziaŇāania, rozwaŇľyńá stopieŇĄ wchŇāaniania z przewodu pokarmowego czŇāowieka oraz dalsze losy w ustroju.
W cińÖgu ostatnich lat pojawiŇāo sińô wiele doniesieŇĄ o wynikach badaŇĄ nad absorpcjńÖ, metabolizmem i wydalaniem flawonoid√≥w, prowadzonych w warunkach in vitro i in vivo. Wiele spornych kwestii zostaŇāo wyjaŇõnionych, jednakŇľe, w zwińÖzku z r√≥ŇľnorodnoŇõcińÖ czynnik√≥w wpŇāywajńÖcych na dostńôpnoŇõńá oraz kierunki metabolizmu jelitowego i wńÖtrobowego, wyniki badaŇĄ z r√≥Ňľnych oŇõrodk√≥w nie zawsze pokrywajńÖ sińô. Pytanie podstawowe pozostaje nadal aktualne: czy absorbowane sńÖ aglikony, glikozydy, czy obie formy jednoczeŇõnie?
Aglikony flawonoidowe majńÖ charakter hydrofobowy i mogńÖ byńá transportowane przez bŇāony biologiczne na drodze dyfuzji biernej (2). PoŇāńÖczenie z cukrem w postańá glikozydowńÖ zmienia charakter zwińÖzku na bardziej hydrofilny, co zmniejsza moŇľliwoŇõńá dyfuzji. b-Glukozydazy, obecne w aktywnym enzymatycznie nabŇāonku jelita cienkiego, umoŇľliwiajńÖ wchŇāanianie wolnych aglikon√≥w, poprzez rozszczepienie wińÖzania b-glikozydowego. Metabolizm flawonoid√≥w zachodzi w wńÖtrobie, przy udziale enzym√≥w I fazy (hydroksylacja, demetylacja – cytochrom P 450) oraz II fazy (O-metylacja, sprzńôganie z kwasem glukuronowym lub siarkowym), czńôŇõciowo juŇľ w jelicie (32). Produkty metabolizmu zwińÖzk√≥w flawonoidowych wydalane sńÖ z moczem oraz z Ňľ√≥ŇācińÖ, ulegajńÖc krńÖŇľeniu jelitowo-wńÖtrobowemu, co przedŇāuŇľa czas eliminacji a takŇľe moŇľliwego dziaŇāania. NiewchŇāonińôte oraz wydzielone z Ňľ√≥ŇācińÖ metabolity flawonoid√≥w sńÖ przetwarzane przez mikroflorńô jelitowńÖ, gŇā√≥wnie w jelicie grubym. Enzymy bakteryjne mogńÖ katalizowańá reakcje, takie jak hydroliza glukuronid√≥w, siarczan√≥w i glikozyd√≥w, dehydroksylacja, demetylacja, redukcja wińÖzania podw√≥jnego, rozkŇāad pierŇõcienia C z utworzeniem fenolokwas√≥w, a nastńôpnie ich dekarboksylacjńô (76). Kwasy fenolowe mogńÖ byńá absorbowane, ulegańá koniugacji czy O-metylacji w wńÖtrobie, a nastńôpnie wydaleniu z moczem (35). Absorpcja moŇľe mieńá znaczenie dla caŇākowitej aktywnoŇõci antyoksydacyjnej osocza, gdyŇľ kwasy posiadajńÖce strukturńô katecholowńÖ wykazujńÖ dziaŇāanie wymiatajńÖce wolne rodniki (52).
Flawonole degradowane sńÖ do pochodnych kwasu fenylooctowego i fenylopropionowego. Rozerwanie pierŇõcienia C katechin prowadzi do powstania fenylowalerolakton√≥w i kwasu hydroksyfenylopropionowego. Flawony i flawanony przeksztaŇācane sńÖ do kwasu fenylopropionowego, a nastńôpnie pochodnych kwasu benzoesowego (76).
FLAWONOLE
Do najczńôŇõciej spotykanych w przyrodzie zwińÖzk√≥w flawonoidowych naleŇľńÖ flawonole, a zwŇāaszcza kwercetyna i jej glikozydy. ZnaleŇļńá je moŇľna w cebuli, herbacie, czerwonym winie czy owocach, takich jak jabŇāka (tab. 1).
Tabela 1. ŇĻr√≥dŇāa polifenoli w poŇľywieniu (wg 2, 47, 66, 79).
Flawonole
kwercetyna
kemferol |
cebula, saŇāata, brokuŇāy, ciemne winogrona, jabŇāka, herbata,
brokuŇāy, grejpfrut, czarna herbata |
Flawony
luteolina
apigenina |
seler, cytryny, czerwona papryka
seler, pietruszka |
Flawanony
hesperetyna
naryngenina |
pomaraŇĄcze
grejpfruty |
Flawanole
(+)-katechina
(-)-epikatechina
proantocyjanidyny |
jabŇāka, winogrona, czerwone wino, herbata, czekolada
|
Izoflawony
genisteina
daidzeina |
soja, produkty sojowe, warzywa strńÖczkowe
|
Antocyjany
cyjanidyna
delfinidyna |
owoce: czarnej porzeczki, truskawki, winoroŇõli, wiŇõni, bzu czarnego,
owoce: aronii, borówki czernicy |
Fenolokwasy
kwas kawowy
kwas chlorogenowy
kwas ferulowy |
biaŇāe winogrona, oliwki, kapusta
jabŇāka, wiŇõnie, pomidory, brzoskwinie, gruszki,
zboŇľa, pomidory, szparagi |
DziaŇāanie biologiczne kwercetyny wynika z jej wysokiej aktywnoŇõci antyoksydacyjnej oraz moŇľliwoŇõci hamowania enzym√≥w, m.in. biorńÖcych udziaŇā w powstawaniu procesu zapalnego (65). Kwercetyna i jej pochodne, jak rutozyd (3-ramnoglukozyd kwercetyny), stosowane sńÖ w terapii wspomagajńÖcej niewydolnoŇõńá ŇľylnńÖ koŇĄczyn dolnych oraz jako naturalne przeciwutleniacze.
Glikozydy flawonoidowe, podobnie jak hydroksykwasy, nie ulegajńÖ kwaŇõnej hydrolizie w ŇľoŇāńÖdku (76). Zaproponowany mechanizm wchŇāaniania opiera sińô na aktywnoŇõci endogennych b-glukozydaz obecnych w jelicie cienkim. Badania Day i wsp. (16) oraz Nemeth i wsp. (55) wykazaŇāy, Ňľe aktywne sńÖ szczeg√≥lnie dwa enzymy: hydrolaza florydzynowa (EC 3.2.1.62) i b-glukozydaza cytozolowa (EC 3.2.1.21). Hydrolaza obecna jest w Ňõcianie jelita cienkiego, na zewnńôtrznej powierzchni kom√≥rek nabŇāonka, gdzie odpowiada za hydrolizńô laktozy. b-Glukozydaza cytozolowa wystńôpuje w narzńÖdach, takich jak wńÖtroba, nerki i jelito cienkie u ssak√≥w (15). UwaŇľa sińô, Ňľe wsp√≥Ňāuczestniczy ona w detoksykacji ksenobiotyk√≥w poprzez hydrolizńô wińÖzania b-glukozydowego, co umoŇľliwia nastńôpnie sprzńôganie z kwasem glukuronowym i szybkie wydalanie z moczem lub Ňľ√≥ŇācińÖ. PowstaŇāe po hydrolizie aglikony wchŇāaniane sńÖ przez Ňõcianńô jelita cienkiego na drodze dyfuzji biernej (76).
Przypuszcza sińô, Ňľe poŇāńÖczenia z glukozńÖ mogńÖ przechodzińá przez bŇāonńô enterocyt√≥w podczas transportu aktywnego. Badania nad farmakokinetykńÖ kwercetyny wykazaŇāy, Ňľe po podaniu doustnym jej glukozydy wchŇāaniane sńÖ w jelicie cienkim. Hollman i wsp. (36) okreŇõlili absorpcjńô r√≥Ňľnych form kwercetyny u zdrowych ochotnik√≥w z przetokńÖ kńÖtniczńÖ, co zapobiegaŇāo degradacji poŇāńÖczeŇĄ flawonoidowych przez mikroflorńô jelitowńÖ. Wykazano, Ňľe absorpcja kwercetyny wynosiŇāa 52±5% dla glukozyd√≥w obecnych w cebuli. Wolny aglikon i 3-O-rutynozyd kwercetyny wchŇāaniaŇāy sińô odpowiednio w iloŇõci 24±9% i 17±15%.
WchŇāanianie kwercetyny z cebuli jest do trzech razy wińôksze niŇľ z jabŇāek (48). Cebula zawiera gŇā√≥wnie glukozydowe poŇāńÖczenia kwercetyny, natomiast w jabŇākach kwercetyna wystńôpuje jako mieszanina glikozyd√≥w, takich jak galaktozydy, ramnozydy, arabinozydy, ksylozydy, glukozydy i rutynozydy (37, 48). Lepsza dostńôpnoŇõńá glukozyd√≥w kwercetyny, w por√≥wnaniu z aglikonem, wynika z udziaŇāu Na+-zaleŇľnego przenoŇõnika glukozy (SGLT-1) w procesie absorpcji przez Ňõcianńô jelita (1, 2, 34). Transport aktywny 4´-O-glukozydu kwercetyny przy udziale SGLT-1 zademonstrowano na hodowli kom√≥rek nowotworu jelita grubego (Caco-2) (81).
W oparciu o wyniki dalszych badaŇĄ stwierdzono, Ňľe dostńôpnoŇõńá 3-O-glukozydu i 4´-O-glukozydu kwercetyny jest bardzo zbliŇľona (56). U ludzi wchŇāanianie glukozyd√≥w zachodzi szybciej, a miejsce przyŇāńÖczenia glukozy do aglikonu nie ma wińôkszego znaczenia dla absorpcji tych poŇāńÖczeŇĄ. (34, 56). Rutozyd ulega przeksztaŇāceniu do 3-O-glukozydu kwercetyny przez enzymatyczne odszczepienie czńÖsteczki ramnozy (b-L-ramnozydaza), co znacznie zwińôksza jego dostńôpnoŇõńá. Jednak proces ten zachodzi dopiero w okrńôŇľnicy pod wpŇāywem mikroflory (56). Po podaniu ochotnikom cebuli, jabŇāek i rutozydu, kwercetyna pojawiŇāa sińô w osoczu krwi odpowiednio po 0,7, 2,5 i 9 godzinach od momentu spoŇľycia (37). Wyniki te potwierdzajńÖ udziaŇā bakterii jelitowych w procesie absorpcji rutozydu.
W wńÖtrobie grupy hydroksylowe w pierŇõcieniu B kwercetyny i jej glukozyd√≥w ulegajńÖ metylacji, co prowadzi do powstania m.in. izoramnetyny (3´-O-metylokwercetyny). W surowicy krwi, podobnie jak w moczu, nie stwierdzono wolnego aglikonu (kwercetyny) (76, 78). GŇā√≥wnymi metabolitami wystńôpujńÖcymi w moczu i Ňľ√≥Ňāci sńÖ glukuronidy kwercetyny, 3´-O-metylokwercetyny i 4´-O-metylokwercetyny (76). Po spoŇľyciu cebuli, gŇā√≥wnymi metabolitami oznaczanymi we krwi byŇāy 3´-siarczan i 3-glukuronid kwercetyny (17). WedŇāug Olthof´a i wsp. (56) tylko 3% przyjńôtej kwercetyny wydalane jest z moczem. Wskazuje to na znaczne nasilenie proces√≥w metabolicznych w wńÖtrobie oraz jelicie grubym (mikroflora).
Znaczna czńôŇõńá przyjńôtej kwercetyny (niewchŇāonińôta w jelicie cienkim oraz wydalona z Ňľ√≥ŇācińÖ) ulega przemianom pod wpŇāywem flory jelitowej. Dochodzi do uwolnienia aglikonu z poŇāńÖczeŇĄ glikozydowych i glukuronian√≥w, rozerwania pierŇõcienia i powstania fenolokwas√≥w, kt√≥re nastńôpnie mogńÖ byńá wchŇāaniane (56). Po degradacji poŇāńÖczeŇĄ kwercetyny przez mikroflorńô powstajńÖ nastńôpujńÖce kwasy: 3-hydroksycynamonowy, 3-hydroksyfenylooctowy, 3,4-dihydroksyfenylooctowy, 3-metoksy-4-hydroksyfenylooctowy (homowanilinowy) (28, 64, 76).
Rozerwanie heterocyklicznego pierŇõcienia C powoduje zanik aktywnoŇõci antyoksydacyjnej (73). Metabolity kwercetyny, takie jak 3´-O-metylokwercetyna, mogńÖ nadal wykazywańá dziaŇāanie biologiczne; wŇāaŇõciwoŇõci przeciwutleniajńÖce wykazano w badaniach in vitro (45). Produkty rozkŇāadu rutozydu i kwercetyny: kwasy 3,4-dihydroksyfenylooctowy i 4-hydroksyfenylooctowy, wykazujńÖ silniejszńÖ aktywnoŇõńá antyagregacyjnńÖ niŇľ zwińÖzki wyjŇõciowe (75).
CaŇākowita eliminacja kwercetyny z organizmu zachodzi powoli; okres p√≥Ňātrwania wynosi okoŇāo 25 godzin (36). Wynika to z ŇāńÖczenia sińô koniugat√≥w z albuminami osocza, a takŇľe moŇľliwoŇõci wchodzenia metabolit√≥w do krńÖŇľenia jelitowo-wńÖtrobowego (72).
Jak przedstawiono powyŇľej, przeksztaŇācenie glikozyd√≥w kwercetyny w poŇāńÖczenia glukozydowe jest znaczńÖcym krokiem do zwińôkszonego wchŇāaniania kwercetyny z poŇľywienia oraz preparat√≥w leczniczych. Rutozyd, skŇāadnik wielu preparat√≥w, moŇľe byńá nazywany „prolekiem”, gdyŇľ dopiero jego metabolity ulegajńÖ wchŇāonińôciu i wykazujńÖ aktywnoŇõńá biologicznńÖ.
FLAWONY
SpoŇõr√≥d flawon√≥w w owocach i warzywach najczńôŇõciej wystńôpujńÖ glikozydy luteoliny i apigeniny (ryc. 2). W poŇľywieniu Ňļr√≥dŇāem o najwińôkszym znaczeniu sńÖ pietruszka i seler (tab. 1). W lecznictwie znalazŇāa zastosowanie diosmina (7-rutynozyd diosmetyny), kt√≥ra wraz z flawanonem hesperydynńÖ (7-rutynozyd hesperetyny), stosowana jest w terapii niewydolnoŇõci krńÖŇľenia Ňľylnego i hemoroid√≥w.
Przemiany metaboliczne flawon√≥w sńÖ analogiczne do opisanych wczeŇõniej dla kwercetyny. PoŇāńÖczenia glikozydowe sńÖ rozkŇāadane w jelicie, wolne aglikony wchŇāaniajńÖ sińô z jelita lub ulegajńÖ degradacji pod wpŇāywem enzym√≥w bakteryjnych. 7-O-glukozyd luteoliny jest hydrolizowany do aglikonu przez endogenne b-glukozydazy, a nastńôpnie absorbowany w jelicie cienkim. Podczas przejŇõcia przez Ňõluz√≥wkńô jelita dochodzi do sprzńôgania, gŇā√≥wnie z kwasem glukuronowym (73). W osoczu luteolina wystńôpuje przede wszystkim w postaci monoglukuronian√≥w (50).
W jelicie grubym mikroflora bakteryjna przetwarza flawony do pochodnych kwasu fenylopropionowego. W badaniach Booth i wsp. (7), po podaniu szczurom doŇľoŇāńÖdkowo diosminy w moczu oznaczali jako gŇā√≥wny metabolit kwas 3-hydroksyfenylopropionowy. Po podaniu w analogiczny spos√≥b diosmetyny wyniki byŇāy podobne, oznaczono dodatkowo glukuronid diosmetyny.
Flawony, takie jak diosmina i jej aglikon diosmetyna, mogńÖ modyfikowańá metabolizm ksenobiotyk√≥w poprzez wpŇāyw na enzymy cytochromu P 450, oba zwińÖzki powodujńÖ wzrost aktywnoŇõci CYP 1A1 (13, 32).
Na wchŇāanianie flawonoid√≥w z preparat√≥w leczniczych moŇľe mieńá wpŇāyw formulacja postaci leku. Mikronizacja diosminy znaczńÖco polepsza wchŇāanianie tego zwińÖzku, co potwierdziŇāy badania Garnera i wsp. (27). Po podaniu zdrowym ochotnikom znakowanej 14C diosminy jej absorpcja z przewodu pokarmowego, mierzona caŇākowitńÖ radioaktywnoŇõcińÖ zwińÖzk√≥w wydalonych z moczem, wynosiŇāa 57,9±20,2% dla zmikronizowanego i 32,7±18,8% dla niezmikronizowanego zwińÖzku (27).
FLAWANONY
Flawanony sńÖ grupńÖ zwińÖzk√≥w, w kt√≥re obfitujńÖ owoce cytrusowe, m.in. grejpfrut ( Citrus paradisi) i pomaraŇĄcza ( Citrus chinensis). NaleŇľńÖ tu takie aglikony jak naryngenina, hesperetyna. 7-ramnoglukozyd naryngeniny (naryngina) znajduje sińô w soku, kwiatach i sk√≥rce grejpfruta, stanowińÖc nawet 10% suchej masy (84). Hesperetyna i jej glikozydy to gŇā√≥wne flawanony cytryn i sŇāodkich pomaraŇĄczy. Szklanka soku pomaraŇĄczowego moŇľe zawierańá 25-80 mg flawanon√≥w w przeliczeniu na aglikon (46).
Naryngenina i hesperetyna mogńÖ byńá wchŇāaniane z poŇľywienia, co potwierdzono oznaczajńÖc te zwińÖzki w ludzkim osoczu oraz moczu, odpowiednio po podaniu soku grejpfrutowego i pomaraŇĄczowego oraz czystych zwińÖzk√≥w (84). W przewodzie pokarmowym dochodzi do rozkŇāadu poŇāńÖczeŇĄ glikozydowych; wchŇāaniane mogńÖ byńá aglikony. Oznaczono szczepy bakterii odpowiedzialne za rozkŇāad narynginy do naryngeniny oraz hesperydyny do wolnej hesperetyny; w zaleŇľnoŇõci od skŇāadu mikroflory obserwowano duŇľńÖ osobniczńÖ rozbieŇľnoŇõńá w absorpcji tych zwińÖzk√≥w (84).
Znaczna czńôŇõńá wchŇāonińôtej naryngeniny pojawia sińô w moczu w postaci poŇāńÖczeŇĄ z kwasem glukuronowym, a koniugacja zachodzi w wńÖtrobie lub juŇľ w jelicie cienkim z pomocńÖ UDP-glukuronylotransferazy. Badania na zdrowych ochotnikach wykazaŇāy, Ňľe w moczu 13% flawanon√≥w byŇāo mieszanymi poŇāńÖczeniami z kwasem siarkowym i glukuronowym (46, 88). Wyniki badaŇĄ in vitro prowadzonych na izolowanym jelicie cienkim, bńÖdŇļ jego homogenatach sugerujńÖ, Ňľe monoglikozydy mogńÖ byńá rozkŇāadane w jelicie cienkim, diglikozydy natomiast przechodzńÖ do jelita grubego (12, 15). Po 24 godzinach od spoŇľycia soku pomaraŇĄczowego eliminacja z moczem metabolit√≥w wynosiŇāa blisko 98% (46).
W badaniach na szczurach, stosujńÖc znakowanńÖ 14C hesperetynńô wykazano, Ňľe 40% wchŇāonińôtego zwińÖzku dociera do wńÖtroby (84). Tam przez hydroksylacjńô naryngeniny i demetylacjńô hesperetyny, powstaje eriodiktiol, gŇā√≥wny metabolit obu tych zwińÖzk√≥w (84). Hydroksylacja naryngeniny zachodzi przy udziale wńÖtrobowego izoenzymu cytochromu P 450 (CYP 1A), natomiast hesperetyna jest substratem dla CYP 1A1 i CYP 1B1 prowadzńÖcych demetylacjńô (32). Flawanony mogńÖ byńá specyficznymi induktorami cytochrom√≥w (np. CYP 2B1/2), jednak naryngenina wykazuje dziaŇāanie hamujńÖce wobec CYP 3A4 w enterocytach jelita cienkiego. Wraz z bergamotynńÖ, furanokumarynńÖ wystńôpujńÖcńÖ takŇľe w Citrus paradisi, naryngenina odpowiada za upoŇõledzenie metabolizmu lek√≥w podawanych razem z sokiem grejpfrutowym (14, 22, 46). CzńôstoŇõńá wystńôpowania interakcji soku z grejpfruta z innymi lekami moŇľe byńá uzaleŇľniona od indywidualnych r√≥Ňľnic w skŇāadzie mikroflory jelitowej, kt√≥ra powoduje rozkŇāad glikozyd√≥w i uwolnienie Ňāatwiej wchŇāanialnych aglikon√≥w.
U szczur√≥w gŇā√≥wnńÖ drogńÖ wydalania flawonoid√≥w jest wydzielanie do Ňľ√≥Ňāci. Flawanony sńÖ wchŇāaniane zwrotnie i wchodzńÖ do krńÖŇľenia jelitowo-wńÖtrobowego lub ulegajńÖ rozkŇāadowi pod wpŇāywem enzym√≥w bakteryjnych w okrńôŇľnicy (84). PowstajńÖce hydroksykwasy mogńÖ nastńôpnie byńá wchŇāaniane. Po podaniu szczurom naryngeniny w moczu oznaczono kwas 4-hydroksyfenylopropionowy (7), kwas 4-hydroksycynamonowy i 4-hydroksybenzoesowy (46). Niekt√≥rzy autorzy sńÖdzńÖ, Ňľe jedynie kwas 4-hydroksyfenylopropionowy jest produktem rozkŇāadu bakteryjnego, a pozostaŇāe metabolity powstajńÖ w wńÖtrobie (84).
Przygotowanie odwar√≥w z naowocni Citrus grandis z dodatkiem miodu powodowaŇāo zwińôkszenie stńôŇľenia narynginy w wycińÖgu. Lecz jednoczeŇõnie po podaniu zdrowym ochotnikom zmniejszyŇāo wchŇāanianie tego zwińÖzku, prawdopodobnie na skutek zahamowania powstawania aglikonu (naryngeniny) (39). Wyniki te wskazujńÖ na wpŇāyw innych skŇāadnik√≥w poŇľywienia na dostńôpnoŇõńá flawonoid√≥w.
POCHODNE FLAWAN-3-OLU
Herbata, czyli suszone i odpowiednio preparowane liŇõcie Camelia sinensis, zawiera wiele zwińÖzk√≥w, jednak jej aktywnoŇõńá biologiczna, taka jak obniŇľanie poziomu lipid√≥w, dziaŇāanie przeciwzapalne, przeciwbakteryjne, antymutagenne i antyoksydacyjne, wynika gŇā√≥wnie z zawartoŇõci frakcji polifenoli, z najwińôkszym udziaŇāem katechin (91). W herbacie znajdujńÖ sińô m.in. wolne aglikony, takie jak (–)-epikatechina (EC) i (+)-katechina oraz estry kwasu galusowego: galusan 3-(–)-epikatechiny (ECG), galusan 3-(–)-epigalokatechiny (EGCG). ZwińÖzki te wystńôpujńÖ takŇľe w czekoladzie (gŇā√≥wnie (+)-katechina i (–)-epikatechina), czy czerwonym winie (m.in. (+)-katechina) (4, 6, 20).
Flawanole, w odr√≥Ňľnieniu od pozostaŇāych pochodnych flawonoidowych, w roŇõlinach wystńôpujńÖ jako formy niezglikozydowane. W zwińÖzku z tym aktywnoŇõńá b-glukozydazy nie ma wpŇāywu na proces wchŇāaniania. Stosunkowo dobrze absorbowana jest (+)-katechina, jednak inne pochodne flawonoidowe herbaty charakteryzujńÖ sińô niskńÖ absorpcjńÖ i dostńôpnoŇõcińÖ u ludzi (82). Udowodniono wpŇāyw Ňõliny na estry katechiny zawarte w zielonej herbacie; odŇāńÖczenie reszty kwasu galusowego z galusanu epigalokatechiny zaobserwowali Yang i wsp. (87). Podstawniki hydroksylowe ugrupowaŇĄ galoilowych mogńÖ wińÖzańá sińô z biaŇākami powierzchniowymi bŇāon oraz obecnymi w Ňõlinie, co upoŇõledza wchŇāanianie przez obniŇľenie rozpuszczalnoŇõci (91). Podczas pasaŇľu pokarmu z ŇľoŇāńÖdka do jelita cienkiego moŇľe dochodzińá do oksydacji galusanu epigalokatechiny z wytworzeniem produkt√≥w dimerycznych, kt√≥re majńÖ wyŇľszńÖ aktywnoŇõńá neutralizacji wolnych rodnik√≥w i wińÖzania jon√≥w Ňľelaza niŇľ EGCG (75).
Flawan-3-ole w jelicie cienkim ulegajńÖ sprzńôganiu z kwasem glukuronowym, tworzńÖc bardziej polarne koniugaty 5- lub 7-O-glukuronidowe oraz 3´- lub 4´-O-metyloglukuronidy (63). W innych procesach, prowadzonych przez metylotransferazy, powstajńÖ 3´-O-metylowe pochodne; ich aktywnoŇõńá antyoksydacyjna jest zmniejszona (20, 75). Glukuronidy katechiny i epikatechiny wykazujńÖ podobnńÖ do wolnych zwińÖzk√≥w aktywnoŇõńá wymiatania wolnych rodnik√≥w (38).
Badania prowadzone na myszach i szczurach potwierdziŇāy wchŇāanianie z jelita galusanu epigalokatechiny (44, 53). EGCG oznaczany w osoczu w 50-90% byŇā zwińÖzany z kwasem glukuronowym. Badania Zhu i wsp. (91) wykazaŇāy najwińôksze stńôŇľenie katechin we krwi w 2 godziny po podaniu szczurom frakcji zawierajńÖcej EC, ECG i EGCG. ZwińÖzki te w znacznym stopniu przenikajńÖ do tkanek, co mimo niskiej dostńôpnoŇõci biologicznej, warunkuje ich korzystne dziaŇāanie. Po podaniu doŇľylnym nieskoniugowany galusan epigalokatechiny oznaczano m.in. w pŇāucach i prostacie (44).
Znaczne modyfikacje struktury zachodzńÖ w okrńôŇľnicy, gdzie bakterie jelitowe degradujńÖ flawanole do kwas√≥w fenolowych. Niekt√≥re z nich mogńÖ byńá wchŇāaniane i wywierańá wŇāasne dziaŇāanie biologiczne. Degradacja w okrńôŇľnicy prowadzi do rozkŇāadu ukŇāadu flawanu i wytworzenia prostszych zwińÖzk√≥w fenolowych, jak walerolaktony i kwas hydroksyfenylopropionowy (63).
Jak wynika z badaŇĄ Roodenburga i wsp. (69) spoŇľywanie zielonej lub czarnej herbaty powoduje wzrost stńôŇľenia katechin we krwi, z towarzyszńÖcym temu procesowi wzrostem aktywnoŇõci antyoksydacyjnej, mierzonej zdolnoŇõcińÖ aktywnoŇõci osocza do redukcji jon√≥w Ňľelaza (FRAP). Mleko, podawane z czarnńÖ herbatńÖ, nie hamowaŇāo wchŇāaniania katechin, ani nie znosiŇāo obserwowanego wzrostu aktywnoŇõci przeciwutleniajńÖcej (69). Polepszenie absorpcji flawonoid√≥w moŇľna uzyskańá podajńÖc je wraz z substancjami emulgujńÖcymi. Podanie katechiny wraz z fosfolipidami zwińôkszyŇāo jej wchŇāanianie (61).
Proantocyjanidyny sńÖ zwińÖzkami polimerycznymi, kt√≥rych podstawowa struktura skŇāada sińô z jednostek polihydroksyflawan-3-olu poŇāńÖczonych wińÖzaniami C-C (26). Proantocyjanidyny majńÖ wybitnńÖ aktywnoŇõńá wymiatania wolnych rodnik√≥w i hamowania oksydacji LDL in vitro. WŇāaŇõciwoŇõci te potwierdzono takŇľe badajńÖc wpŇāyw na Ňľywy organizm (szczury) (42). Oligomery proantocyjanidynowe uwaŇľane sńÖ w powszechnej opinii za najskuteczniejsze przeciwutleniacze roŇõlinne. Szczeg√≥lnie duŇľo zwińÖzk√≥w tego typu znajduje sińô w czekoladzie, jabŇākach, Ňľurawinie czy czerwonym winie (tab. 1) (29). WysokńÖ ich zawartoŇõcińÖ charakteryzujńÖ sińô owoce winoroŇõli; wycińÖgi z nasion stosowane sńÖ jako Ňõrodek wspomagajńÖcy leczenie przewlekŇāej niewydolnoŇõci Ňľylnej i mikroangiopatii (26).
Inkubacja oligomer√≥w procyjanidyn (dimery – heksamery) w Ňõrodowisku ludzkiej Ňõliny przez 30 minut nie powodowaŇāa zmian w budowie tych zwińÖzk√≥w, a takŇľe nie zaobserwowano rozkŇāadu wińôkszych czńÖsteczek na mniejsze jednostki (75). Stwierdzono natomiast, Ňľe dimery proantocyjanidynowe majńÖ wysokie powinowactwo do wińÖzania sińô z biaŇākami Ňõliny bogatymi w prolinńô. Szczeg√≥lnie wysokńÖ aktywnoŇõńá wykazujńÖ estry galoilowe epikatechiny, a takŇľe galusany dimer√≥w procyjanidyny typu B2 (25).
WedŇāug Spencer´a i wsp. (74) oligomery procyjanidynowe (od trimer√≥w do dekamer√≥w) izolowane z Theobroma cacao sńÖ niestabilne w kontakcie z sokiem ŇľoŇāńÖdkowym ex vivo i tworzńÖ monomery, dimery epikatechiny oraz inne jednostki oligomeryczne. Z przeprowadzonych przez Rios i wsp. (67) doŇõwiadczeŇĄ na zdrowych ochotnikach wynika, Ňľe w Ňõrodowisku soku ŇľoŇāńÖdkowego, po podaniu napoju z kakaowca, zwińÖzki oligomeryczne pozostajńÖ niezmienione.
Oligomery procyjanidynowe o duŇľej masie czńÖsteczkowej odznaczajńÖ sińô wysokim powinowactwem do struktur biaŇākowych Ňõciany jelita (70). W eksperymentach z uŇľyciem jednowarstwowej hodowli kom√≥rek nowotworu jelita grubego (Caco-2) wykazano, Ňľe jedynie dimery i trimery sńÖ w stanie przenikańá przez nabŇāonek jelita (19). Oznaczono dimer procyjanidynowy B2, (–)-epikatechinńô i (+)-katechinńô we krwi u ludzi, juŇľ 30 minut po podaniu wycińÖgu z nasion kakaowca (38).
PowyŇľej zamieŇõciliŇõmy fragment artykuŇāu, do kt√≥rego moŇľesz uzyskańá peŇāny dostńôp.
Mam kod dostńôpu
- Aby uzyskańá pŇāatny dostńôp do peŇānej treŇõci powyŇľszego artykuŇāu albo wszystkich artykuŇā√≥w (w zaleŇľnoŇõci od wybranej opcji), naleŇľy wprowadzińá kod.
- WprowadzajńÖc kod, akceptujńÖ PaŇĄstwo treŇõńá Regulaminu oraz potwierdzajńÖ zapoznanie sińô z nim.
- Aby kupińá kod proszńô skorzystańá z jednej z poniŇľszych opcji.
Opcja #1
24 zŇā
Wybieram
- dostńôp do tego artykuŇāu
- dostńôp na 7 dni
uzyskany kod musi byńá wprowadzony na stronie artykuŇāu, do kt√≥rego zostaŇā wykupiony
Opcja #2
59 zŇā
Wybieram
- dostńôp do tego i pozostaŇāych ponad 7000 artykuŇā√≥w
- dostńôp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zŇā
Wybieram
- dostńôp do tego i pozostaŇāych ponad 7000 artykuŇā√≥w
- dostńôp na 90 dni
- oszczńôdzasz 28 zŇā
PiŇõmiennictwo
1. Ader P., et al.: Interaction of quercetin glucosides with the intestinal sodium/glucose co-transporter (SGLT-1). Cancer Lett. 2000, 162, 175. 2.Aherne S.A., O´Brien N.M.: Dietary flavonols: chemistry, food content, and metabolism. Nutrition 2002, 18, 75. 3.Arcari M., et al.: A new inclusion complex of silibin and beta-cyclodextrins: in vitro dissolution kinetics and in vivo absorption in comparison with traditional formulations. Biol. Pharm. Bull. 1992, 131, 205. 4.Arts I.C.W., et al.: Chocolate as a source of tea flavonoids. Lancet 1999, 354, 488. 5.Bhattaram V.A., et al.: Pharmacokinetics and bioavailability of herbal medicinal products. Phytomed. 2002, 9, 1. 6. Bombardelli E., Morazzoni P.: Vitis vinifera L. Fitoterapia 1995, 66, 291. 7.Booth A.N., et al.: Metabolic fate of hesperidin, eriodictyol, homoeriodictyol, and diosmin. J. Biol. Chem. 1958, 230, 661. 8.Breinholt V.M., et al.: In vitro investigation of cytochrome P 450-mediated metabolism of dietary flavonoids. Food Chem. Toxicol. 2002, 40, 609. 9.Chang Y.C., Nair M.G.: Metabolites of daidzein and genistein and their biological activities. J. Nat. Prod. 1995, 58, 1901. 10.Chang Y.C., Nair M.G.: Metabolism of daidzein and genistein by intestinal bacteria. J. Nat. Prod. 1995, 58, 1892. 11.Chen C.Y., et al.: High-genistin isoflavone supplementation modulated erythrocyte antioxidant enzymes and increased running endurance in rats undergoing one session of exhausting exercise – a pilot study. Pakist. J. Nutr. 2002, 1, 1. 12.Choudhury R., et al.: Interactions of the flavonoid naringenin in the gastrointestinal tract and the influence of glycosylation. Biochem. Biophys. Res. Comm. 1999, 265, 410. 13.Ciolino H.P., et al.: Diosmin and diosmetin are agonists of the aryl hydrocarbon receptor that differentially affect cytochrome P 540 1A1 activity. Cancer Res. 1998, 58, 2754. 14.Dahan A., Altman H.: Food-drug interaction: grapefruit juice augments drug bioavailability – mechanism, extend and relevance. Eur. J. Clin. Nutr. 2004, 58, 1. 15.Day A.J., et al.: Deglycosylation of flavonoid and isoflavonoid glycosides by human small intestine and liver b-glucosidase activity. FEBS Lett. 1998, 436, 71. 16.Day A.J., et al.: Dietary flavonoid and isoflavone glycosides are hydrolysed by the lactase site of lactase phlorizin hydrolase. FEBS Lett. 2000, 468, 166. 17.Day A.J., et al.: Human metabolism of dietary flavonoids: identification of plasma metabolites of quercetin. Free Rad. Res. 2001, 35, 941. 18.Deprez S., et al.: Polymeric proanthocyanidins are catabolized by human colonic microflora into low-molecular-weight phenolic acids. J. Nutr. 2000, 130, 2733. 19.Deprez S., et al.: Transport of proanthocyanidin dimer, trimer and polymer across monolayers of human intestinal epithelial Caco-2 cells. Antiox. Redox. Signal 2001, 3, 957. 20.Donovan J.L., et al.: Catechin is present as metabolites in human plasma after consumption of red wine. J. Nutr. 1999, 129, 1662. 21. Ebadi M.: Pharmacodynamic basis of herbal medicine. CRC Press 2002. 22.Erlund I.: Chemical analysis and pharmacokinetics of the flavonoids quercetin, hesperetin and naringenin in humans. Academic dissertation. Helsinki 2002. 23.Felgines C., et al.: Strawberry anthocyanins are recovered in urine as glucuro- and sulphoconjugates in humans. J. Nutr. 2003, 133, 1296. 24.Frank T., et al.: Bioavailability of anthocyanidin-3-glucosides following consumption of red grape juice. Can. J. Physiol. Pharmacol. 2003, 81, 423. 25. Freitas V. de, Mateus N.: Structural features of procyanidin interaction with salivary proteins. J. Agric. Food Chem. 2001, 49, 940. 26.Gabetta B., et al.: Characterisation of proanthocyanidins from grape seeds. Fitoterapia 2000, 71, 162. 27.Garner R.C., et al.: Comparison of the absorption of micronized (Daflon 500 mg) and non micronized 14C-diosmin tablets after oral administration to healthy volunteers by accelerator mass spectrometry and liquid scintillation counting. J. Pharm. Sci. 2002, 91, 32. 28.Gräfe U., Veit M.: Urinary metabolites of flavonoids and hydroxycinnamic acids in humans after application of a crude extract from Equisetum arvense L. Phytomed. 1999, 6, 239. 29.Hammerstone J.F., et al.: Procyanidin content and variation in some commonly consumed foods. J. Nutr. 2000, 130, 2086. 30.Havsteen B.H.: The biochemistry and medical significance of the flavonoids. Pharmacol. Ther. 2002, 96, 67. 31.Hertog M.G.L., et al.: Dietary antioxidant flavonoids and risk of coronary heart disease: the Zuphten Elderly Study. Lancet 1993, 342, 1007. 32.Hodek P., et al.: Flavonoids-potent and versatile biologically active compounds interacting with cytochromes P 450. Chem. Biol. Interact. 2002, 139, 1. 33. Hof K.H. van het, et al.: Bioavailability of catechins from tea: the effect of milk. Eur. J. Clin. Nutr. 1998, 52, 356. 34. Hollman P.C.H., et al.: Absorption of dietary quercetin glycosides and quercetin in healthy ileostomy volunteers. Am. J. Clin. Nutr. 1995, 62, 1276. 35.Hollman P.C.H., Katan M.B.: Absorption, metabolism and health effects of dietary flavonoids in man. Biomed. Pharmacother. 1997, 51, 305. 36.Hollman P.C.H., et al.: Bioavailability of the dietary antioxidant flavonol quercetin in man. Cancer Lett. 1997, 114, 139. 37.Hollman P.C.H., et al.: Relative bioavailability of the antioxidant flavonoid quercetin from various foods in man. FEBS Lett. 1997, 418, 152. 38.Holt R.R., et al.: Procyanidin dimer B2 (epicatechin-4b-epicatechin) in human plasma after the consumption of a flavanol-rich cocoa. Am. J. Clin. Nutr. 2002, 76, 798. 39.Hou Y.C., et al.: Effect of honey on naringin absorption from a decoction of the pericarps of Citrus grandis. Planta Med. 2000, 66, 439. 40.Huxley R.R., Neil H.A.W.: The relation between dietary intake and coronary heart disease mortality: a meta-analysis of prospective cohort studies. Eur. J. Clin. Nutr. 2003, 57, 904. 41.Knekt P., et al.: Flavonoid intake and risk of chronic diseases. Am. J. Clin. Nutr. 2002, 76, 560. 42.Koga T., et al.: Increase of antioxidative potential of rat plasma by oral administration of proanthocyanidin-rich extract from grape seeds. J. Agric. Food Chem. 1999, 47, 1892. 43.Kong J.M., et al.: Analysis and biological activities of anthocyanins. Phytochem. 2003, 64, 923. 44. Lambert J.D., et al.: Epigalocatechin-3-gallate is absorbed but extensively glucuronidated following oral administration to mice. J. Nutr. 2003, 133, 4172. 45.Manach C., et al.: Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties. FEBS Lett. 1998, 426, 331. 46. Manach C., et al.: Bioavailability in humans of the flavanones hesperidin and narirutin after the ingestion of two doses of orange juice. Eur. J. Clin. Nutr. 2003, 57, 235. 47.Manach C., et al.: Polyphenols: food sources and bioavailability. Am. J. Clin. Nutr. 2004, 79, 727. 48.McAnlis G.T., et al.: Absorption and antioxidant effects of quercetin from onions, in man. Eur. J. Clin. Nutr. 1999, 53, 92. 49.Messina M.: A healthy look at sweet cherries. www.nwcherries.com. 50.Miyake Y., et al.: Identification and antioxidant activity of flavonoid metabolites in plasma and urine of eriocitrin-treated rats. J. Agric. Food Chem. 2000, 48, 3217. 51.Morazzoni P., et al.: Comparative pharmacokinetics of silipide and silimarin in rats. Eur. J. Drug Metab. Pharmacokinet. 1993, 18, 289. 52.Murkovic M., et al.: Analysis of anthocyanins in plasma for determination of their bioavailability. J. Food Comp. Analys. 2000, 13, 291. 53.Nakagawa K., Miyazawa T.: Absorption and distribution of tea catechin, (–)-epigallocatechin-3-gallate, in the rat. J. Nutr. Sci. Vitaminol 1997, 43, 679. 54.Narayan M.S., et al.: Antioxydant effect of anthocyanin on enzymatic and non-enzymatic lipid peroxidation. Prostagl. Leukotr. Essent. Fatty Acids 1999, 60, 1. 55.Nemeth K., et al.: Deglycosylation by small intestinal epithelial cell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans. Eur. J. Nutr. 2003, 42, 29. 56.Olthof M.R., et al.: Bioavailabilities of quercetin-3-glucoside and quercetin-4´-glucoside do not differ in humans. J. Nutr. 2000, 130, 1200. 57.Olthof M.R., et al.: Chlorogenic acid, quercetin-3-rutinoside and black tea polyphenols are extensively metabolized in humans. J. Nutr. 2003, 133, 1806. 58.Passamonti S., et al.: The interaction of anthocyanins with bilitranslocase. Biochem. Biophys. Res. Commun. 2002, 296, 631. 59.Passamonti S., et al.: The stomach as a site for anthocyanins absorption from food. FEBS Lett. 2003, 544, 210. 60.Pietta P.G.: Flavonoids as antioxidants. J. Nat. Prod. 2000, 63, 1035. 61. PiscuŇāa M.K., Terao J.: Quercetin´s solubility affects its accumulation in rat plasma after oral administration. J. Agric. Food Chem. 1998, 46, 4313. 62.Prior R.L.: Fruits and vegetables in the prevention of cellular oxidative damage. Am. J. Clin. Nutr. 2003, 78, 570. 63.Rechner A.R., et al.: The metabolic fate of dietary polyphenols in humans. Free Rad. Biol. Med. 2002, 33, 220. 64.Rechner A.R., et al.: Colonic metabolism of dietary polyphenols: influence of structure on microbial fermentation products. Free Rad. Biol. Med. 2004, 36, 212. 65.Rice-Evans C.A., et al.: Structure-antioxidant activity relationship of flavonoids and phenolic acids. Free Rad. Biol. Med. 1996, 20, 933. 66.Rice-Evans C.A., et al.: Antioxidant properties of phenolic compounds. Trends in plant science 1997, 2, 152. 67.Rios L.Y., et al.: Cocoa procyanidins are stable during gastric transit in humans. Am. J. Clin. Nutr. 2002, 76, 1106. 68.Rohdewald P.: Bioavailability and metabolism of Pycnogenol(r). Eur. Bull. Drug Res. 1999, 7, 2. 69.Roodenburg A.J.C., et al.: Bioavailability and antioxidant activity of tea flavonoids. 2-nd International Electronic Conference on Synthetic Organic Chemistry (ECSOC-2), September 1998. www.mdpi.org. 70.Ross J.A., Kasum C.M.: Dietary flavonoids: bioavailability, metabolic effects, and safety. Ann. Rev. Nutr. 2002, 22, 19. 71.Schandalik R., et al.: Pharmacokinetics of silybin in bile following administration of silipide and silymarin in cholecystectomy patients. Arzneim.-Forsch. 1992, 42, 964. 72.Skibola C.F., Smith M.T.: Potential health impacts of excessive flavonoid intake. Free Rad. Biol. Med. 2000, 29, 375. 73.Spencer J.P.E., et al.: The small intestine can both absorb and glucuronidate luminal flavonoids. FEBS Lett. 1999, 458, 224. 74.Spencer J.P.E., et al.: Decomposition of cocoa procyaniodins in the gastric milieu. Biochem. Biophys. Res. Commun. 2000, 272, 236. 75.Spencer J.P.E.: Metabolism of tea flavonoids in the gastrointestinal tract. J. Nutr. 2003, 133, 3255. 76.Stahl W., Vet al.: Bioavailability and metabolism. Mol. Aspects Med. 2002, 23, 39. 77.Strack D., Wray V.: Anthocyanins. In: Methods in plant biochemistry (P.M. Dey, J.B. Harborne). Vol. 1. Plant phenolics. Academic Press 1989. 78.Texier O., et al.: Comparison of the bioavailability of dietary quercetin and catechin in rats. 2-nd International Electronic Conference on Synthetic Organic Chemistry (ECSOC-2), September 1998. www.mdpi.org. 79.USDA database for the flavonoid content of selected foods – 2003. http://www.nal.usda.gov/fnic/foodcomp/data/flav.html. 80.Virgilli F., et al.: Ferulic acid excretion as a marker of consumption of a French Maritime Pine ( Pinus maritima) bark extract. Free Rad. Biol. Med. 2000, 28, 1249. 81.Walgren R.A., et al.: Cellular uptake of dietary flavonoid quercetin-4´-b-glucoside by sodium-dependent glucose transporter SGLT1. J. Pharmacol. Exp. Ther. 2000, 294, 837. 82.Walle T.: Absorption and metabolism of flavonoids. Free. Rad. Biol. Med. 2004, 36, 829. 83.WHO Monograph on selected medicinal plants. Vol. 1. Geneva 1999. 84.Wilcox L.J., et al.: Antiatherogenic properties of naringenin, a citrus flavonoid. Cardiovasc. Drug Rev. 1999, 17, 160. 85.Williams C.A., Harborne J.B.: Isoflavonoids. In: Methods in plant biochemistry (P.M. Dey, J.B. Harborne). Vol. 1. Plant Phenolics. Academic Press 1989. 86.Wu X., et al.: Absorption and metabolism of anthocyanins in elderly woman after consumption of elderberry or blueberry. J. Nutr. 2002, 132, 1865. 87.Yang C.S., et al.: Human salivary tea catechin levels and catechin esterase activities: implication in human cancer prevention studies. Cancer Epidemiol. Biomarkers Prev. 1999, 8, 83. 88.Yang C.Y., et al.: Determination of hesperetin and its conjugate metabolites in serum and urine. J. Food Drug Anal. 2002, 10, 143. 89. Yamamoto S., et al.: Soy, isoflavones and breast cancer risk in Japan. J. Nat. Cancer Inst. 1995, 12, 906. 90. Yasuda T., et al.: Urinary and biliary metabolites of daidzin and daidzein in rats. Biol. Pharm. Bull. 1994, 17, 1369. 91.Zhu M., et al.: Oral absorption and bioavailability of tea catechins. Planta Med. 2000, 66, 444.







