© Borgis - Postępy Fitoterapii 4/2004, s. 163-168
Justyna Stefanowicz, J. Renata Ochocka
Kokoryczka wielokwiatowa Polygonatum multiflorum (L.) All. – pospolita roślina lecznicza naszych lasów
Solomon´s seal (Polygonatum multiflorum (L.) All.) – common medicinal plant of ours forests
Katedra i Zakład Biologii i Botaniki Farmaceutycznej Akademii Medycznej w Gdańsku
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. J. Renata Ochocka
Summary
Polygonatum multiflorum (L.) All. – Solomon´s seal is a common herb in Europe. It is a perennial plant with the odorless, greenish - white flowers, blue-black berries and ovate to elliptical leaves. It is a medicinal herb and extracts from the rhizome and roots of Solomon´s seal have found uses mainly for external problems. The herb is used for internal diseases too, but only under professional supervision. Polygonatum multiflorum contains mainly steroid saponins, mucilages, lectins, flavonoids and the active compounds have an antiinflammatory, astringent, diuretic and lowering the level of blood sugar effects. Nowadays, Solomon´s seal seems to be interesting due to cytotoxic activity of steroid saponins on the animal and human carcinoma cells.

Kokoryczka wielokwiatowa – Polygonatum multiflorum (L.) All., syn. Convallaria multiflora to bylina należąca do rodziny konwaliowatych Convallariaceae.Występuje powszechnie w Europie, wschodniej Azji, Himalajach, Syberii oraz Ameryce Północnej. W Polsce jest pospolita na całym obszarze jako roślina lasów liściastych (bukowo-grabowych) oraz zarośli i lasów nadrzecznych (za wyjątkiem terenów położonych powyżej 600 m n.p.m.). Preferuje miejsca cieniste oraz gleby gliniaste o odczynie zasadowym lub słabo kwaśnym.
W Polsce oprócz kokoryczki wielokwiatowej spotykane są jeszcze dwa inne gatunki tego rodzaju, a mianowicie kokoryczka okółkowa – Polygonatum verticillatum (L.) All. o liściach w okółkach i drobnych, niepozornych kwiatach, występująca w górach i rzadziej na niżu oraz kokoryczka wonna, nazywana również lekarską – Polygonatum odoratum (Mill.) Druce = Polygonatum officinale All. o kwiatach pachnących, spotykana częściej na niżu niż w górach (3, 17, 20, 24, 25). Szafer i wsp. (22) oprócz wyżej wspomnianych gatunków wymieniają również kokoryczkę szerokolistną – Polygonatum latifolium ( Jacq.) Desf. rosnącą w widnych lasach i zaroślach. Nazwa kokoryczki wywodzi się z języka greckiego – „ polýs ” znaczy „liczny, wielokrotny”, zaś „ góny ” – „kolano”. Odnosi się to do kolankowatych zgrubień kłącza rośliny, które złożone jest z wielu odcinków (19).
OPIS BOTANICZNY
Kokoryczka wielokwiatowa jest rośliną trwałą, sięgającą niekiedy do jednego metra wysokości (zazwyczaj 30-80 cm), zimującą w postaci kłącza pod powierzchnią ziemi. Na grubej, obłej łodydze, osadzone są skrętolegle jajowatoeliptyczne liście do 15 cm długie, gładkie, górą ciemnozielone, spodem błękitnawe, zwężające się u podstawy i malejące w stronę szczytu łodygi. Są zaostrzone i całobrzegie, z wyraźnymi nerwami. W ich nasadzie rozwijają się w maju zwisające, najczęściej dwu- lub trójkwiatowe grona.
Okwiat jest biały, bezwonny, zrosłopłatkowy, w kształcie wydłużonego dzwoneczka, zakończony sześcioma krótkimi, zielonawymi łatkami (ryc. 1). Wejście do rurki zamyka sześć zwartych pylników, osadzonych na krótkich, owłosionych, przyrośniętych do korony nitkach oraz niewielkie znamię, umieszczone na wydłużonej mocno szyjce. Owocem jest jagoda (8-9 mm średnicy) (ryc. 2) o zabarwieniu niebieskoczarnym, mdławosłodkim smaku i widocznym oszronieniu. Powstaje ona na skutek krzyżowego zapylenia jedynie za pomocą trzmieli.

Ryc. 1. Kwitnąca kokoryczka wielokwiatowa.

Ryc. 2. Owocująca kokoryczka wielokwiatowa.
Znany jest również inny rodzaj rozmnażania u tej rośliny, a mianowicie rozmnażanie wegetatywne. Corocznie z kłącza wyrasta pęd nadziemny, który jesienią zamiera i pozostawia na kłączu zgrubiałą, okrągłą bliznę. Z liczby blizn można zatem określić wiek rośliny. Roślina kwitnie od maja do czerwca (17, 24).
SKŁAD CHEMICZNY
Kokoryczka wielokwiatowa jest mało poznana pod względem zawartości związków czynnych. Wiadomo, że zawiera kwas azetydyno-2-karboksylowy (w świeżych liściach oraz w ilości 6% w kłączu) (2, 7), kwas L-a,g-diaminomlekowy (DABA) (7), saponiny steroidowe, flawonoidy (flawony – pochodne apigeniny oraz flawonole – rutynę, kwercetynę), glikozydy podobne do występujących w konwalii (1), śluzy, kwas chelidonowy, skrobię, asparaginę, sole mineralne oraz lektynę (3, 11, 17, 26).
Lektyna występująca w kłączu oraz liściach kokoryczki została zidentyfikowana jako lektyna wiążąca mannozę (ang. mannose-binding lectin) – nazywana również aglutyniną Polygonatum multiflorum (PMA) – należąca do rodziny białek wiążących mannozę. PMA to tetramer złożony z czterech identycznych podjednostek o masie 14 kDa (26).
Oprócz wyżej opisanej lektyny liście kokoryczki zawierają dwie substancje należące do 2. typu białek inaktywujących rybosomy RIPs (ang. ribosome inactivating proteins). RIPs są definiowane jako roślinne glikoproteiny, które mają zdolność katalitycznej inaktywacji eukariotycznych rybosomów poprzez deadenylację rRNA. Zbudowane są z dwóch łańcuchów A i B połączonych disiarczkowym mostkiem. Łańcuch A ma aktywność N-glikozydazy, uszkadzając tym samym rRNA, natomiast łańcuch B jest pozbawiony aktywności enzymatycznej, ale zawiera domeny wiążące węglowodany. Z powodu obecności tych domen białka te uważane są za lektyny (27). Oba białka występujące w kokoryczce są N-acetylogalaktozamino-specyficzne (zarówno monomer – PMRIPm, ang. P. multiflorum RIP monomer, jak i tetramer – PMRIPt – ang. P. multiflorum RIP tetramer). Tylko PMRIPm jest dodatkowo galaktozo-specyficzne. N-acetylogalaktozamina i galaktoza są inhibitorami aglutynacji erytrocytów spowodowanej przez lektyny.
Ponadto kokoryczka wielokwiatowa zawiera w podziemnych i nadziemnych organach wegetatywnych dwie nienazwane saponiny steroidowe (saponozyd A i saponozyd B), posiadające aglikon- diosgeninę (<0,1% diosgeniny, niezależnie od okresu wegetacji oraz części morfotycznej rośliny) (6, 10, 23). Jedna z saponin to monodesmozyd spirostanolowy (saponozyd A), druga zaś to bidesmozyd furostanolowy (saponozyd B), który po hydrolizie enzymatycznej łatwo przechodzi w saponozyd spirostanolowy (ryc. 3). W obu saponozydach stwierdzono oprócz obecności diosgeniny, również glukozę, galaktozę oraz ksylozę (w monodesmozydzie wyżej wymienione węglowodany występują przy C3, zaś w bidesmozydzie dodatkowo przy C26 obecna jest glukoza) (9, 11).
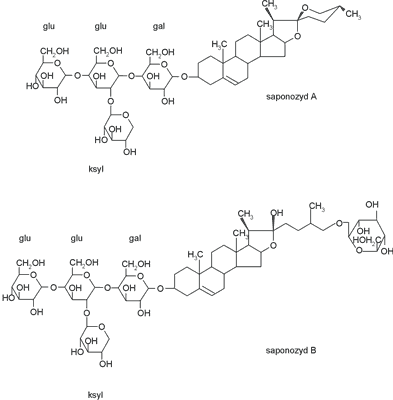
Ryc. 3. Saponozydy kokoryczki wielokwiatowej.
Diosgenina (ryc. 4) to jedna z najważniejszych z punktu widzenia farmaceutycznego sapogenin steroidowych. Jest bowiem bardzo dogodnym półproduktem (ryc. 5) do syntezy kortykosteroidów i hormonów płciowych (13). Ze wszystkich gatunków kokoryczki występujących w Polsce jedynie kokoryczka okółkowa zawiera znaczącą ilość diosgeniny, która daje możliwość zastosowania tego gatunku do produkcji hormonów steroidowych (12, 23).

Ryc. 4. Szkielety spirostanu i furostanu oraz diosgenina.
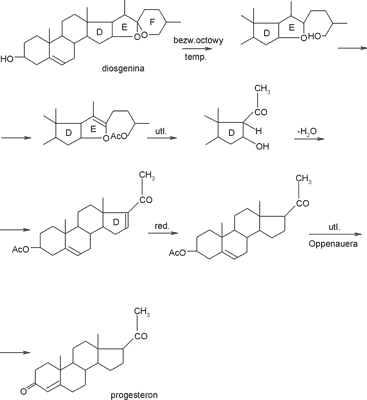
Ryc. 5. Synteza progesteronu z diosgeniny.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Bagiński S., Mowszowicz J.: Krajowe rośliny trujące. PWN, Łódź 1963. 2. Bell E.A.: „Uncommon” amino acids in plants. FEBS Lett. 1976, 64, 29. 3. Broda B., Mowszowicz J.: Przewodnik do oznaczania roślin leczniczych, trujących i użytkowych. Wyd. Lekarskie PZWL, Warszawa 1996. 4. Cai J., et al.: Apoptosis induced by dioscin in HeLa cells. Biol. Pharm. Bull. 2002, 25, 193. 5. Corbiere C., Liagre B., et al.: Induction of antiproliferative effect by diosgenin through activation of p53, release of apoptose-inducing factor (AIF) and modulation of caspase-3 activity in different human cancer cells. Cell Res. 2004, 14, 188. 6. Gruewald J., et al.: PDR for herbal medicines. Medical Economics Company, Montvale 2000. 7. Harborne J.B., et al.: Phytochemical dictionary: a handbook of bioactive compounds from plants. Taylor and Francis, London 1999. 8. Huo R., et al.: Diosgenin induces apoptosis in HeLa cells via activation of caspase pathway. Acta Pharm. Sin. 2004, 25, 1077. 9. Janeczko Z.: Ustalenie struktury component cukrowych saponozydów sterydowych z korzeni kokoryczki wielokwiatowej – Polygonatum multiflorum L. Acta Polon. Pharm. 1980, 37, 559. 10. Janeczko Z.: Badania nad saponozydami steroidowymi krajowych gatunków w rodzaju Polygonatum All. Rozprawa habilitacyjna. Kraków 1993. 11. Janeczko Z., Sendra J.: Saponozydy sterydowe w Polygonatum multiflorum L. Acta Polon. Pharm. 1979, 36, 475. 12. Janeczko Z., Sibiga A.: Saponozydy sterydowe w Polygonatum verticillatum All. Herba Polon. 1982, 28, 115. 13. Kohlmünzer S.: Farmakognozja. Wyd. Lekarskie PZWL, Warszawa 1993. 14. Kowalski J., Strzelecka H.: Encyklopedia zielarstwa i ziołolecznictwa. PWN, Warszawa 2000. 15. Li M., Han X., Yu B.: Synthesis of monomethylated dioscin derivatives and their antitumor activities. Carbohydr. Res. 2003, 338, 117. 16. Liu M.J., et al.: Diosgenin induces cell cycle arrest and apoptosis in human leukemia K562 cells with the disruption of Ca2+ homeostasis. Cancer Chemother. Pharmacol. 2004, 55, 79. 17. Mackú J., Krejča J.: Atlas roślin leczniczych. Zakł. Narod. im. Ossolińskich, Wrocław 1989. 18. Moalic S., et al.: A plant steroid, diosgenin, induces apoptosis, cell cycle arrest and COX activity in osteosarcoma cells. FEBS Lett. 2001, 506, 225. 19. Rejewski M.: Pochodzenie łacińskich nazw roślin polskich. Przewodnik botaniczny. KiW, Warszawa 1996. 20. Rutkowski L.: Klucz do oznaczania roślin naczyniowych Polski niżowej. PWN, Warszawa 1998. 21. Sarwa A.: Wielki leksykon roślin leczniczych. KiW, Warszawa 2001. 22. Szafer W., i wsp.: Rośliny polskie. PWN, Warszawa 1986. 23. Szybka-Hrynkiewicz P., Janeczko Z.: Densytometryczna analiza diosgeniny w ekstraktach z tkanki kalusowej Polygonatum verticillatum (L.) All. Biotechnologia 2004, 2, 93. 24.Traczyk T.: Rośliny lasu liściastego. Wyd. Szkolne i Pedagogiczne, Warszawa 1989. 25.Tutin T.G., et al.: Flora Europaea. Cambridge Univ. Press, Cambridge 1980. 26. Van Damme E.J., et al.: Molecular cloning of the lectin and a lectin-related protein from common Solomon´s seal ( Polygonatum multiflorum). Plant Mol. Biol. 1996, 31, 657. 27.Van Damme E.J.M., et al.: Characterization and molecular cloning of two different type 2 ribosome-inactivating proteins from the monocotyledonous plant Polygonatum multiflorum. Eur. J. Biochem. 2000, 267, 2746. 28.Volák J., Stodola J.: Rośliny lecznicze. PWRiL, Warszawa 1987. 29.Wang Z., et al.: Effects of two saponins extracted from the Polygonatum Zanlanscianense Pamp on the human leukemia (HL-60) cells. Biol. Pharm. Bull. 2001, 24, 159.





