© Borgis - Postępy Fitoterapii 4/2004, s. 183-188
Katarzyna Karłowicz-Bodalska
Żeń-szeń – wszechlek Dalekiego Wschodu
Hasco-Lek S.A. we Wrocławiu

Znany od niepamiętnych czasów korzeń reliktowej byliny wschodnio-azjatyckiej Panax Ginseng z rodz. Araliaceae, zwany powszechnie żeń-szeniem ( Rad. Ginseng) – nazwy ludowe: korzeń życia, boskie ziele, cud świata, sól ziemi, korzeń-piorun i in. – doczekał się wyjątkowego miejsca w światowym piśmiennictwie medycznym. Śmiało można powiedzieć, że jest on jednym z najobszerniej opisywanych surowców roślinnych. Roślinie tej poświęcono ponad 2 tysiące publikacji o zróżnicowanej tematyce, głównie dotyczącej badań składu chemicznego, właściwości farmakologicznych i leczniczych ekstraktów z korzenia.
W tradycyjnej medycynie Dalekiego Wschodu żeń-szeń (żeń-szeń górski lub właściwy) jest stosowany od ponad 4000 lat jako panaceum na schorzenia wszelkiego rodzaju. Zyskał on największy rozgłos wśród znanych i cenionych chińskich leków roślinnych, m.in. takich jak ziele przęśli – Ephedra sinic a (które stosowano w dychawicy oskrzelowej i dusznicy bolesnej od tysięcy lat i dopiero w 1887 r. wydzielono z tego surowca efedrynę), liście miłorzębu japońskiego ( Ginkgo biloba) – środka stosowanego w zaburzeniach krążenia mózgowego, czy działającego antyhepatotoksycznie cytryńca chińskiego ( Schizandra chinensis) i in.
Gatunki rodzaju Panax rosną na rozległych obszarach półkuli północnej. Występują na terenach Chin, od zboczy środkowych Himalajów poprzez Koreę i Japonię aż do Ameryki Północnej. Działaniem zbliżonym do żeń-szenia właściwego odznaczają się tylko nieliczne taksony. Należą do nich: Panax quinquefolium L., P. notoginseng (Burk) F.M. Chen, P. pseudoginseng Wall. subsp. himalaicus, P. japonicus C.A. Meyer oraz P. vietnamensis Ha et Grushv. Żeń-szeń właściwy ( P. ginseng C.A. Meyer) rośnie dziko w górskich lasach Półwyspu Koreańskiego, północno-wschodnich Chin, na Wyspach Japońskich i w północno-wschodniej Syberii na luźnych, dobrze uwodnionych glebach. Jest rośliną wieloletnią osiągającą wys. do 80 cm. Należy do roślin długowiecznych; – znane są egzemplarze żyjące 150-200 lat. Po upływie roku z nasienia wyrasta tylko jeden 3-palczasty liść wys. 6-8 cm; w następnych latach tworzy się rozetka złożona z 2-6 liści, przy czym trzeci liść pojawia się dopiero w 10 roku życia rośliny w naturalnych warunkach. Ze środka okółka liści wyrasta łodyga zakończona baldachem drobnych zielonkawo-białych kwiatów. Żeń-szeń kwitnie w czerwcu, owoce – jaskrawoczerwone pestkowce dojrzewają z końcem sierpnia (1-3).
Korzeń żeń-szenia jest opisywany w licznych prastarych opracowaniach medycznych, m.in. w słynnej chińskiej księdze leków „Shennong bencao”, pochodzącej z okresu dynastii Zhou ( XI w. p.n.e.). Surowcowi temu przypisywano działanie wzmacniające w stanach wyczerpania nerwowego i fizycznego, również w przedwczesnych zaburzeniach seksualnych jako aphrodisiacum. Uważany był także za magiczny środek, talizman – noszony na szyi, zapewniający jego posiadaczowi nie tylko zdrowie, lecz również powodzenie we wszelkich poczynaniach, także handlowych. Tajemniczości korzeniowi żeń-szenia dodawał fakt, że często w jego kształcie można było dopatrzeć się zarysu postaci ludzkiej (w języku chińskim dżen – człowiek i czien – korzeń), co dodatkowo zwiększało jego znaczenie i wartość.
Do Europy (Francja) surowiec został po raz pierwszy przywieziony z Syjamu, przez pracowników ambasady francuskiej, na dwór króla Ludwika XIV (Króla Słońce) jako afrodyzjak; później został rozpowszechniony przez kupców holenderskich w innych krajach europejskich (ok. 1610 r.). Cena żeń-szenia była wówczas bardzo wysoka (z początkiem XIX w. była 18-krotnie wyższa od ceny złota) (4).
Pierwszą monografię surowca, zawierającą opis właściwości biologicznych żeń-szenia (działanie przeciwdziałające zmęczeniu, które autor z dobrym skutkiem eksperymentował na samym sobie) napisał w roku 1711 jezuita Jartoux, misjonarz francuski w Chinach.
Wysoka cena korzenia żeń-szenia spowodowała, że mimo dość dużych zasobów naturalnych, na terenie Chin i Mongolii rośliny te zostały niemal całkowicie wytrzebione. Roczne zbiory w lasach Półwyspu Koreańskiego i Chin wynoszą obecnie 3-4 kg, podczas gdy w latach trzydziestych ubiegłego stulecia zbierano na terenie Chin do 500 kg, w Mongolii do 130 kg, a w Korei ok. 30 kg tego surowca.
W warunkach naturalnych żeń-szeń rozwija się wolno, wyłącznie z nasion. Nasiona kiełkują dopiero po 22 miesiącach od wysiania. Rozwój rośliny, podobnie jak przyrost korzenia na grubość, trwa kilka lat. Masa korzeni roślin ok. 5-letnich wynosi niewiele ponad 1 gram a u roślin 20-25-letnich ok. 25 g.
Szybszy rozwój roślin zaobserwowano na plantacjach. Obecnie surowiec pozyskuje się z upraw pochodzących z Korei, Chin i Japonii, gdzie masa korzeni roślin 3-letnich wynosi 6-20 g, a masa korzeni roślin sześcioletnich dochodzi do 200 g. Jest to tzw. żeń-szeń ogrodowy (yuan-shen). Na surowiec pozyskuje się korzenie z roślin 4-5-letnich, niekiedy 10-letnich. Wykopane korzenie poddaje się stabilizacji (w celu unieczynnienia enzymów) przez suszenie na słońcu (korzeń biały), obróbce parowej (korzeń czerwony) lub na drodze wymrażania na sucho. Liczne próby hodowli żeń-szenia w Europie nie powiodły się, ze względu na szczególne wymagania edaficzne rośliny (glebowe i klimatyczne). Ostatnio, ze względu na duże zapotrzebowanie na surowiec, prowadzi się kultury tkankowe in vitro (hodowlę biomasy, zwłaszcza w Japonii), przy stałym doskonaleniu metod biotechnologicznych. Metoda ta stanowi poważną alternatywę dla upraw polowych, uzależnionych od niekorzystnych i zmiennych warunków klimatycznych.
Interesujące właściwości biologiczne żeń-szenia spowodowały szerokie zainteresowanie fitochemików składem chemicznym przede wszystkim surowca, lecz również całej rośliny. Największa ilość publikacji ukazała się w drugiej połowie ubiegłego stulecia.
Stwierdzono, że korzeń żeń-szenia zawiera liczne grupy związków naturalnych, wśród których na czołowym miejscu znajdują się saponiny i węglowodany (oligo- i polisacharydy). Obie grupy związków wykazują zbliżone działanie biologiczne i są odpowiedzialne za właściwości terapeutyczne surowca. Surowiec zawiera ponadto związki flawonoidowe, fenolokwasy (wanilinowy, salicylowy), peptydoglikany (panaksany), związki acetylenowe i inne.
Większość prac fitochemicznych dotyczy badania chemizmu saponozydów, nazwanych ginzenozydami, którym przypisuje się szczególną rolę w działaniu leczniczym żeń-szenia. Są to związki o charakterze glikozydów triterpenowych, z których większość (ponad 30) stanowią pochodne układu damaranu. Jak dotąd tylko jeden związek zidentyfikowano jako pochodną oleananu (ginzenozyd Ro).
Ginzenozydy pochodne damaranu wywodzą się z dwóch aglikonów: 20 (S) – protopanaksadiolu i 20 (S) – protopanaksatriolu. Do pierwszej grupy zalicza się m.in. ginzenozydy Ra1-3, Rb1-3, Rc, Rd i Rh2. Do grupy pochodnych protopanaksatriolu należą saponozydy Re i Rf, Rg1-2, Rh1.W największych ilościach występują w surowcu 3 związki: ginzenozydy: Rb1-2 i Rg1 (5) (wzory) (ryc. 1).
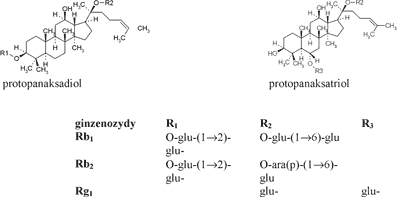
Ryc. 1. Wzory podstawowych ginzenozydów
Zawartość sumy saponin w korzeniu 6-letnim waha się w szerokich granicach i wynosi od 0,7 do 3% (ESCOP, 2003).
Spośród wielu właściwości leczniczych przypisywanych żeń-szeniowi jedynie kilka zostało potwierdzonych badaniami. Należy tu wymienić przede wszystkim działanie wzmacniające ( tonicum) w okresach długotrwałych i nadmiernych wysiłków fizycznych i psychicznych oraz działanie adaptogenne, wzmagające rezystencję, czyli oporność na stres, infekcje oraz niesprzyjające warunki różnego rodzaju, powodujące obniżenie odporności organizmu, co prowadzi do wystąpienia zmian patologicznych. Badania sugerują, że powyższe działanie warunkują ginzenozydy, które biorą udział w reakcjach przemian hormonalnych, regulujących odpowiedź organizmu na stres (6).
Najszerzej klinicznie przebadaną saponiną z grupy pochodnych protopanaksadiolu jest ginzenozyd Rb1. Wykazuje on depresyjny wpływ na ośrodkowy układ nerwowy (działanie antypsychotyczne, przeciwdrgawkowe, analgetyczne oraz przeciwgorączkowe). Mechanizm jego działania nie jest ostatecznie poznany, lecz przeprowadzone badania sugerują regulujący wpływ tego związku na metabolizm acetylocholiny w OUN. Podany doustnie ginzenozyd Rb1 wzmaga pasaż jelitowy oraz przeciwdziała tworzeniu się wrzodów żołądka i dwunastnicy indukowanemu przez stres. Ginzenozydy Rb1 oraz Rg1 są aktywnymi nootropowymi składnikami surowca, które polepszają pamięć oraz zdolność uczenia się zarówno u zwierząt normalnych jak i zwierząt z zaburzoną zdolnością poznawania (7).
Spośród saponozydów grupy protopanaksatriolu najlepiej zbadanym pod względem właściwości terapeutycznych jest ginzenozyd Rg1, który w przeciwieństwie do ginzenozydu Rb1, stymuluje ośrodkowy układ nerwowy, wzmaga aktywność ruchową organizmu oraz zwiększa jego wydolność fizyczną. Wykazuje również działanie immunomodulujące. Stwierdzono, że pochodne protopanaksatriolu silniej blokują kanały wapniowe niż pochodne protopanaksadiolu oraz działają, podobnie jak saponiny, hemolizująco na krwinki czerwone, w przeciwieństwie do grupy związków pochodnych protopanaksadiolu, które działają antyhemolitycznie (cyt. wg 1).
Ginzenozydy okazały się silnymi stymulatorami układu przysadkowo-nadnerczowego. Podane dootrzewnowo powodowały w krótkim czasie wzrost poziomu ACTH i kortykosteronu w osoczu. Mechanizm tego działania nie jest znany.
Żeń-szeń obniża poziom cholesterolu we krwi, powoduje wzrost frakcji HDL lipoprotein, działa przeciwzakrzepowo na płytki krwi oraz obniża poziom cukru we krwi, co wg niektórych autorów, może stanowić uzasadnienie do stosowania preparatów z surowca jako środka wspomagającego w leczeniu cukrzycy. Przez oddziaływanie na gruczoł nadnerczowy preparaty z surowca mogą bowiem mieć znaczenie jako czynnik regulujący produkcję insuliny (8). Zaobserwowano korzystny wpływ preparatów z korzeni żeń-szenia w badaniach klinicznych pacjentów cukrzycowych insulinozależnych i niezależnych. Przyjmowanie doustne tabletek 200 mg dz. w ciągu 8 tygodni przez pacjentów insulinowo niezależnych znacznie polepszyło ich nastrój, czynności fizyczne oraz spowodowało obniżenie poziomu glukozy w krwi (9).
Preparaty z żeń-szenia (ekstrakt G115) podawane dootrzewnowo wydłużały czas tolerancji na morfinę i niwelowały uzależnienie psychiczne na ten narkotyk, nie znosząc jego działania przeciwbólowego (10).
Przyjmowanie żeń-szenia obniża również szkody poalkoholowe organizmu. W eksperymentach na zwierzętach stwierdzono, że żeń-szeń wzmagał utlenianie alkoholu w wątrobie oraz stymulował proces regeneracji hepatocytów.
Napromieniowane promieniami X myszy, otrzymujące wyciąg z żeń-szenia przed i podczas przeprowadzania eksperymentu, wykazały mniej zmian zarówno funkcyjnych jak i anatomicznych w narządach wewnętrznych, niż zwierzęta grupy kontrolnej, nieotrzymujące tego preparatu. Badania serologiczne wykazały w obu grupach znaczące obniżenie poziomu gamma-globulin, albumin i immunoglobuliny G w osoczu. W grupie kontrolnej zmiany struktury białek były tak rozległe, że zwierzęta zostały praktycznie zupełnie pozbawione odporności, w przeciwieństwie do zwierząt otrzymujących w karmie żeń-szeń przed i po napromieniowaniu. Zwierzęta te w krótkim czasie odbudowywały barierę odpornościową, porównywalną do występującej u myszy niepoddawanych napromieniowaniu (11).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. ESCOP Monographs, Second Edition (2003). 2.Hagers Handbuch d.pharm. Praxis; 5 th ed. Vol.6; Berlin-Springer Vrl. (1994):12-34. 3.WHO monographs on selected medicinal plants: Rad. Ginseng; (1999): 168 –182). 4.Camponovo F, Hostettmann K: Préparations ŕ base de Panax ginseng; Journal suisse de pharmacie (1999) 137 /16/: 524-529. 5.Wang X, Sakuma T i in.: Determination of ginsenosides in plant extracts from Panax ginseng and Panax quinquefolius L. by LC/MS/MS; Anal Chem (1999) 71 /8/: 1579-84. 6.Hiai S i in.: Stimulation of pituitary-adrenocotrical system by Ginseng saponin; Endocrinol Jpn (1979) 26 /6/: 661-65. 7.Liu CX, Xiao PG: Recent advances in ginseng research in China; J Ethnopharmacol (1992) 36: 27- 38. 8.Ng TB i in.: Hypoglycemic constituents of Panax Ginseng; Gen Pharmacol (1985) 16 /6/: 549-52. 9.Sotaniemi EA, Haapakoski E, Rautio A: Ginseng therapy in non-insulin-dependent diabetic patients; Diabetes care (1995) 18: 1373-1375. 10.Takahashi M, Tokuyama S, Kaneto H: Antistress effect of ginseng on the inhibition of the development of morphine tolerance in stressed mice. Jpn J Pharmacol (1992) 53 /3/: 399-404; CA (1992) 117: 163738v. 11.Michinori Kubo, Tong Chung-ning, Hideaki Matsuda: Influence of the 70% methanolic extract from red ginseng on the lysosome of tumor cells and on the cytocidal effect of mitomycin C; Planta Med (1992) 58: 389- 448. 12.Scaglione F i in.: Immunomodulatory effects of two extracts of Panax ginseng C.A.Meyer, Drugs, experimental and clinical research (1990) 26: 537-542. 13.Vogler BK,Pittler MH, Ernst E: The efficacy of ginseng. A systematic review of randomised, clinical trials; Eur J Clin Pharmacol (1999) 55: 567-75. 14.Qi-pin Gao, Hiroaki Kiyohara i in.: Chemical properties and anti-complementary activities of polysaccharide fractions from roots and leaves of Panax ginseng; Planta Med (1989) 55: 9-12. 15.Belogortseva NI, Yoon JY, Kim KH: Inhibition of Helicobacter pylori hemmaglutination by polysaccharide fractions from roots of Panax ginseng; Planta Med (2000) 66: 217-220; 16.Cui JF, Garle M i in.: Determination of aglycones of ginsenosides in ginseng preparations sold in Sweden and in urine samples from Swedish athletes consuming ginseng; Scand J Clin Lab Invest (1996) 56: 151-160. 17.Podlewski J, Chwalibogowska-Podlewska A: Leki Współczesnej Terapii (PANAX); wyd. XVI (2003): 823-24.

