© Borgis - Postępy Fitoterapii 1-2/2005, s. 53-57
Michał Gajewski1, Elżbieta Kamińska2, Szymon Szczepanik3, Łukasz Wysocki3, Sławomir Maśliński1,3
Czy zakłóceniami przepływu energii możemy opisać główne zjawiska patologii?
1Zakład Biochemii Instytutu Reumatologicznego w Warszawie
2Zakład Patofizjologii i Immunologii Instytutu Reumatologicznego w Warszawie
3Zakład i Katedra Patologii Ogólnej i Doświadczalnej Akademii Medycznej w Warszawie

NORMA FIZJOLOGICZNA
Założeniem wykładu było przeanalizowanie relacji zachodzących pomiędzy różnymi stanami patologicznymi, a narastającymi zaburzeniami przepływu energii w organizmie. Wykład ograniczono, w kontekście zakłóconego transferu energii, do opisania roli tlenu.
Kompleks enzymatyczny wytwarzający energię (znajdujący się w mitochondriach, które mogą zajmować nawet do 40% objętości komórek) nie jest w 100% sprawny. Około 3% tlenu w komórkach serca i do 10% tlenu w komórkach płucnych, nie dociera do końcowego enzymu redukującego tlen do wody (oksydaza cytochromowa), lecz w formie wolnych rodników tlenowych (WRT) przedostaje się przez błony mitochondriów. Przeciętna komórka ciała człowieka konsumuje dziennie 1013 atomów tlenu, tak więc wytworzy się w niej 1011-12 rodników tlenowych. W objętości 1 cm3 zmieści się 109 komórek przeciętnej wielkości, WRT wytworzy się zatem dziennie 1020-21, co odpowiada ilości WRT w wypalonych 104-5 papierosów.
Proces unieszkodliwiania toksycznych pochodnych tlenu jest absolutnie niezbędny dla przeżycia wszystkich organizmów żyjących w atmosferze 21% tlenu. Średni okres życia wszystkich przebadanych dotąd gatunków małp był ściśle uzależniony od średniej aktywności ich enzymów detoksykujących WRT. Już w roku 1928 Rubner zauważył, że wszystkie przebadane dotąd gatunki ssaków nienależących do naczelnych zużywają około 200±25 kcal na gram tkanki w ciągu całego swego życia. Rubner wykazał, że chociaż krowa, koń, kot, pies, czy świnka morska, różnią się prawie 5-krotnie średnią długością życia, to ich potencjał metaboliczny, czyli ilość energii zużywanej na gram tkanki ciała, a liczony w czasie całego życia, był właściwie identyczny. Różne filogenetyczne grupy mają różny potencjał metaboliczny. I tak, na przykład muchy mają potencjał wielkości 25 kcal, nienaczelne ssaki 200, ludzie 800, a ptaki 1000-1500 kcal.
Najogólniej rzecz ujmując, większe, dłużej żyjące zwierzęta, zużywają mniej kalorii na gram tkanki w danej jednostce czasowej, aniżeli mniejsze, krócej żyjące. Tak więc l gram przeciętnej tkanki ryjówki zużywa dziennie tyle samo kalorii, ile 1 gram porównywalnej tkanki słonia na miesiąc. Pearl podsumował to krótko: „generalnie czas trwania życia zmienia się odwrotnie proporcjonalnie do szybkości wydatkowania energii”. Nazwano to „teorią szybkości życia”. Pomimo znacznych różnic tempa metabolizmu tlenowego, a co za tym idzie różnej długości życia, wykazano, że każdemu gatunkowi „przysługiwało około miliarda uderzeń serca”. We wszystkich omawianych przypadkach tempo wytwarzania WRT przez mitochondria było proporcjonalne do tempa metabolizmu i odwrotnie proporcjonalne do średniej długości życia danego gatunku.
DNA w każdej komórce szczura (szybki metabolizm) jest uszkadzane dziennie na skutek metabolizmu oksydacyjnego w 100 tys. miejsc (trwałych uszkodzeń jest 1 milion), DNA człowieka natomiast (wolny metabolizm), w 10 tys. miejsc (trwałych uszkodzeń jest 100 tys.). Człowiek dożyć może więc 120 lat, szczur natomiast tylko do lat 2. WRT uszkadzają również błony komórkowe poprzez peroksydację lipidów (LPO). LPO jest procesem lawinowej reakcji łańcuchowej, tzn. jedna nieprawidłowa cząsteczka w połączeniu z prawidłową daje dwie nieprawidłowe cząsteczki. Natychmiast po śmierci człowieka, wówczas gdy następuje zahamowanie wytwarzania zmiataczy WRT, dochodzi do przerwania ich blokady i masywnej LPO. Przez kilka dni po śmierci, ciało „zasysa”, przez skórę, z otoczenia tlen z intensywnością znacznie większą aniżeli podczas normalnego oddychania za życia organizmu. Śmierć, na poziomie molekularnym, wynika z gwałtownie nasilającego się i nieodwracalnego już procesu LPO.
Natężenie stresu oksydacyjnego jest odwrotnie proporcjonalne do długości życia. Opisany w roku 1998 roku gen zwany „methuselah” wydłuża życie jego posiadacza o 35%. Niedawno odkryto kolejny „gen długiego życia”, którego mutacja u muszki owocowej, wydłuża życie dwukrotnie. Obie mutacje polegają na spowolnieniu tempa metabolizmu. Komórki takie wymagają więc mniejszej ilości energii. Gen długowieczności otrzymał nazwę Indy („I am not dead yet”). Mutacja tego genu spowalnia transport składników odżywczych z komórek i do komórek organizmu, a zatem ogranicza przemianę materii. Zmutowane nicienie, o ograniczonej przemianie materii (bezpłodne i o przytępionych zmysłach – ślepota), żyją nawet sześcio- czy ośmiokrotnie dłużej. Przywrócenie tym organizmom zdolności do widzenia, czy rozmnażania się, natychmiast (i proporcjonalnie) skraca średni czas ich życia.
Można założyć, że gdyby szczurom żyjącym dwa lata spowolnić metabolizm do tempa metabolizmu ludzkiego (80-120 lat), ich życie mogłoby się wydłużyć przynajmniej o rząd wielkości, czyli nawet do 20 lat. Analogicznie spowolnienie tempa metabolizmu u człowieka wydłużyłoby jego życie do 1000 lat. Powszechnie dzisiaj akceptowana teoria starzenia się Harmana wyznacza granicę wieku człowieka na 120 lat. Pierwszym, znanym źródłem podającym tę granicę jest Księga Rodzaju (Rdz. 6.3) (ryc. 1). Następuje to jednak nie od razu, lecz po 22 pokoleniach ciągłego spadku, tak długości życia, jak i wieku płodzenia potomstwa. Obie wartości są wyjściowo bardzo wysokie. Można założyć, że wydłużenie życia mężczyzn nie wpłynęłoby na ich płodność, całe życie produkują oni bowiem plemniki. Cytowane źródło nie porusza natomiast problemu kobiet. O fakcie urodzenia syna przez 90-letnią Sarę, w Księdze Rodzaju wspomina się jak o ewenemencie (Rdz. 17.17). Wiadomo, że kobiety posiadają ukształtowane komórki jajowe już w wieku płodowym, więc nie mogłyby rodzić dzieci w tak ekstremalnie długim życiu. Brak danych o długo żyjących kobietach, rodzących dzieci w późnej starości, świadczyć może o wiarygodności przekazu. Krzywa jest ponadto bardzo „nowoczesna”, z nieoczekiwanymi spadkami i wzrostami, typowymi dla wszelkich pomiarów, dokonywanych przez naukę właściwie dopiero od epoki Oświecenia. Przed XVIII wiekiem nie wiedziano, że stałemu spadkowi jakiejś wartości, towarzyszą chwilowe ich wzrosty, i odwrotnie. Dlatego można założyć, iż zbyt wcześnie uznano zawarte w Księdze Rodzaju informacje jedynie za mityczno-etnograficzną ciekawostkę.
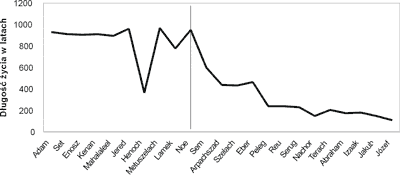
Ryc. 1. Dane dotyczące długości życia pokoleń biblijnych patriarchów (wg. Księgi Rodzaju). Podłużna linia na środku wykresu wyznacza granicę zdarzenia opisanego jako „potop”.
Organizmy oddychające tlenowo muszą ograniczać tempo metabolizmu tlenowego (a co za tym idzie stres oksydacyjny), jednak w pewnych sytuacjach muszą go generować (walka z patogenami). W całym Królestwie Zwierząt pierwszą i najważniejszą linią obrony są neutrofile. Są to komórki bardzo aktywne i nietrwałe, dziennie następuje 4-krotna wymiana całej ich puli, a prawie 60% masy szpiku kostnego (ważącego u dorosłego człowieka 2-3 kg) przeznaczone jest dla ich produkcji. Całkowity zanik aktywności neutrofilów oznacza śmierć organizmu na skutek zakażeń w ciągu zaledwie kilku dni. Aktywność neutrofilów polega, paradoksalnie, na miejscowym nasilaniu stresu oksydacyjnego. W przeciwieństwie do przeciętnych komórek tkanki, w których 5% tlenu ucieka w postaci WRT, a pozostałe 95% w normalnych procesach metabolizmu komórkowego, w neutrofilach sytuacja wydaje się odwrotna. Są one komórkami beztlenowymi, nieposiadającymi prawie mitochondriów, a proces powstawania WRT zachodzi w ich błonie komórkowej. Znajduje się w niej kompleks enzymatyczny, tak zwanej NADPH oksydazy, który z 95% pobieranego tlenu celowo wytwarza WRT.
OSTRY STRES OKSYDACYJNY
Neutrofile nie są jedynymi strukturami w organizmie biorącymi udział w celowym, miejscowym nasilaniu stresu oksydacyjnego. WRT wydzielane przez neutrofile są dalej przekształcane przez przeciwciała w trójatomową formę tlenu – ozon, silną substancję bakteriobójczą. Obecność ozonu wykazano w blaszkach miażdżycowych, jak się okazało jedynie utleniony przez ozon cholesterol jest fagocytowany przez makrofagi, tworzące w ten sposób blaszkę miażdżycową. Jeżeli występujący pod blaszką miażdżycową stres oksydacyjny jest wystarczająco silny, następuje jej oderwanie, zatkanie naczyń krwionośnych i niedotlenienie. Na obszarze niedotlenionym następuje zachwianie równowagi – tlen (zmniejszony już poziom):elektrony (niezmniejszony poziom). Dochodzi do masywnego łączenia się elektronów z pozostałym jeszcze tlenem, w efekcie czego nasila się produkcja WRT. Zmniejszenie o 40% tlenu w tkankach niedotlenionych powoduje wzrost powstawania WRT o 40%, a tym samym znaczne nasilenie stresu oksydacyjnego. Już po kilku sekundach niedotlenienia dochodzi do obniżenia aktywności oksydazy cytochromowej, której towarzyszy równoczesny wzrost jednoelektronowych redukcji z wytworzeniem WRT, co przypomina przyspieszony proces starzenia się.
Podczas reperfuzji (napływ normalnie utlenowanej krwi) stwierdza się nieoczekiwane dalsze zwiększenie stresu oksydacyjnego. Jest to najniebezpieczniejszy moment niedotlenienia powodujący najsilniejsze uszkodzenia tkanek. Zjawisko to zostało nazwane „paradoksem tlenowym”, którego mechanizm polega na tym, iż znaczna ilość napływającego tlenu zostaje przekształcona w WRT. Odpowiedzialna jest za to oksydaza ksantynowa powstająca w warunkach patologicznych z dehydrogenazy ksantynowej. W modelach doświadczalnych wykazano, że stosując allopurinol (będący inhibitorem oksydazy ksantynowej) ograniczyć można obszar martwicy o 60%. Dalsze ograniczenie martwicy serca obniżyć można stosując podczas reperfuzji krew o podwojonej ilości erytrocytów, zawierających duże ilości enzymów inaktywujących WRT.
Dopiero od roku 1983 wiadomo, że odczyn zapalny, towarzyszący niedotlenieniu, nie jest zjawiskiem późnym. Wykazano, że już po 45 minutach niedotlenienia serca mamy do czynienia z silnym, destrukcyjnym odczynem zapalnym. Neutropenia (znaczne obniżenie liczby neutrofilów) ograniczyła martwicę niedotlenionego serca u psów o prawie 43%. W tkankach dotkniętych niedotlenieniem neutrofile powodują poważne uszkodzenia, wydzielając duże ilości WRT. Ten pozorny paradoks wyjaśnić może fakt, iż neutrofile są komórkami niezwykle sprawnymi w wychwytywaniu tlenu i przekształcaniu ich w WRT. Badania in vitro wykazały, że 100-krotne obniżenie poziomu tlenu powodowało tylko dwukrotne obniżenie poziomu WRT, produkowanych przez neutrofile. Nawet jeśli, w warunkach doświadczalnych, stężenie tlenu wynosiło zero, produkcja WRT przez neutrofile wynosiła 10% wartości maksymalnej.
PRZEWLEKŁY STRES OKSYDACYJNY
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł

