© Borgis - Postępy Fitoterapii 1/2008, s. 2-14
*Tadeusz Wolski, Tomasz Baj, Agnieszka Ludwiczuk, Kazimierz Głowniak, Gabriela Czarnecka
Rodzaj Rhodiola – systematyka, skład chemiczny, działanie i zastosowanie oraz analiza fitochemiczna korzeni dwu gatunków różeńca: Rhodiola rosea L. oraz Rhodiola quadrifida (Pall.) Fish et Mey
RHODIOLA GENUS – TAXONOMY, CHEMICAL COMPOSITION, ACTIVITY AND USE ALSO PHYOCHEMICAL ANALYSIS OF ROOTS OF TWO SPECIES OF RHODIOLA: RHODIOLA ROSEA L. AND RHODIOLA QUADRIFIDA (PALL.) FISH ET MEY
Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, Uniwersytet Medyczny, Lublin
Kierownik Katedry i Zakładu: prof. dr hab. Kazimierz Głowniak
Summary
The taxonomy of Rhodiola genus was described in this research (work). That the genus consists from over 200 different species. Furthermore chemical composition, effectiveness and application of species of Rhodiola genus were introduced with particular allowance of Rhodiola rosea species. Pharmacological active substances responsible for advantages of that plant are poliphenolic compounds: phenylpropanoids, flavonoids, anthocyanins and tannins The most known are: rosine, rosavine, rhodioline, salidroside and p-thyrosol. The biological compounds occurring in Rhodiola rosea reveal multidirectional pharmaceutical activity: anti-stress, anti-dejection, they have good influence on heart muscle, and also act as anticancer, immunostimulant and antioxidant. In the next part of this research phytochemical assay two species Rhodiola: R. rosea and R. quadrifida was introduced. The subject of analysis were three group of substances: phenolic acids, flavonoids and anthocyanins selection of optimal extraction method, pointing out proper suitable concentration of dissolvent and temperature which provide the highest consist of analyzed group of compounds. The assay was carried out by reflux extraction method (KOS), accelerated solvent extraction (ASE), and ultrasound-assisted extraction (UAE).The comparison method of extraction showed that the ASE metod, carried out with 100% methanol for phenolic acids and flavonoids in temperature 100°C, and in 80°C, for anthocyanins distinguishes the best efficiency. In proportion contents of sum of flavonoids in roots of R.rosea was 4.33%, whereas in roots of R. quadrifida was 1.18%. In proportion contents of sum of phenolic acids in roots of R. quadrifida – was little higher and was 1.67%, and in R. rosea – 1.25%. Indication of proportionally content anthocyanins in roots of R. quadrifida, analyzed by method with different pH (Method 2) gave value 16.65%, and in R. rosea 4.92%. The results obtained by spectroscopic method (Method 1) were much lower: 7.84% for R. quadrifida and 0.5%. for R. rosea.

Rodzaj Rhodiola należy do rodziny Crassulacae (Gruboszowate), jest szeroko rozpowszechniony w zimnych regionach półkuli wschodniej. Nazwa gatunku pochodzi od greckiego słowa „rodia” lub „rodion”, które jest związane z charakterystycznym różanym zapachem kłączy Rhodiola. Na podstawie cech morfologicznych rodzaju Rhodiola wyodrębniono trzy sekcje, a także nowe gatunki (1, 7). Wzmianki o leczniczych właściwościach różeńca górskiego ( Rhodiola rosea), odnalezione w Tybecie, pochodzą sprzed 1200 lat (2). Różeniec górski znany jest powszechnie jako „golden root” – „złoty korzeń” i „arctic root” (3). Nazwę „złoty korzeń” roślina zawdzięcza osobliwej, metalicznej barwie korzenia, którą można porównać z blaskiem szlachetnego metalu (4). Występuje on na terenach północnej Azji, górskich regionach Europy oraz subarktycznych rejonach Ameryki Północnej (5, 6). W Polsce występowanie ograniczone jest do terenów górskich (Sudety, Tatry, Karpaty) (8). Typowymi siedliskami różeńca są: skaliste murawy i piargi. Roślina preferuje wilgotne obszary na stokach, klifach oraz skałach ubogich w substancje organiczne (7-8).
Surowiec ten stosowano m.in. w przewlekłym zmęczeniu, jako środek mobilizujący do poprawy wydajności pracy (9-10). Różeniec górski od wieków stosowany był w tradycyjnej medycynie Rosji, Skandynawii i innych krajów. Między rokiem 1725 a 1960 pojawiło się wiele medycznych danych na temat Rhodiola rosea w naukowej literaturze Szwecji, Norwegii, Rosji, Francji oraz Islandii. (10). Surowiec ten przez blisko 30 lat znajdował się w wykazie roślin Farmakopei Rosyjskiej (11).
Index Kevensis z 1885 r. (12) wymienia 15 gatunków z rodzaju Rhodiola,w tym najpopularniejsze stosowane w farmakoterapii, to jest Rhodiola rosea, R. quadrifida oraz R. kirilowii. Jednak szczegółowa systematyka rodzaju podlega ciągłym dyskusjom. Po dzień dzisiejszy naukowcom nie udało się zająć jednoznacznego stanowiska w tej kwestii. Według niektórych taksonomistów rodzaj ten można traktować jako samodzielną jednostkę, według innych jest sekcją rodzaju Sedum. Nowsze dane podają, że rodzaj Rhodiola obejmuje około 90 gatunków (7). Ponad 70 z nich występuje na terenie Chin, gównie na Qinghai-Tibet Platean na wysokości 1000-5600 m n.p.m. (13, 14). W piśmiennictwie istnieją też doniesienia wskazujące na obecność ponad 200 różnych gatunków tej rośliny (15-17).
Dla przybliżenia charakterystyki obu badanych surowców ich budowę morfologiczną podano poniżej.
Różeniec górski jest byliną alpejsko-arktyczną o znacznym zasięgu i dużej zmienności morfologicznej kształtów i zabarwienia pędów (od sinozielonego do czerwonego) (5). Ma on silnie rozrastające się poziome kłącze z licznymi korzeniami. Pędy płonne i kwiatonośne są nagie, wysokie do 40 cm, wznoszące się łukowato, gęsto ulistnione. Liście mają kształty podługowate do jajowatych. Są one mięsiste, płaskie, siedzące, o nasadzie klinowatej lub sercowatej, na szczycie zwykle zaostrzone, całobrzegie lub szpilkowane. Kwiaty różeńca górskiego są zwykle czterokrotne, zebrane w zbite, szczytowe podbaldachy. Kwiaty męskie o płatkach podługowatych, barwy żółtej, często różowo nabiegłej, wykształcają 8 pręcików i zwykle 4 zmarniałe słupki. Kwiaty żeńskie o płatkach bardzo małych, lub bez nich, mają 4 rozwinięte słupki i zmarniałe pręciki. Rośliny kwitną od czerwca do lipca, a owocują jesienią. Owocem są 4 zielone mieszki, zrośnięte u nasady, o krótkich szyjkach odchylonych na zewnątrz (7, 8).
Rhodiola quadrifida występuje także pod nazwą Sedum quadrifidum Pallas, Chamaerhodiola quadrifida (Pallas) Nakai. Jest wieloletnią rośliną zielną, dorastającą do 25-30 cm wysokości. Spotykana jest w regionach alpejskich, porasta kamienne zbocza, górskie rumowiska oraz kamieniste i żwirowate brzegi strumyków. Występuje na obszarze Chin, a dokładnie w regionie Xinjiang oraz na sąsiadujących z nim obszarach Mongolii, Kazachstanu i Rosji (18).
Skład chemiczny związków występujących w rodzaju Rhodiola
Wyniki badań naukowych i klinicznych wykazały, że najważniejszymi chemicznymi substancjami farmakologicznie czynnymi, odpowiedzialnymi za korzystne właściwości R. rosea, są związki polifenolowe, tj. fenylopropanoidy, flawonoidy, proantocyjanidyny i taniny. Do najbardziej znanych należą m.in. rozawina, rozyna, rodiolina oraz salidrozyd wraz z aglikonem p-tyrozolem. Według niektórych badaczy z blisko 200 poznanych gatunków Rhodiola sp., tylko różeniec górski zawiera wraz z salidrozydem również rozawinę i jej pochodne fitozwiązki – rozynę i rozarynę (15, 17, 19).
Czynne związki R. rosea wykazują cenne działanie przeciwstresowe i przeciwdepresyjne. Są to właściwości szczególnie doceniane obecnie, ponieważ, jak podaje Sedlac-Vadoc (2004), ok. 80% chorób ma swoje podłoże stresogenne (19). Poza tym surowiec ten i jego przetwory wpływają korzystnie na mięsień sercowy, działają przeciwnowotworowo, immunostymulująco, przeciwutleniająco na poziomie komórkowym, zwiększają funkcje intelektualne, wzmagają wydolność organizmu oraz chronią wątrobę przed działaniem toksyn (17).
Poniżej zostały opisane poszczególne grupy związków występujących w gatunkach rodzaju Rhodiola.
Fenylopropanoidy
Fenylopropanoidy są estrami kwasu cynamonowego z cukrami. Zawierają one w cząsteczce jedną, bądź dwie reszty cukrowe. Jest to grupa substancji biologicznie czynnych, charakterystyczna wyłącznie dla gatunku różeńca górskiego. Nie stwierdzono jej obecności w żadnym innym gatunku tego rodzaju (5, 16). Fenylopropanoidy stanowią jedną z najważniejszych grup chemicznych, odpowiadają bowiem za główną aktywność farmakologiczną różeńca górskiego. Wpływają szczególnie na zwiększenie sprawności fizycznej i umysłowej, a także na wzrost wydajności pracy. Podwyższając poziom serotoniny w mózgu, zmniejszają objawy depresji. Wykazują cenne działanie adaptogenne, kardioochronne, przeciwutleniające, antymito-tyczne, cytotoksyczne i przeciwbakteryjne (5). Do fenylopropanoidów należą związki potocznie zwane „rozawinami”, a wśród nich rozawina, rozyna i rozaryna (ryc. 1).
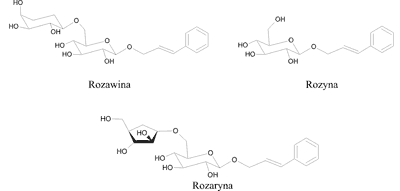
Ryc. 1. Struktury chemiczne fenylopropanoidów, występujących w Rhodiola rosea (7).
Pochodne fenyloetanolu
Pochodne fenyloetanolu stanowią kolejną istotną grupę związków fenolowych. Razem z fenylopropanoidami warunkują działanie terapeutyczne R. rosea.
Ich występowanie we wszystkich, przebadanych do tej pory gatunkach Rhodiola, zostało potwierdzone naukowo (16, 20). Należą tu: p-tyrozol, występujący w formie aglikonu, jego glikozyd – salidrozyd, wiridozyd oraz glikozyd charakterystyczny dla R. heterodonta – heterodontozyd (21) (ryc. 2). Salidrozyd jest charakterystyczny także dla innych gatunków spoza rodzaju Rhodiola,z wyjątkiem R. semenovii, w którym nie stwierdzono tej substancji. Salidrozyd jest charakterystyczny również dla innych gatunków spoza rodzaju Rhodiola, z wyjątkiem R. semenovii, w którym nie stwierdzono tej substancji (21).
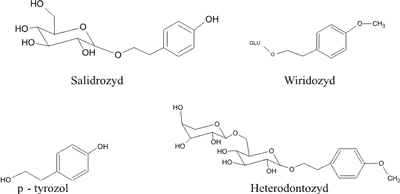
Ryc. 2. Struktury chemiczne pochodnych fenyloetanolu występujących w gatunkach Rhodiola (7, 21).
Pochodne fenyloetanolu wykazują wielokierunko-we działanie farmakologiczne: przeciw zmęczeniu, przeciw toksycznemu działaniu związków chemicznych, chronią przed promieniowaniem, działają przeciwnowotworowo, spowalniają proces starzenia oraz mają silne działanie przeciwutleniające (13).
Flawonoidy
Flawonoidy są szeroko rozpowszechnioną grupą związków obecną w rodzaju Rhodiola. Jak podaje piśmiennictwo (22, 23), w tym rodzaju najczęściej występuje kemferol. Petsalo i wsp. (24) wymieniają w R. rosea także herbacetynę i gossypetynę. Wzory strukturalne przedstawia rycina 3.
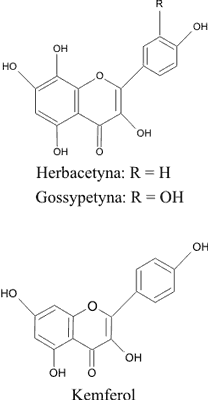
Ryc. 3. Wzory strukturalne flawonoidów występujących w gatunkach Rhodiola.
Flawonoidy przedstawione na rycinie 4 zaliczane są do grupy flawonów, mogą występować w formie aglikonów i są charakterystyczne dla następujących gatunków: R. rosea, R. crenulata, R. imbricata, R. quadrifida, R sachalinensis (22, 25-27).
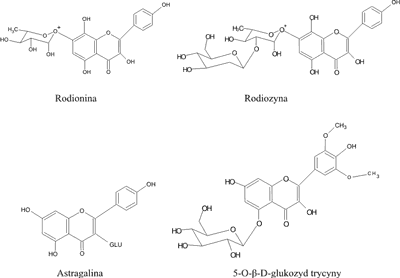
Ryc. 4. Struktury chemiczne flawonoidów występujących w postaci połączeń glikozydowych w rodzaju Rhodiola.
Wyżej wymienione flawonoidy występują również w postaci połączeń glikozydowych:
– glikozyd kemferolu występujący pod nazwą krenulozyd, charakterystyczny jest dla R. crenulata (25);
– oligoglikozydy – rodioflawonozyd {gossypetyn-7-O-β-D-glukopiranozyl-(1-3)-α-L-ramnopiranoza} i rodiooctanozyd obecne są w R. quadrifida (27);
– kemferol-7-O-α-L-ramnopiranozyd i 7-O-ramnozyd gossypetyny występują w R. rosea (24, 28);
– rodionina (7-ramnozyd herbacetyny), rodionidyna, rodiolgina, rodiolgidyna, rodalina, rodalidyna, rodiozyna (glikozyd herbacetyny), acetylorodalgina, astragalina obecne są w R. rosea, R. crenulata (5, 7, 10, 24, 29-30);
– trycyna oraz jej glikozydy: 7-O-β-D-glukopiranozyd trycyny, 5-O-β-D-glukopiranozyd trycyny charakterystyczne są dla R. rosea i R. quadrifida (7, 27).
Wzory niektórych połączeń glikozydowych flawonoli przedstawia rycina 4.
W rodzaju Rhodiola występuje także flawonoid będący przedstawicielem grupy flawonolignanów (połączeń flawonoidu z fenylopropanoidem) rodiolina,jej wzór strukturalny przedstawia rycina 5 (7, 31);
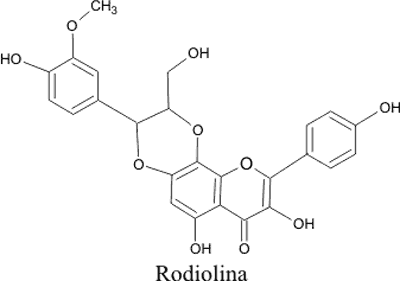
Ryc. 5. Struktura chemiczna rodioliny obecnej w gatunku Rhodiola.
Do grupy flawonoidów obecnych w rodzaju Rhodiola zaliczyć można również pochodne flawan-3-olu, tj. katechinę, w szczególności epigalokatechinę (31), jej ester galusan epigalokatechiny oraz ich polimeryczne struktury – procyjanidyny (3, 9, 15). Związki te wyizolowano z trzech gatunków: R. rosea, R. semenovii i R. heterodonta (21); a ich struktury przedstawia rycina 6. Ta grupa związków zaliczana może być do silnych przeciwutleniaczy, zmiatających wolne rodniki bardziej skutecznie niż witaminy C i E.
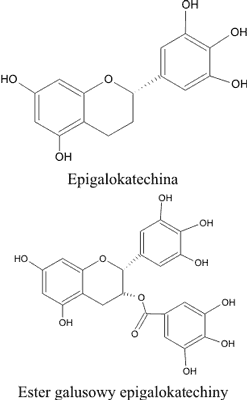
Ryc. 6. Przykłady katechin w gatunkach rodzaju Rhodiola.
Ważną grupą połączeń są również proantocyjanidyny, które są związkami polimerycznymi, składającymi się z jednostek polihydroksyflawan-3-olu połączonych wiązaniami C-C, które oprócz zmiatania wolnych rodników hamują proces utleniania cholesterolu i uważane są za najskuteczniejsze przeciwutleniacze roślinne (32). Działają one także przeciwnowotworowo, przeciwzapalnie, przeciwalergicznie, antymutagennie, poprawiają funkcje ochronne wątroby (21).
Fenolokwasy
Istnieją liczne dane piśmiennictwa wskazujące na występowanie kwasów fenolowych w rodzaju Rhodiola. Krajewska-Patan i wsp. (31), opisują występowanie kwasu galusowego i chlorogenowego w hodowlach tkankowych. Zhou i wsp. (14) stwierdzili natomiast, że w gatunkach Rhodiola obecne są kwasy: ferulowy, salicylowy, kawowy, galusowy, kwas 4-hydro-ksybenzoesowy i 3,4-dihydroksybenzoesowy. De Sanctis i wsp. (15) podają występowanie w R. rosea kwasu kawowego, galusowego i chlorogenowego.
Inne dane piśmiennictwa zebrane na temat obecności kwasów fenolowych w rodzaju Rhodiola pozwalają stwierdzić, iż występują one poza różeńcem górskim także w R. semenovii (33), R. crenulata (26) i R. kirilowii (31).
Inne związki występujące w rodzaju Rhodiola
Spośród pozostałych substancji na uwagę zasługuje obecność olejku eterycznego. Jego zawartość i skład zostały przebadane w R. rosea, R. crenulata, R. fastigiata i R. quadrifida. Olejki wymienionych roślin odbiegają od siebie składem.
– R. quadrifida – zidentyfikowano 23 składowe olejku. Główne składniki stanowiły kwasy: heksadekanowy, 9,12-oktadekadienowy, mirystynowy, oktadekanowy oraz α-terpineol (13);
– W olejku eterycznym R. rosea zidentyfikowano 75 składników, z których najwyższą zawartość procentową wykazywał n-dekanol; ponadto stwierdzono obecność geraniolu, limonenu, α-pinenu i dodekanolu (3).
– R. crenulata i R. fastigiata – głównym wyizolowanym składnikiem był geraniol, a także n-octanol, 2-metyl-3-buten-2-ol oraz linalol (26);
Ważną grupą związków wśród izoprenoidów występujących w rodzaju Rhodiola są monoterpenoidy. Zaliczamy do nich: rozyrydol (oksygeraniol) i jego glikozyd – rozyrydynę oraz glikozydy rodiolozydy A – E. Są to związki wyodrębnione tylko z różeńca górskiego (33).
Gatunki Rhodiola zawierają również w swoim składzie kwasy organiczne, takie jak szczawiowy, jabłkowy, cytrynowy, bursztynowy, mlekowy, winowy, fumarowy (34), glikozydy cyjanogenne – lotaustralin oraz rodiocyjanozyd A (obecne w R. rosea, R. semenovii i R. heterodonta) (15, 21), a także rodiocyjanozyd B (w R. quadrifida) (27).
W składzie chemicznym rodzaju Rhodiola stwierdzono ponadto występowanie garbników pirogalolowych (ok. 15-20%) (7, 34), cukrów (glukoza, sacharoza), białek, tłuszczów i wosków oraz innych metabolitów wtórnych, tj. antrachinonów i oksykumaryn (4, 34). W częściach podziemnych, szczególnie różeńca górskiego, stwierdzono obecność licznych mikroelementów, w tym znaczących ilości manganu, a także baru, chromu, cynku, kadmu, kobaltu, miedzi, niklu i selenu (7, 34-35).
Cel pracy
Celem niniejszej pracy była analiza zawartości trzech podstawowych grup związków biologicznie czynnych, takich jak kwasy fenolowe, flawonoidy i antocyjany, występujących w dwóch gatunkach rodzaju Rhodiola: R. rosea i R. quadrifida, a także dobór optymalnej metody ekstrakcji oraz wyznaczenie właściwego stężenia rozpuszczalnika (ekstrahenta) i temperatury, zapewniających najwyższą zawartość badanych grup związków.
Materiał i metody
Surowcami użytymi do badań były korzenie różeńca górskiego Rhodiola rosea oraz Rhodiola quadrifida pochodzące z Mongolii.
Ekstrakcję poszczególnych surowców prowadzono z wykorzystaniem następujących metod: ogrzewanie w koszyku grzejnym (KOS), przyspieszona ekstrakcja cieczowa (ASE) oraz ekstrakcja wspomagana ultradźwiękami (UAE). Stosowano zmienne parametry fizykochemiczne: temperaturę (25, 60, 80 i 100°C) i skład ekstrahenta (metanol 50, 80 i 100%).
W badaniach analitycznych stosowano: ekstraktor ASE 100 (Dionex, USA), łaźnię ultradźwiękową Sonorex (Bandelin, Niemcy), koszyczek grzejny, spektrofotometr UV-Visible, Varian 50 Scan, pehametr pH 211 (Hanna Instruments Arvre Industrial, Włochy), pompę próżniową SC 842-KNF (Niemcy), wagę analityczną Radwag WPS 510/C (Polska), suszarkę uniwersalną SUP-4 (Polska) oraz inny niezbędny sprzęt laboratoryjny i odczynniki.
Analizę zawartości wilgoci w badanych surowcach oraz oznaczenia flawonoidów i kwasów fenolowych prowadzono z wykorzystaniem metod farmakopealnych (36), natomiast do oznaczenia zawartości antocyjanów wykorzystano dwie metody spektrofotometryczne opisane w piśmiennictwie (37-39).
Ekstrakcja w koszyczku grzewczym (KOS)
Ekstrakcję typu ciecz-ciało stałe w koszyczkach grzewczych, przeprowadzono przy użyciu czystego metanolu oraz mieszanin metanolu i wody, w temperaturze wrzenia rozpuszczalnika.
Odważono sproszkowany korzeń Rhodiola quadrifida (przesiany przez sito 1,2 mm) w ilości około 20 g. Surowiec przeniesiono ilościowo do kolby okrągłodennej o pojemności 500 ml i zalewano 200 ml 50, 80 lub 100% metanolu. Kolby umieszczano w koszyczkach grzewczych pod chłodnicą zwrotną i prowadzono ekstrakcję w temperaturze wrzenia rozpuszczalnika przez okres 30 min. Po tym czasie wyciągi zdekantowano nad sączkami bibułowymi do zlewek. Pozostały w kolbach surowiec oraz sączki bibułowe zalano 100 ml ekstrahenta i ogrzewano od momentu wrzenia cieczy przez okres 30 min. Uzyskane wyciągi ponownie przesączono przez sączki bibułowe do zlewek, a pozostałe sączki wraz z surowcem ponownie zalano 100 ml rozpuszczalnika i ogrzewano przez 30 min. Po tym czasie połączone wyciągi zagęszczono na wyparce obrotowej i przesączono przez sączki do kolbek miarowych o pojemności 50 ml. Kolbki uzupełniono do nominalnej objętości czystym metanolem. Ekstrakcję korzeni Rhodiola rosea prowadzono analogicznie do powyższego opisu.
Otrzymane wyciągi z korzeni R. quadrifida i R. rosea odpowiednio oznaczono i poddano analizie ilościowej na zawartość związków fenolowych – fenolokwasów, flawonoidów i antocyjanów.
Ekstrakcja wspomagana ultradźwiękami (UAE)
Naważkę 15 g wysuszonych i rozdrobnionych (1,2 mm) korzeni R. quadrifida przeniesiono ilościowo do kolby okrągłodennej o pojemności 500 ml i zalano 200 ml 50, 80 lub 100% metanolu. Kolbę umieszczono w łaźni ultradźwiękowej pod chłodnicą zwrotną i prowadzono ekstrakcję w temperaturze 25°C przy mocy równej 10 W przez 20 min. Po tym czasie wyciąg zdekantowano nad sączkiem bibułowym do zlewki. Pozostały w kolbie surowiec oraz sączek bibułowy zalano nową porcją rozpuszczalnika i ogrzewano w tych samych warunkach przez 20 min. Uzyskany wyciąg ponownie przesączono przez sączek bibułowy do zlewki, po czym ponownie zalano 100 ml pozostały w kolbie surowiec. Ogrzewano w określonych warunkach przez 20 min. Ekstrakcję powtórzono jeszcze raz, a następnie połączone wyciągi zagęszczono na wyparce obrotowej i przesączono przez miękki sączek do kolbki miarowej o pojemności 50 ml. Kolbkę uzupełniono do nominalnej objętości czystym metanolem.
W przypadku Rhodiola rosea odważono 10 g wysuszonego i rozdrobnionego (1,2 mm) surowca, przeniesiono ilościowo do kolby okrągłodennej o pojemności 250 ml i zalewano 100 ml 80% metanolu. Ekstrakcję na łaźni ultradźwiękowej przeprowadzono jak dla Rhodiola quadrifida, używając dwukrotnie po 50 ml rozpuszczalnika w drugim i trzecim etapie ekstrakcji. Połączone wyciągi po zagęszczeniu przesączono do kolbki o pojemności 50 ml i dopełniono do kreski metanolem.
W tak otrzymanych wyciągach z obu surowców analizowano zawartość związków fenolowych.
Przyspieszona ekstrakcja cieczowa (ASE)
Proces przyspieszonej ekstrakcji cieczowej dla korzeni R. quadrifida oraz R. rosea prowadzono w 3 różnych temperaturach pieca grzewczego: 60, 80 i 100°C. Każdorazowo odważano odpowiednią masę każdego z badanych surowców, przenoszono ilościowo do celi ekstrakcyjnej ze stali nierdzewnej o pojemności 10 ml. Każdą próbkę ekstrahowano czystym metanolem, pod ciśnieniem 100 barów. Zebrane w pojemnikach kolekcyjnych ekstrakty przesączono przez sączek bibułowy do kolbek miarowych o pojemności 25 ml, odpowiednio oznaczono i poddano dalszym badaniom.
Parametry techniczne urządzenia ASE 100 przedstawiono w tabeli 1.
Tabela 1. Wybrane parametry szybkiego ekstraktora próbek organicznych ASE 100 (Dionex Corporation, USA) (40).
| Element urządzenia | Opis |
| Piec | - kontrola temperatury do 200°C
- pionowy przepływ rozpuszczalnika przez celę ekstrakcyjną (z góry do dołu) |
| Pompa | - dozowanie rozpuszczalnika pod stałym ciśnieniem 10 Mpa
- czujnik ciśnienia i automatyczny zawór bezpieczeństwa |
| Czujnik cieczy | - czujnik na podczerwień (IR) do wykrywania obecności pojemnika kolekcyjnego i poziomu cieczy podczas ekstrakcji |
| Cela ekstrakcyjna | - cela o objętości 10 ml
- wewnętrzna średnica celi: 28,3 mm
- zakręcana ręcznie, z kompresyjną uszczelką dla wysokich ciśnień |
| Pojemniki kolekcyjne | - pojemniki o pojemności 250 ml
- wyposażone w odporne chemicznie septy |
| Ekstrahenty | - możliwość użycia szerokiej gamy rozpuszczalników organicznych i mieszanin wodno-organicznych |
| Wymagania pneumatyczne | - azot (N2): 1034-1340 kPa
- powietrze: 400-827 kP |
Analiza ilościowa flawonoidów
Oznaczenie flawonoidów w korzeniach dwóch gatunków Rhodiola przeprowadzono na podstawie zmodyfikowanej metody opisanej w FP VI (36). Zawartość procentową sumy flawonoidów podano w przeliczeniu na kwercetynę, zaś wyniki przedstawiono w tabeli 3.
Tabela 2. Procentowa zawartość strat masy po suszeniu w organach podziemnych R. rosea i R. quadrifida.
| Organy podziemne | Strata masy po suszeniu (%) | Średnia wartość (%) |
| Rhodiola rosea | 9,9 | 10,37 |
| 10,8 |
| 10,4 |
| Rhodiola quadrifida | 8,6 | 8,47 |
| 8,5 |
| 8,3 |
Tabela 3. Średnia procentowa zawartość sumy flawonoidów w korzeniach R. quadrifida i R. rosea w przeliczeniu na suchą masę surowca. (± S.D., n=3).
| Metoda ekstrakcji | Warunki ekstrakcji | Średnia zawartość flawonoidów odczytana z krzywej wzorcowej (mg) | Średnia zawartość flawonoidów w przeliczeniu na suchą masę (%) |
| rozpuszczalnik | temperatura (°C) |
| Rhodiola quadrifida |
| KOS | MeOH 100% | wrzenia rozpuszczalnika | 5,421 ? 0,125 | 0,61 ? 0,01 |
| MeOH 80% | 8,054 ? 0,418 | 0,90 ? 0,05 |
| MeOH 50% | 6,762 ? 0,149 | 0,81 ? 0,02 |
| UAE | MeOH 100% | 25 | 3,891 ? 0,105 | 0,57 ? 0,01 |
| MeOH 80% | 4,668 ? 0,163 | 0,71 ? 0,02 |
| MeOH 50% | 4,952 ? 0,085 | 0,72 ? 0,01 |
| ASE | MeOH 100% | 60 | 0,857 ? 0,44 | 0,93 ?0,05 |
| 80 | 0,854 ? 0,085 | 0,91 ?0,09 |
| 100 | 1,646 ? 0,076 | 1,18 ? 0,05 |
| Rhodiola rosea |
| KOS | MeOH 80% | wrzenia rozpuszczalnika | 12,994 ? 0,442 | 3,12 ? 0,11 |
| UAE | 25 | 8,794 ? 0,144 | 2,10 ? 0,03 |
| ASE | MeOH 100% | 60 | 3,244 ? 0,086 | 3,52 ? 0,09 |
| 80 | 4,060 ? 0,174 | 4,33 ? 0,18 |
| 100 | 5,658 ? 0,126 | 4,10 ? 0,09 |
| Metody ekstrakcji: KOS - ekstrakcja w koszyczku grzejnym; UAE - ekstrakcja wspomagana ultradźwiękami; ASE - przyspieszona ekstrakcja rozpuszczalnikowa |
Przygotowanie roztworu podstawowego. Z ekstraktów otrzymanych różnymi metodami, opisanymi w części pierwszej, odważano próbki po 10 g, za wyjątkiem metody ASE (MeOH 100% w 100°C), gdzie próbki odważano po 15 g.
Ekstrakty przeniesiono do kolbek okrągłodennych o pojemności 100 ml, po czym odparowano do sucha na łaźni wodnej. Do każdego z otrzymanych suchych ekstraktów dodano 20 ml acetonu, 4 ml kwasu solnego, 2 ml metenaminy i utrzymywano 30 min. we wrzeniu na łaźni wodnej pod chłodnicą zwrotną. Każdy hydrolizat przesączono przez watę do kolbek miarowych o pojemności 100 ml, a osad wraz z watą umieszczono w kolbie. Dodano 20 ml acetonu i ponownie utrzymywano we wrzeniu przez 10 min. Wytrawianie acetonem powtórzono jeszcze raz. Wyciągi przesączono do tej samej kolby miarowej i uzupełniono acetonem. Następnie odmierzono 20 ml roztworu do rozdzielacza, dodano 20 ml wody i ekstrahowano octanem etylu: jeden raz w ilości 15 ml, a następnie trzy razy po 10 ml. Połączone warstwy organiczne przemyto 2 razy po 40 ml wody, przesączono do kolbki miarowej o pojemności 50 ml i uzupełniono octanem etylu.
Przygotowanie roztworów badanych. Do oznaczenia przygotowano po trzy próbki wyciągu octanowego każdego z ekstraktów. Do 10 ml wyciągu dodano 2 ml roztworu chlorku glinu i uzupełniono mieszaniną kwasu octowego z metanolem (1:19; v/v) do 25 ml.
Przygotowanie roztworu porównawczego. Do 10 ml wyciągu octanowego każdej próbki dodano mieszaninę kwasu octowego z metanolem (1:19; v/v) do 25 ml, bez dodatku chlorku glinowego. Roztwory odstawiono na 30 min., licząc od momentu dodania chlorku glinu, po czym zmierzono jego absorbancję przy długości fali λ = 425 nm. Jako odnośnik zastosowano roztwór porównawczy.
Procentową zawartość sumy flawonoidów (X), w przeliczeniu na kwercetynę wyliczano z wyznaczonej krzywej wzorcowej. Wyniki przedstawiono w tabeli 3.
Analiza ilościowa sumy fenolokwasów
Analizie poddano ekstrakty z korzeni R. quadrifida i R. rosea (otrzymane uprzednio opisanymi metodami ekstrakcyjnymi). Oznaczenie procentowej zawartości sumy fenolokwasów wykonano zmodyfikowaną metodą spektrofotometrii absorpcyjnej VIS z użyciem odczynnika Arnova opisaną w FP VI (36). Zawartość procentową fenolokwasów podano w przeliczeniu na kwas kawowy.
Przygotowanie badanego roztworu: Do wytarowanej kolbki okrągłodennej o pojemności 100 ml odważono odpowiednie ilości ekstraktów R. quadrifolia i R. rosea (koszyczek grzewczy oraz łaźnia ultradźwiękowa; próbki po 2,5 g, zaś w metodzie ASE próbki o masie 9,0 g).
Ekstrakty odparowano do sucha na łaźni wodnej. Syropowatą pozostałość rozpuszczono w 20 ml gorącej wody, ostudzono i przesączono przez sączek bibułowy. Roztwór przeniesiono do kolby miarowej, a następnie uzupełniono wodą do 100 ml.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Pietrosiuk A, Zych M, Kozłowski J, Furmanowa M. Preliminary report on phytochemistry of medicinal plant Rhodiola kirilowii (Regel.) maxim. Herba Pol 2002; 48,(3):136-45. 2. Help Your Patients Resist Stress and Enhance Stamina. http://www.headquartersforhealth.com/Adreset.pdf (dostępne 10.04.2008r.). 3. Rohloff J. Volatiles from rhizomes of Rhodiola rosea L. Phytochem 2002; 59:655-61. 4. Radwan-Pytlewska K. Rhodiola rosea L. – roślina o zaletach żeń-szenia. Wiad Ziel 1983; 25(9):15-6. 5. Krajewska-Patan A, i wsp. Rhodiola rosea L. (różeniec górski) – stan badań biotechnologicznych. Herba Pol 2005; 51(3/4): 52-64. 6. Wagner H, Norr H, Winterhoff H. Plant adaptogens. Phytomed 1994; 1:63-78. 7. Przybył J. Praca doktorska: Gromadzenie się związków biologicznie aktywnych w organach surowcowych różeńca górskiego ( Rhodiola rosea L.) uprawianego w zróżnicowanych warunkach klimatyczno-glebowych. SGGW W-wa 1999. 8. Kozłowski J, Szczyglewska D. Biologia kiełkowania nasion roślin leczniczych. Cz. XXII. Gatunki z rodziny gruboszowatych ( Crassulaceae). Rhodiola rosea L. Herba Pol 2001; 47(2):137-41. 9. (No author cited): Rhodiola rosea – monograph – overview of medicinal plant known as golden root and arctic root. Altern Med Rev 2002; 7,5: 421-3. 10. Brown RP, Gerbarg PL, Ramazanov Z. A phytomedicinal overview. Herbal Gram 2002; 56:40-52. 11. Kerry B. Rhodiola: A new weapon against fatigue. Chiropractic Nutr. Wellness.http://www.nutritionalwellness.com/archives/2007/may/05_bone.php (dostępne 10.04.2008 r.). 12. Index Kavensis Plantarum Phanerogamarum II. 1885; 710. 13. Bai Z, Nan P, Zhong Y. Chemical composition of the essential oil of Rhodiola quadrifida from Xinjiang, China. Chem. Nat. Comp. 2005; 41(4):418-9. 14. Zhou G, Guan Y, Chen H, Ye J. Simultaneous determination of pharmacologically active ingredients in Rhodiola by capillary chromatography with electrochemical detection. J Chromat A 2007; 1142:236-9. 15. De Sanctis R, et al. In vitro protective effect of Rhodiola rosea extract against hypochlorus acid-induced oxidative damage in human erythrocytes. BioFactors 2004; 20(3):147-59. 16. Kelly GS. Rhodiola rosea: A possible plant adaptogen – evaluation of therapeutic properties. Altern Med Rev 2001; 6(3):293-02. 17. Khanum F, Singh Bawa A, Singh B. Rhodiola rosea: A versatile adaptogen. Comprehensive reviews in food science and safety. 2005; 4:55-62. 18. Mook-Jung I, et al. Neuroprotective Effects of Constituents of the Oriental Crude Drugs, Rhodiola sacra, R. sachalinensis and Tokaku-joki-to, against Beta-amyloid Toxicity, Oxidative Stress and Apoptosis. Biol Pharm Bulletin 2002; 25:1101-4. 19. Sedlac-Vadoc V. Żywienie i zdrowie. http://www.e-depresja.pl/suplementy-calivity/rhodiolin-120.html (dostępne 10.04.2008 r.). 20. Abidov M, et al. Effect of extracts from Rhodiola rosea and Rhodiola crenulata ( Crassulaceae) roots on ATP content in mitochondria of skeletal muscles. Bulletin of experimental biology and medicine. Immunol and microbiology 2003; 136(12):585-7. 21. Yousef GG, et al. Comparative phytochemical characterization of three Rhodiola species. Phytochem 2006; 67,21:2380-91. 22. Song EK, et al. Hepatoprotective phenolic constituents of Rhodiola sachalinensis on tacrine – induced cytotoxicity in Hep G2 cells. Phytother Res 2003; 17:563-5. 23. Lei Y, et al. Determination of genetic variation in Rhodiola crenulata from the Hengduan Mountains Region, China using inter-simple sequence repeats. Genet Molecular Biol 2006; 29(2):339-44. 24. Petsalo A, Jalonen J, Tolonen A. Identification of flavonoids of Rhodiola rosea by liquid chromatography-tandem mass spectrometry. J Chromatog A 2006; 1112:224-31. 25. Du M, Xie J. Flavonol glycosides from Rhodiola crenulata. Phytochem 1995; 38,(3):809-10. 26. Lei Y, et al. Chemical composition of the essential oils of two Rhodiola species from Tibet. Z Naturforsch 58c, 2003; 161-4. 27. Yoshikawa M, et al. Bioactive constituents of Chinese natural medicines. II. Rhodiolae radix. (1). Chemical structures and antiallergic activity of rhodiocyanosides A and B from the underground part of Rhodiola quadrifida (Pall.) Fisch. et Mey. ( Crassulaceae). Chem Pharm Bull Tokyo, 1996; 44,(11):2086-91. 28. Ming DS, et al. Bioactve compounds from Rhodiola rosea ( Crassulaceae). Phytother Res 2005; 19:740-3. 29. Barker J, Meletis Ch D. Chronic fatigue syndrome: treatment from an adaptogenic perspective. Townsend Letter for Doctors and Patients.Feb-March, 2004, http://findarticles.com/p/articles/mi_m0ISW/is_247-248/ai_113807012/pg_1 (dostępne 10.04.2008 r.). 30. Sou Y, et al. Analysis of five pharmacologically active compounds from Rhodiola for natural product drug discovery with capillary electrophoresis. Chromatogr 2004, 60, (9/10), 589-95. 31. Krajewska-Patan A, i wsp. Zawartość związków biologicznie czynnych w hodowlach kalusa i w hodowlach zawiesinowych Rhodiola kirilowii (Regel.) maxim. Herba Polon 2006; 52,(3):47-8. 32. Makowska-Wąs J, Janeczko Z. Biodostępność polifenoli roślinnych. Post Fitoter 2004; 13:3. 33. Kuliev R Z, Akhmedov U, Khalmatov Kh Kh, Kuliev Z A. Dimeric proanthocyanidins form Rhodiola semenovii. Chem Nat Comp 2004; 40,(1):94-5. 34. www.pogodyne.pl/adaptogeny. 2007. 35. Jezierska A. Różeniec górski – roślina o cennych właściwościach leczniczych. Wiad Ziel 1995; 37(3):4-5. 36. Farmakopea Polska VI, PTFarm, Warszawa 2002. 37. Elbanowska A, Napierała A. Metoda ilościowego oznaczania antocyjanów w wyciągach ze świeżych, stabilizowanych owoców aronii ciemnoowocowej ( Aronia melanocarpa (Michx. Eliot). Herba Polon 1989; 35,(4):187-91. 38. Anthocyanin Content in Bilberry by pH-Differential Spectrophotometry INA Method 116.000, www.nsf.org/business/ina/bilberry.asp?program=INA. (dostępne 10.04.2008 r.). 39. Miłkowska K., Strzelecka H. Flos Hibisci – metody identyfikacji i ocena surowca. Herba Polon 1995; 41,(1):11-6. 40. Instrukcja obsługi szybkiego ekstraktora próbek organicznych ASE 100 (Dionex Corporation. Sunnyyale, CA, USA).






