© Borgis - Postępy Fitoterapii 1/2008, s. 47-58
*Bogdan Kędzia
Skład chemiczny i adaptogenne działanie pszczelego pyłku kwiatowego. Cz. I. Skład chemiczny
CHEMICAL COMPOSITION AND ADAPTOGENIC ACTIVITY OF HONEYBEE – COLLECTED POLLEN. PART I. CHEMICAL COMPOSITION
Instytut Roślin i Przetworów Zielarskich w Poznaniu
Dyrektor Instytutu: dr hab. n. med. Przemysław M. Mrozikiewicz
Summary
The honeybee – collected pollen contains in highest amounts: sugars (33.7%), total proteins (23.9%) and cellulose (22.4%). In lower amount are present: water (9.5%), total lipids (5.4%), bioelements (1.3%), phenolic compounds (1.2%) and vitamins (0.2%). The total amount of above mentioned components is 97.6%. For this reason it could be assumed, that 70% of substances being present in honeybee pollen (excluding water and cellulose) show the biological activity, which could be used succesfully for diet supplementation. This product is characterized especially by a strong adaptogenic activity.

Skład chemiczny
Pyłek kwiatowy, zebrany z kwiatów roślin zielnych i drzew, pszczoły mieszają z niewielką ilością śliny lub nektaru i w postaci obnóży przenoszą do ula w koszyczkach znajdujących się na tylnej parze nóg. Pyłek w formie obnóży pozyskuje się za pomocą poławiaczy pyłku i po wysuszeniu stanowi on surowiec farmaceutyczny, spożywczy lub kosmetyczny. Do celów użytkowych obnóże rozdrabnia się i wykorzystuje m.in. do wytwarzania tabletek, kapsułek i granulatów, a także sporządza z niego wyciągi alkoholowe, głównie zagęszczone.
Pyłek kwiatowy, często nazywany pszczelim pyłkiem kwiatowym lub pyłkiem pszczelim, z tego względu, że zbierany jest przez pszczoły, a nie w sposób mechaniczny przez człowieka, jest dość zróżnicowanym produktem pochodzenia roślinnego, bogatym w substancje biologicznie aktywne.
W ziarnach pszczelego pyłku kwiatowego, pochodzącego z różnych gatunków roślin, stwierdzono ponad 250 substancji. Do zasadniczych grup substancji zalicza się białka i aminokwasy, lipidy i kwasy tłuszczowe, cukry, związki fenolowe, witaminy i biopierwiastki.
Pyłek kwiatowy charakteryzuje się zróżnicowanym składem chemicznym. Dla przykładu obnóże pszczele zebrane wiosną dość znacznie różni się zawartością aminokwasów w porównaniu do obnóża zebranego przez pszczoły latem. Zróżnicowana jest wyraźnie zawartość karotenoidów i witaminy C w obnóżach pochodzących z różnych roślin zbieranych przez pszczoły w tej samej porze roku, nawet od 30 do 400-krotnie. Poza tym odmienny jest także skład chemiczny pyłku pochodzącego z tych samych gatunków roślin, rosnących w różnych strefach klimatycznych (1).
Postanowiono dokonać przeglądu składu chemicznego pyłku kwiatowego opierając się na dostępnym piśmiennictwie krajowym i zagranicznym.
Białka i aminokwasy
Białko ogólne
Zawartość białka ogólnego w pyłku kwiatowym waha się od 13,2 do 33,1 (średnio 23,9%) (1-16). Jak wykazały badania Wachoniny i Bodrowej (4) pyłek pozyskiwany z jednego ula w trzech kolejnych miesiącach sezonu jesiennego prawie wcale nie różnił się zawartością białka ogólnego; i tak w lipcu średnia zawartość białka wynosiła 24,2, w sierpniu 23,7 i we wrześniu 24,2% w odniesieniu do suchej masy tego produktu. Natomiast pomiędzy zawartością białka ogólnego w pyłku kwiatowym pochodzącym z różnych roślin występowały duże różnice. Jak podaje Dobrovoda (7) w pyłku rzepaku i orzecha laskowego stwierdzono obecność ponad 50% białka ogólnego, natomiast w pyłku z kukurydzy i sosny zaledwie 14% białka. Do produktu bogatego w białko Szemietkow i wsp. (12) zaliczają pyłek ze śliwy, brzoskwini, dziurawca, koniczyny białej i łąkowej, gorczycy czarnej, eukaliptusa, facelii, jasnoty białej i chabra bławatka. Istotne jest jednak to, że średnia zawartość białka ogólnego w pyłku wielokwiatowym, pochodzącym z różnych, nawet odległych rejonów świata jest bardzo podobna. Badania Szczęsnej i Rybak-Chmielewskiej (14) wskazują, że wartości te dla pyłku polskiego wynoszą 20,7, pyłku hiszpańskiego 17,0, koreańskiego 20,7 i chińskiego 23,7%. Według Almeida-Muradian i wsp. (17) w pyłku kwiatowym brazylijskim zawartość białka wynosi średnio 21,4%.
Z kolei Syrocka i Zalewski (9) stwierdzili, że w białku pyłku kwiatowego znajdują się następujące frakcje: albuminy (35,4% w odniesieniu do całości białka), globuliny (18,9%), gluteliny (18,6%), prolaminy (21,8%) i inne białka (m.in. enzymy – 5,3%).
Aminokwasy
Ogólna zawartość aminokwasów w pyłku kwiatowym zarówno pochodzących z białka, jak i wolnych (niezwiązanych), mieści się w granicach od 10,2 do 26,3% (średnio 17,6%) (1, 5, 7, 16-20).
Dotąd z pyłku kwiatowego wyizolowano 19 aminokwasów (13), jednak we wszystkich próbkach pyłku zawsze występuje 18 aminokwasów (1, 2, 7, 15, 18-20), a mianowicie: kwas asparaginowy, treonina, seryna, kwas glutaminowy, prolina, glicyna, alanina, walina, metionina, izoleucyna, leucyna, tyrozyna, fenyloalanina, histydyna, lizyna, arginina, cystyna i tryptofan.
W największej ilości w pyłku kwiatowym występują aminokwasy: kwas asparaginowy (średnio 2,10%), kwas glutaminowy (średnio 2,04%), prolina (średnio 1,72%) i leucyna (średnio 1,42%) (1, 5, 7, 19, 20) (ryc. 1). W większych ilościach spotyka się także lizynę i glicynę (średnio 1,16%), alaninę (średnio 1,12%) oraz argininę, serynę, walinę, treoninę i fenyloalaninę (w granicach 1,02-1,09%) (1, 5, 7, 19, 20).
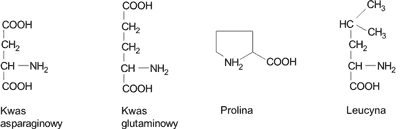
Ryc. 1. Aminokwasy występujące w największych ilościach w pyłku kwiatowym.
W pyłku kwiatowym występują wszystkie aminokwasy egzogenne, to znaczy takie, które muszą być dostarczone do organizmu wraz z pożywieniem. Zalicza się do nich fenyloalaninę, izoleucynę, leucynę, lizynę, metioninę, treoninę, tryptofan i walinę. Ludzie i zwierzęta nie mają możliwości ich syntetyzowania ani magazynowania. Poza tym w pyłku kwiatowym znajdują się także dwa inne aminokwasy – arginina i histydyna, które uważa się za względnie egzogenne. A zatem pyłek kwiatowy zawiera wszystkie aminokwasy niezbędne do budowy białka ludzkiego.
Opierając się na danych Tichonowa (1), Donadieu (5), Dobrovody (7) i Szczęsnej (19) można stwierdzić, że zawartość aminokwasów egzogennych i względnie egzogennych w pyłku kwiatowym wynosi średnio 8,6%. W odniesieniu do wszystkich aminokwasów zawartych w pyłku kwiatowym (16,9%) jest to wartość 50,7%. Z tego można wnioskować, że ponad połowa zawartości aminokwasów występujących w pyłku kwiatowym przypada na aminokwasy egzogenne i względnie egzogenne. Według Szczęsnej i Rybak-Chmielewskiej (15) niezbędne aminokwasy występują w pyłku kwiatowym w około 36%.
Poza aminokwasami związanymi ze strukturami białkowymi występującymi w pyłku kwiatowym, w produkcie tym znajdują się także wolne aminokwasy. Zorja i wsp. (21) w pyłku ukraińskim oznaczyli około 6% wolnych aminokwasów. Natomiast w pyłku kwiatowym uzyskanym przez Mondal i wsp. (22) z 9 roślin indyjskich zawartość wolnych aminokwasów wahała się od 0,65 do 4,0%, przy czym ze wszystkich próbek pyłku wyizolowano prolinę i kwas aminomasłowy, a z większości próbek kwas asparaginowy.
Kwasy nukleinowe
W pyłku kwiatowym wykryto obecność kwasów nukleinowych (6, 12). Odgrywają one dużą rolę w przekazywaniu cech dziedzicznych oraz regulacji ważnych procesów syntezy w organizmie. W jądrach komórek pyłku o charakterze generatywnym stwierdzono przewagę kwasu dezoksyrybonukleino-wego (DNA), a w jądrach komórek pyłku o charakterze wegetatywnym przewagę kwasu rybonukleinowego (RNA). Poza wolnymi kwasami rybonukleinowymi w pyłku kwiatowym występują także nukleoproteidy – białka proste (histony, protaminy, albuminy i globuliny) związane z kwasami rybonukleinowymi. Poczinkowa (11) podaje, że pyłek kwiatowy zawiera od 0,60 do 4,87% kwasów nukleinowych.
Enzymy
W pyłku kwiatowym występują liczne enzymy – substancje białkowe katalizujące przebieg reakcji syntezy i rozkładu wielu substancji metabolicznych. Według Szapiro i wsp. (6) oraz Szemietkowa i wsp. (12) do najważniejszych enzymów zalicza się α- i β-amylazy – katalizujące rozszczepienie skrobii, glikogenu i substancji pokrewnych, inulazę – katalizującą proces rozpadu inuliny, celulazę – hydrolizującą celulozę (błonnik), sacharozę (inwertazę) – uczestniczącą w procesie rozszczepiania sacharozy do glukozy i fruktozy, lipazy i fosfolipazy – katalizujące rozszczepianie lipidów i fosfatydów oraz proteazy i peptydazy – działające na białka i peptydy. Iannuzzi (13) podaje, że w pyłku kwiatowym występuje ponad 100 enzymów, przy czym najliczniej reprezentowane są hydrolazy, oksydoreduktazy, transferazy, liazy i izomerazy. Większość enzymów obecnych w pyłku kwiatowym pochodzi z materiału roślinnego, jednak występują w nim także enzymy będące składnikami wydzieliny gruczołow ślinowych i gardzielowych pszczół (1, 11).
Do ważnych enzymów pyłku kwiatowego, znajdujących znaczenie praktyczne należą zgodnie z Tichonowem i wsp. (1): inwertaza, amylazy i lipaza. Aktywność tych enzymów w pyłku kwiatowym pochodzącym z gryki, lipy, kasztanowca, rzepaku, mniszka, koniczyny, facelii i gorczycy wynosi: dla inwertazy średnio 9,4 mmola/l, dla amylaz średnio 0,11 mmola/l i dla lipazy średnio 1,18 mmola/l. Zainteresowanie naukowców budzi również enzym o nazwie fitaza alkaliczna, który z kwasu fitynowego uwalnia jony fosforowe, co stawia pyłek kwiatowy w rzędzie wartościowych suplementów żywnościowych (23).
Lipidy i kwasy tłuszczowe
Lipidy całkowite
Na podstawie badań wielu autorów można stwierdzić, że zawartość substancji lipidowych w pyłku kwiatowym mieści się w granicach 0,16-14,0% (średnia zawartość wynosi 5,41% (6, 7, 13-15, 17, 24). Do najbogatszych w substancje lipidowe zalicza się pyłek z mniszka i czarnej gorczycy (powyżej 10%) (6). Z kolei nieznaczne ilości tych substancji znajdują się w pyłku kukurydzianym i z orzecha laskowego (poniżej 1%) (7).
Lipidy są pojęciem dość szerokim. Z punktu widzenia aktywności biologicznej pyłku kwiatowego wyróżnia się: kwasy tłuszczowe (nasycone i nienasycone, w tym niezbędne nienasycone kwasy tłuszczowe – NNKT), fosfolipidy i fitosterole.
Kwasy tłuszczowe
Iannuzzi (13) podaje, że w pyłku kwiatowym występuje 13 kwasów tłuszczowych: 9 kwasów nasyconych (kapronowy, kaprylowy, kaprynowy, laurynowy, mirystynowy, palmitynowy, stearynowy, arachidowy i behenowy) oraz 4 kwasy nienasycone (palmitooleinowy, oleinowy, α-linolenowy i arachidonowy).
Seppänen i wsp. (25) w pyłku kwiatowym oznaczyli zawartość 6 kwasów tłuszczowych. Wśród kwasów nasyconych znajdowały się: kwas mirystynowy (0,2%), kwas stearynowy (2,2%) i kwas palmitynowy (25,1%) (ryc. 2). Natomiast kwasy nienasycone były reprezentowane przez kwas oleinowy (1,5%), linolowy (5,4%) i α-linolenowy (65,7%) (ryc. 2). Zawartość poszczególnych kwasów odnoszono do puli tych związków obecnej w wyciągu z pyłku kwiatowego, otrzymanego za pomocą rozpuszczalników organicznych. Okazało się, że kwasy nienasycone znajdowały się w przewadze (75,2%) w porównaniu do kwasów nasyconych (28,2%). Wzajemny stosunek tych grup związków wynosił 2,67.

Ryc. 2. Kwasy tłuszczowe występujące w największych ilościach w pyłku kwiatowym.
Z kolei Manning (26) stwierdził występowanie w pyłku kwiatowym 10 kwasów tłuszczowych. Zawartość kwasów nasyconych w wyciągach z pyłku kwiatowego 46 roślin oblatywanych przez pszczoły kształtowała się następująco: kwas dekanowy (średnio 1,3%), kwas dodekanowy (średnio 1,5%), kwas mirystynowy (średnio 6,3%), kwas palmitynowy (średnio 20,6%), kwas stearynowy (średnio 5,3%), kwas arachidowy (średnio 1,1%) i kwas behenowy (średnio 1,8%). Zawartość kwasów nienasyconych przedstawiała się jak następuje: kwas oleinowy (średnio 18,5%), kwas linolowy (średnio 17,2%) i kwas α-linolenowy (średnio 20,8%). Suma zawartości kwasów nienasyconych wynosiła 56,6%, a kwasów nasyconych 37,7%, a ich wzajemny stosunek kształtował się na poziomie 1,50.
Najnowsze i najlepiej udokumentowane badania przeprowadziła Szczęsna (24). We frakcji kwasów tłuszczowych autorka stwierdziła występowanie 9 kwasów, w tym 6 kwasów nasyconych: mirystynowego, palmitynowego, stearynowego, arachidowego, behenowego i lignocerynowego. Ich ogólna zawartość wynosiła 30,2%. Ponadto wykryła ona 3 kwasy nienasycone: oleinowy, linolowy i α-linolenowy w łącznej ilości 64,4%. Wzajemny stosunek kwasów nienasyconych i nasyconych wynosił 2,13.
Kędzia i wsp. (32, 33) w wyciągach z pyłku kwiatowego wykryli kwasy nasycone – palmitynowy i stearynowy (łącznie w ilości 18%) oraz kwasy nienasycone – oleinowy, linolowy i α-linolenowy (łącznie w ilości 24,2%). Dominowały kwasy: palmitynowy (16,8% i α-linolenowy (24,2%).
Dalsze badania wykazały, że kwasy tłuszczowe w wyciągach z pyłku kwiatowego polskiego, koreańskiego i chińskiego nie różnią się specjalnie, ani pod względem jakościowym, ani pod względem ilościowym. W podsumowaniu badań można było stwierdzić, że w pyłku kwiatowym pochodzącym z różnych rejonów świata dominowały następujące kwasy tłuszczowe: α-linolenowy (średnio 43,7%), palmitynowy (średnio 28,3%), linolowy (średnio 12,8%) i oleinowy (średnio 3,8%). A zatem w puli kwasów tłuszczowych przeważają kwasy nienasycone, a wśród nich kwas α-linolenowy. Badania Kołoczek i wsp. (38) wykazały, że w pyłku kwiatowym znajduje się od 3,6 do 4,0% kwasów tłuszczowych (średnio 3,8%), w tym od 2,3 do 3,1% NNKT (średnio 2,7%).
Jest to bardzo ważne spostrzeżenie, ponieważ izomery cis kwasu linolowego i linolenowego wykazują szczególne znaczenie żywieniowe. Określane są one mianem niezbędnych nienasyconych kwasów tłuszczowych (NNKT) i muszą być do organizmu człowieka dostarczane z zewnątrz wraz z pożywieniem. NNKT są niezbędne do budowy błon komórkowych, zapewniają ich prawidłowe funkcjonowanie, zapobiegają zakrzepom krwi w naczyniach, obniżają ciśnienie tętnicze krwi i poziom cholesterolu w surowicy krwi. Biorąc pod uwagę to, że we frakcji lipidowej pyłku kwiatowego kwasy tłuszczowe stanowią większość, można przyjąć, że pyłek kwiatowy jest bogatym źródłem NNKT.
Fosfolipidy
W pyłku kwiatowym znajduje się od 1,40 do 1,65% fosfolipidów (6). Wśród nich występują fosfatydylo-cholina (lecytyna) (ryc. 3), fosfatydyloetanoloamina (kefalina) oraz fosfatydyloinozytol (mio-inozytol) (1, 6, 12). Według Kołoczek i wsp. (38) w pyłku kwiatowym występuje średnio 0,50% fosfolipidów. Związki te wchodzą w skład błon komórkowych i wybiórczo regulują przenikanie substancji do komórek, odgrywając w ten sposób bardzo ważną rolę w przemianach metabolicznych.

Ryc. 3. Fosfatydylocholina (lecytyna).
Wymienione substancje jako czynniki lipotropowe hamują odkładanie lipidów w hepatocytach, zabezpieczając organizm przed hepatozą (czynnościowym zaburzeniem wątroby), a tym samym przed rozwojem miażdżycy.
Fitosterole
Pyłek kwiatowy odznacza się także wysoką zawartością fitosteroli (0,6-1,6%) (1, 6, 12). We frakcji sterolowej stwierdzono obecność β-sitosterolu (ryc. 4), kampesterolu (1, 27). Z innych steroli warto wymienić 24-metylenocholesterol, izofukosterol i brassikosterol (1, 27).
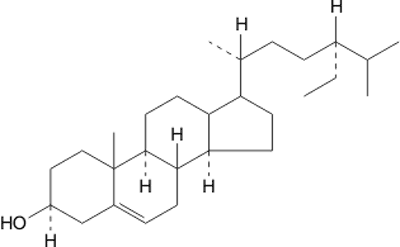
Ryc. 4. β-Sitosterol (fitosterol).
Obecność β-sitosterolu w pyłku kwiatowym, antagonisty cholesterolu, może wspomagać przeciwmiażdżycowe działanie tego produktu pszczelego.
Dzięki obecności fitosteroli pyłek kwiatowy wykazuje działanie estrogenne, stymulując procesy tworzenia i dojrzewania komórek jajowych u zwierząt i ludzi.
Cukry
Ogólna zawartość
W pyłku kwiatowym występują zarówno cukry proste, jak i cukry złożone (polisacharydy). Oznaczone wspólnie pozwalają na określenie tzw. ogólnej zawartości cukrów. Przegląd piśmiennictwa (1, 5-7, 10, 12-16, 28, 29) wskazuje, że w pyłku kwiatowym znajduje się od 21,4 do 41,6% cukrów (średnio 33,7%). Dobrovoda (7) podaje, że w pyłku sosnowym zawartość cukrów wynosiła ponad 30%, natomiast w pyłku makowym tylko około 12%. Z kolei Szczęsna (29) w pyłku chińskim wykryła 26,9% cukrów, a w pyłku koreańskim aż 48,4% tych związków. Stąd wniosek, że ogólna zawartość węglowodanów w pyłku kwiatowym może ulegać dużym wahaniom w zależności od rośliny z której pszczoły zbierają pyłek, jak i od kraju pochodzenia pyłku.
Cukry redukujące
Cukry o charakterze hydroksyaldehydów i hydroksyketonów mają zdolności redukujące (m.in. redukują sole miedzi w środowisku alkalicznym i stąd zwane są cukrami redukującymi. Do takich cukrów, które występują w pyłku kwiatowym należą: fruktoza, glukoza, maltoza i turanoza (ryc. 5).
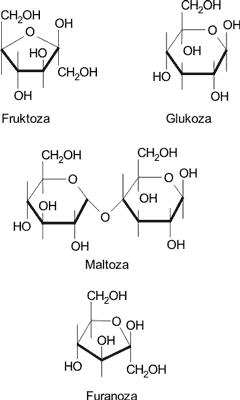
Ryc. 5. Cukry redukujące występujące w największej ilości w pyłku kwiatowym.
W pyłku kwiatowym cukry redukujące występują w ilości od 20,8 do 40,4% (średnio 25,6%) (10, 13-15, 29). Wśród nich w największej ilości występuje fruktoza (średnio w 20,3%) oraz glukoza (średnio w 15,5%) (12, 28, 29). Wzajemny stosunek fruktozy do glukozy (F/G) wynosi średnio 1,29 (12, 14, 15, 29).
Maltoza występuje w pyłku kwiatowym średnio w 2,2%, a turanoza średnio w 0,3% (28, 29).
Cukry nieredukujące
Do cukrów prostych nieredukujących zalicza się występującą w pyłku kwiatowym sacharozę i trehalozę. Średnia zawartość sacharozy kształtuje się na poziomie 4,1% (1, 6, 28, 29), a trehalozy na poziomie 0,4% (29).
Cukry złożone
Informacje na ten temat są dość skąpe. Dobrovoda (7) i Kalinina (16) wspominają o występowaniu w pyłku kwiatowym takich polisacharydów jak dekstryny, skrobia, celuloza i pollenina (składnik zewnętrznej okrywy ziarna pyłku – egzyny). Szczęsna (29) podaje, że według różnych autorów zawartość skrobi w pyłku kwiatowym może wahać się od 2 do 17%.
Bouveng (30) stwierdził, że w wewnętrznej okrywie ziarna pyłku (intynie) sosny górskiej ( Pinus mugo) występuje glikoproteina zwana arabinogalaktanem. Duże ilości tego cukru złożonego (ponad 20%) stwierdzono ponadto w pyłku trawy o nazwie tymotka ( Phleum pratense) (31).
Związki fenolowe i triterpenowe
W pyłku kwiatowym występują liczne związki fenolowe, do których zalicza się flawonoidy, leukoantocyjanidyny, katechiny i kwasy fenolowe, a także związki triterpenowe, kanabinoidy i alkaloidy pirolizydynowe.
O ile związki fenolowe występujące w pyłku kwiatowym wykazują szerokie spektrum działania biologicznego na organizm, m.in. wzmacniające naczynia włosowate, przeciwzapalne, przeciwmiażdżycowe, ochraniające przed promieniowaniem jonizującym, przeciwutleniające, żółciopędne, moczopędne, przeciwnowotworowe i inne, to kanabinoidy i alkaloidy pirolizydynowe działają szkodliwie na organizm. Pierwsze z nich działają głównie halucynogennie, a drugie uszkadzają tkankę wątrobową i wywołują nowotwory.
Flawonoidy
Charakterystyczną cechą pyłku kwiatowego jest występowanie w nim związków flawonoidowych w połączeniu z cukrami, w tak zwanej formie glukozydowej. W polskim (32), słowackim (7), białoruskim (6) i meksykańskim (36) pyłku kwiatowym często występuje rutyna (rutozyd), to jest 3-rutynozyd kwercetyny (ryc. 6).
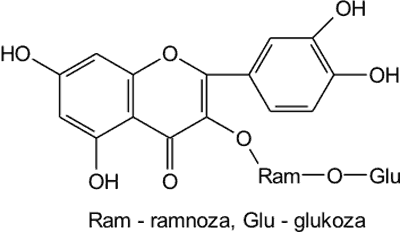
Ryc. 6. Rutyna (3-rutynozyd kwercetyny).
Ogólna zawartość flawonoidów (zarówno form glukozydowych, jak i aglikonów) mieści się w pyłku kwiatowym w dość szerokich granicach. Szapiro i wsp. (6) podają zakres od 0,15 do 2,60% (średnio 1,1%), Kędzia i wsp. (32) podają zakres od 0,21 do 0,29% (średnio 0,25%), a Campos i wsp. (34) zakres od 0,08 do 2,79% (średnio 0,83%).
Szapiro i wsp. (6) z Białorusi najmniej flawonoidów wykryli w pyłku kwiatowym pochodzącym z gryki, wierzby i mniszka (<0,5%), a najwięcej w pyłku pozyskiwanym z koniczyny, gruszy i tawuły (>1,8%). Z kolei Campos i wsp. (34) wykryli w pyłku roślin pochodzących z Portugalii i Nowej Zelandii, takich jak Knightia excelsa, Ulex europeus, Ixerba brexioides i Raphanus raphanistrum poniżej 0,5% flawonoidów, natomiast w Eucalyptus globulus ich zawartość osiągała poziom 2,8%.
Poza 3-rutynozydem kwercetyny, spotyka się także inne pochodne glukozydowe tego aglikonu, a mianowicie 3-O-glukozyd kwercetyny, 3,7-O-diglukozyd kwercetyny (6) oraz 3-soforozyd kwercetyny (36, 37). Z innych połączeń glukozydowych warto wymienić: 7-O-glukozyd apigeniny (32, 36), 6,8-di-O-glukozyd apigeniny (36), 7-O-glukozyd luteoliny (36), 7-O-β-D-glukozyd genisteiny (6, 36), 3-O-soforozyd kemferolu (35, 37), 3-O-glukopiranozyd kemferolu (astragalina) (6), 3-O-glukozyd kemferolu (6), 3-O-ramnoglukozyd kemferolu (6), 3-rutynozyd kemferolu (6), 3-O-glukozyd izoramnetyny (6), 3-rutynozyd izoramnetyny (6) oraz 3-O-ramnoglukozyd izoramnetyny (6).
Wśród niekiedy występujących w pyłku kwiatowym samych aglikonów, wymienia się kwercetynę, kemferol, 6-metylokemferol i luteolinę (6, 32, 38).
Leukoantocyjanidyny i katechiny
Dane na temat zawartości tych związków w pyłku kwiatowym podają badacze białoruscy (6) i ukraińscy (1). Badania obejmujące pyłek kwiatowy pozyskany z 25 roślin pyłkodajnych dla pszczół wskazują, że leukoantocyjanidyny występują w nim w granicach 0,08-0,77% (średnio 0,27%). Najmniej tych związków stwierdzono w pyłku z tawuły i łubinu żółtego (<0,1%), najwięcej w pyłku z chabra bławatka i koniczyny łąkowej (>0,5%).
Katechiny występowały w pyłku kwiatowym w mniejszych ilościach, a mianowicie w granicach od 0,04 do 0,16% (średnio 0,09%). Najmniej omawianych związków stwierdzono w pyłku z mniszka lekarskiego i koniczyny łąkowej (<0,05%), a najwięcej w pyłku z łubinu żółtego i tawuły (>0,12%).
Kwasy fenolowe
Dane Szapiro i wsp. (6) wskazują, że w pyłku kwiatowym pochodzącym z 25 roślin pyłkodajnych dla pszczół stwierdzono od 0,06 do 0,80% kwasów fenolowych (średnio 0,19%). Wśród nich wykryto głównie kwas chlorogenowy (ryc. 7) (wraz z izomerami izo- i neo-), oraz kwasy: p-kumarowy i ferulowy. Najmniej kwasów fenolowych występowało w pyłku z rdestu wężownika, lucerny siewnej i chabra bławatka (<0,08%), a najwięcej w pyłku z wiśni zwyczajnej oraz wierzby iwy i wierzby kruchej (>0,4%).
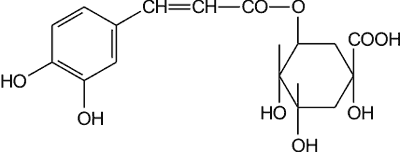
Ryc. 7. Kwas chlorogenowy.
Kędzia i wsp. (32, 33) w etanolowych wyciągach z pyłku kwiatowego również stwierdzili obecność kwasów: chlorogenowego, izochlorogenowego i neochlorogenowego. Natomiast Kołoczek i wsp. (38) w wyciągach etanolowych z pyłku kwiatowego wykryli obecność kwasu ferulowego.
W pyłku meksykańskiej rośliny Ranunculus petiolaris (36) znaleziono pochodną kwasu galusowego, a w pyłku brazylijskim trzy pochodne kwasu p-kumarowego (39).
Związki triterpenowe
Szapiro i wsp. (6), Szemietkow i wsp. (12) oraz Tichonov i wsp. (1) donoszą o występowaniu w pyłku kwiatowym związków triterpenowych. Najczęściej są to wielopierścieniowe kwasy organiczne i alkohole, a także produkty ich glikozydacji.
Związki triterpenowe, głównie kwas ursolowy i oleanolowy, stwierdzono w pyłku kwiatowym pozyskanym z łubinu żółtego, koniczyny łąkowej, wierzby iwy, mniszka lekarskiego, jabłoni, gryki zwyczajnej i chabra bławatka (6).
Charakteryzują się one różnorodnym działaniem biologicznym, m.in. podwyższają odporność organizmu na niekorzystne warunki środowiska zewnętrznego (działanie adaptogenne), uszczelniają naczynia włosowate, rozszerzają naczynia wieńcowe, wykazują działanie przeciwzapalne i przeciwnowotwo-rowe. Związki triterpenowe pyłku kwiatowego nie zostały dotąd szerzej przebadane.
Kanabinoidy
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Tichonow Al, Sodzawicznyj K, Tichonowa SA i wsp. Pylca cwietocznaja (obnożka pczelinaja) w farmacii i medicinie. Charkow: Izd Originał; 2006. 2. Adamski R, Kodym A, Biegańska J. Analiza frakcji białkowej mleczka pszczelego oraz obnóża pyłkowego. Herba Pol 1978; 24:223-31. 3. Wachonina TW, Bodrowa RN. O charakteristikie pylcy. Pczełowodstwo 1979; Nr 2:27-8. 4. Wachonina TW, Bodrowa RN. O charakteristikie pylcy. Pczełowodstwo 1979; Nr 3:27-8. 5. Donadieu Y. Le pollen. Paris: Libraire Maloine S.A. Éditeur; 1983. 6. Szapiro DK, Bandjukowa WA, Szemietkow MF. Pylca rastenij – koncentrat biołogiczeski aktiwnych wieszczestw. Minsk: Nauka i Technika; 1985. 7. Dobrovoda I. Včelie produkty a zdravie. Bratislava: Priroda; 1986. 8. Zalewski W, Kosson R. Zawartość aminokwasów oraz białka w pierzdze i w obnóżach zebranych w kilku miejscowościach w Polsce. V Międzynar Symp Apiter. Zagadnienia wybrane. Kraków-Kamianna: Wyd Pol Zw Pszczel; 1986 s.167-70. 9. Syrocka K, Zalewski W. Zawartość azotu ogólnego oraz niektórych frakcji białek w obnóżach i w pierzdze. V Międzynar Symp Apiter. Zagadnienia wybrane. Kraków-Kamianna: Wyd Pol Zw Pszczel; 1986 s.152-6. 10. Alfanderi R. Właściwości pyłku pszczelego. Apipol – Inf Reg Zrzesz Pszczel 1986; Nr 3:17-8. 11. Poczinkowa P. Pczelnite produkti w medicinata. Sofia: Izd Bołg Akad Nauk; 1986. 12. Szemietkow MF, Szapiro DK, Danusewicz IK. Produkty pczełowodstwa i zdorowie czełowieka. Minsk: Uradżaj; 1987. 13. Iannuzzi J. Pollen: food for honey bee – and man? Am Bee J 1993; 133:557-63. 14. Szczęsna T, Rybak-Chmielewska H. Porównawcze badania składu obnóży pyłkowych z różnych krajów (Polski, Korei i Chin). XXXV Nauk Konf Pszczel. Puławy: 1998; s.76-7. 15. Szczęsna T, Rybak-Chmielewska H. Some properties of honeybee-collected pollen. Pszczeln Zesz Nauk 1998; 42, Nr 2:79-80. 16. Kalinina IG. Rol pylcy (obnóżki) w apiterapii. Mat III Zizdu Apiterapewt Ukrainy. Charkiw: Zołoti Storinki; 2006. s.315-22. 17. Almeida-Muradian LB, Pamplona LC, Coimbra S et al. Chemical composition and botanical evaluation of dried bee pollen pellets. J Food Comp Anal 2005; 18:105-11. 18. Szczęsna T, Rybak-Chmielewska H. Skład aminokwasowy pyłku kwiatowego z różnych gatunków roślin. XXXVI Międzynar Nauk Konf Pszczel. Puławy: 1999; s.100-1. 19. Szczęsna T. Protein content and amino acid composition of bee-collected pollen from selected botanical origins. J. Apicult Sci 2006; 50, Nr 2:81-9. 20. Szczęsna T. Protein content and amino acid composition of bee-collected pollen originating from Poland, South Korea and China. J Apicult Sci 2006; 50, Nr 2:91-9. 21. Zorja BP, Birjuk IA, Skripnikowa WW. Koliczestwiennoje opredelenje summy aminokisłot w pczelinoj obnożkie. Apiterapia i pczełowodstwo. Wilnjus: Alna Litera; 1993. 22. Mondal AK, Parui S, Mandal S. Analysis of the free amino acid content in pollen of nine Asteraceae species of known allergenic activity. Ann Agric Environ Med 1998; 5:17-20. 23. Jog SP, et al. Alkaline phytase from lily pollen: Investigation of biochemical properties. Arch Bioch Biophys 2005; 440:133-40. 24. Szczęsna T. Long-chain fatty acids composition of honeybee – collected pollen. J Apicult Sci 2006; 50, Nr 2:65-79. 25. Seppänen T, et al. An analytical study on fatty acids in pollen extract. Phytother Res 1989; 3:115-6. 26. Manning R. Fatty acids in pollen: a review of their importance for honey bees. Bee World 2001; 82, Nr 2:65-75. 27. Takatsuto S, Omote K, Kitsuwa T. Phytosterol composition of the pollen of buck wheat, Fagopyrum esculentum. Agric Biol Chem 1989; 53:2277-8. 28. Szczęsna T, Rybak-Chmielewska H. Chmielewski W. Aktualne wiadomości o obnóżach pyłkowych. Pszczelarstwo 1997; Nr 11: 5-7. 29. Szczęsna T. Study on the sugar composition of honeybee-collected pollen. J Apicult Sci 2007; 51, Nr1:15-21. 30. Bouveng HO. Polysaccharide in pollen. II. The xylogalacturonan from Mountain pine ( Pinus mugo Turra) pollen. Acta Chem Scand 1965; 19:953-63. 31. Brecker L, et al. Structural and immunological properties of arabinogalactan polysaccharides from pollen of timothy grass ( Phleum pratense L.). Carbohydr Res 2005; 340:657-63. 32. Kędzia B, i wsp. Ocena przeciwzapalnego działania propolisu i pyłku kwiatowego. XXXII Nauk Konf Pszczel. Puławy: 1999 s. 34-35. 33. Kędzia B, i wsp. Badania nad dekontaminacją mikrobiologiczną pyłku kwiatowego za pomocą energii jonizującej. XXXVII Nauk Konf Pszczel. Puławy: 2000. s. 51-2. 34. Campos MG, Webby RF, Markham KR et al. Age-induced diminution of free radical scavenging capacity in bee pollens and the contribution of constituent flavonoids. J Agric Food Chem 2003; 51:742-5. 35. Wei JX, et al. Studies on the chemical components of bee´s pollen from buckwheat ( Fagopyrum esculentum Moench). J Clin Mater Med 1990; 15:293-5. 36. Arraez-Roman D, et al. Identification of phenolic compounds from pollen extracts using capillary electrophoresis-electrospray time-offlight mass spectrometry. Anal Bioanal Chem 2007; 389:1909-17. 37. Ross SA, El Sohly MA, Sultana GNN et al. Flavonoid glycosides and cannabinoids from the pollen of Cannabis sativa L. Phytochem Anal 2005; 16:45-8. 38. Kołoczek H, i wsp. Ocena przydatności pyłku pszczelego jako komponentu do produkcji żywności i parafarmaceutyków. Projekt badawczy. Brzączowice: Zrzesz Pszczel Apipol; 2005. 39. Ohta S, et al. Antioxidant hydroxycinnamic acid derivatives isolated from Brazilian bee pollen. Nat Prod Res 2007; 21:726-32. 40. Boppre M, Colegate SM, Edgar JA. Pyrrolizidine alkaloids of Echium vulgare honey found in pure pollen. J Agric Food Chem 2005; 53:594-600. 41. Prakash AS, et al. Pyrrolizidine alkaloids in human diet. Mutat Res 1999; 443:53-67. 42. Jabłoński B. Surowce zbierane przez pszczoły. Pyłek kwiatowy. [W:] Prabucki B, red. Pszczelnictwo. Szczecin: Wyd Prom Albatros; 1998. s. 816-20. 43. Gekeler W. Pszczoły. Poradnik hodowcy. Warszawa: Wyd RM; 2007. s. 103-5. 44. Vivino AE, Palmer LS. The chemical composition and nutritional value of pollens collected by bees. Ind Eng Chem Anal Ed 1945; 17:129-36. 45. Szapiro DK, i wsp. O biołogiczeski aktiwnych wieszczestwach pylcy. Pczełowodstwo 1979; Nr 2:26-7. 46. Szczęsna T. Projekt międzynarodowej normy dla pyłku pszczelego. Pasieka 2004; Nr 4:49. 47. Czeczuga B. Zawartość karotenoidów w pyłku i w organizmach pszczół robotnic odwiedzających kwiaty różnych roślin. V Międzynar Symp Apiter. Zagadnienia wybrane. Kraków-Kamianna: Wyd Pol Zw Pszczel; 1986. s. 19-23. 48. Bornus L, red. Encyklopedia pszczelarska. Warszawa: PWRiL; 1989. s. 181-2. 49. Szczęsna T, Rybak-Chmielewska H. Obnóża pyłkowe źródłem witamin. Pszczelarstwo 1993; Nr 2, 5. 50. Szczęsna T. Concentration of selected elements in honeybee-collected pollen. J Apicult Sci 2007; 51, Nr 1:5-13. 51. Zalewski W, Szymaniuk J. Pierwiastki śladowe w obnóżach i w pierzdze zebranej w Polsce. V Międzynar Symp Apiter. Zagadnienia wybrane. Kraków-Kamianna: Wyd Pol Zw Pszczel; 1986. s. 171-4. 52. Zeng Z, Yan W. Producing specific high mineral content pollen. Am Bee J 2004; 44:520-1. 53. Zalewski W, Szymaniuk J. Zawartość pierwiastków śladowych w obnóżach i pierzdze. Pszczelarstwo 1985; Nr 10:3-5. 54. Bandjukowa WA, i wsp. Chimiczeskij sostaw i gipolipidemiczeskije swojstwa pylcy (obnóżki) jabłon. II Resp Konf Med Bot. Tezusy dokładow. Kiew: 1988. s 190-1. 55. Mowszowicz J. Pyłek kwiatowy roślin zielarskich. Wiad Ziel 1986; Nr 5:12-3. 56. Gałuszka H, Gwizdek E. Pyłek kwiatowy (obnóża pszczele) jako naturalne źródło biopierwiastków. V Międzynar Symp Apiter. Streszczenia referatów. Kraków: 1985. s. 32. 57. Zalewski W, Szymaniuk J. Pierwiastki śladowe w pyłku pszczelim i pierzdze Polski. V Międzynar Symp Apiter. Streszczenia referatów. Kraków: 1985. s.32. 58. Trzybiński S. Pyłek i jego skład. Pszczel Pol 2005; Nr 12:18-9. 59. Rybak-Chmielewska H. Produkty pszczele. Pyłek kwiatowy (obnóża). W: Prabucki B, red. Pszczelnictwo. Szczecin: Wyd Prom Albatros: 1998. s. 583-8. 60. Szczęsna T, Rybak-Chmielewska H. Chmielewski W. Pyłek kwiatowy (obnóża) – naturalna odżywka i surowiec farmaceutyczny. Puławy: Wyd Oddz Pszczel ISK; 1999. 61. Szczęsna T, Rybak-Chmielewska H. Pyłek kwiatowy (obnóża) – niektóre aspekty jego zanieczyszczenia metalami ciężkimi. Puławy: Wyd Oddz Pszczel ISK; 2000.







