© Borgis - Postępy Fitoterapii 4/2008, s. 207-224
*Tadeusz Wolski, Agnieszka Ludwiczuk, Tomasz Baj, Kazimierz Głowniak
Rodzaj Panax – systematyka, skład chemiczny, działanie i zastosowanie oraz analiza fitochemiczna nadziemnych i odziemnych organów żen-szenia amerykańskiego – Panax quinquefolium L. Metody ekstrakcji i analizy związków fenolowych. Cz. III.
GENUS PANAX. TAXONOMY, CHEMICAL COMPOSITION, PHARMACOLOGICAL EFFECTS, MEDICINAL APPLICATION AND PHYTOCHEMICAL ANALYSIS OF AERIAL AND UNDERGROUND PARTS OF AMERICAN GINSENG (PANAX QUINQUEFOLIUM L.). METHOD OF EXTRACTION AND DETERMINATION OF PHENOLIC COMPOUNDS. PART III
Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, Uniwersytet Medyczny, Lublin
Kierownik Katedry i Zakładu: prof. dr hab. Kazimierz Głowniak
Summary
In presented work the characteristic of phenolic compounds and their pharmacological action and application were shown. The work contains own research concerning methods of extraction and analysis of fraction of phenolic compounds: phenolic acids, flavonoids and tannins which occurred in Panax quinquefolium L. In presented work procedures of obtaining phenolic compounds extracts in by solid–fluid and fluid–fluid methods and their qualitative and quantitative analysis were examined. The qualitative analysis was performed by chromatographic methods TLC and HPLC, quantitative analysis of phenolic acids, flavonoids and tannins was performed by spectroscopic methods, whereas analysis of fraction of tannins by titrimetric-weight method. The quantitative analysis of fenolic compounds revealed that both leaves and roots of Panax quinquefolium are characterized by high content tannins fraction (roots 11.3%, leaves 9.9%). However content of phenolic acids concerns mainly leaves, in which content of these compounds are about 0.2%. The content of phenolic acids was not very high about 0.1%. The analysis of fraction of fenolic compounds shown presence of rutin in the roots and hyperoside, quercetin and isorhamnetin-3-rutinoside in the leaves. Among flavonoids aglycones the isorhamnetin in the leaves and kaempferol and quercetin in the roots were identified. The TLC i HPLC analysis of spare phenolic acids present in the examined raw material shown presence of protocatechuic and salicylic acids, while after hydrolyse (acid and alkaline) some acids: protocatechuic, p-coumaric, ferulic, salicylic and p-hydroxybenzoic and caffeic acid in the roots and in the leaves were identified. The qualitative analysis of tannins fraction were not shown in both both leaves and roots presence of condensed tannins. The chromatographic analysis of tannins fraction after acid hydrolyse were showed shown in both leaves and roots presence of protocatechuic, gentisic, p-coumaric and ferulic acids, and additionally in the leaves p-hydroxybenzoic acid.
Key words: panax quinquefolium,
american ginseng,
phenolic acids,
flavonoids,
tanins,
qualitative analysis,
quantitative analysis,
extraction methods,
uae,
ase,
tlc,
oplc.

Niniejsza praca jest kontynuacją badań dotyczących rodzaju Panax opisanych w poprzednich publikacjach (1, 2), w których przedstawiono ogólne wiadomości o badanym surowcu, w tym pochodzenie i rys historyczny żeń-szenia, charakterystykę botaniczną gatunku oraz uprawę Panax quinquefolium L. Ponadto w cz. I pracy (1) opisano charakterystykę ważniejszych grup związków biologicznie czynnych występujących w rodzaju Panax, tj. ginsenozydów, saponin triterpenowych, poliacetylenów, związków fenolowych oraz innych związków biologicznie czynnych występujących w żeń-szeniu. Ważną częścią poprzedniej pracy (1) jest opis działań leczniczych i zastosowań żeń-szenia oraz jego preparatów, ze szczególnym uwzględnieniem oddziaływania na układ nerwowy, hormonalny oraz sercowo-naczyniowy. W tej części przedstawiono również przegląd piśmiennictwa dotyczącego działania przeciwnowotworowego, przeciwgrzybiczego i przeciwwirusowego, a także wpływ żeń-szenia i jego przetworów na układ odpornościowy, oddechowy oraz gospodarkę cukrową, a także działanie ochronne na wątrobę.
Część II pracy (2) dotyczyła metod ekstrakcji i analizy ginsenozydów występujących w rodzaju Panax quinquefolium L. W tej części opisano przegląd piśmiennictwa dotyczący metod otrzymywania, ekstraktację ginsenozydów następującymi metodami: Soxhleta, ekstrakcję cieczą ASE, ekstrakcję wspomaganą mikrofalami (MAE), ekstrakcję przy użyciu płynów w stanie nadkrytycznym (SFE) oraz ekstrakcję metodą Extrelut. Dokonano również przeglądu piśmiennictwa dotyczącego metod analizy ginsenozydów. Oprócz przeglądu literaturowego metod ekstrakcji wykonano również badania własne nad wyodrębnieniem frakcji ginsenozydów różnymi metodami. Analizę jakościową i ilościową prowadzono metodami chromatograficznymi: TLC, HPTLC, OPLC i HPLC.
Charakterystyka związków fenolowych
Związki fenolowe stanowią zróżnicowaną grupę produktów o często niewyjaśnionej funkcji. Wszystkie one mają pierścień aromatyczny zawierający grupę hydroksylową (fenolową) i inne podstawniki, takie jak grupa karboksylowa i metoksylowa. Podstawniki te nadają związkom fenolowym charakter polarny, ułatwiający rozpuszczalność w środowisku wodnym. Biogenetycznie większość związków fenolowych wywodzi się od fenyloalaniny i tyrozyny, które powstają z fosforanu erytozy oraz kwasu fosfoenolopirogronowego, w wyniku reakcji kwasu szikimowego. Inne związki powstają jako produkty aktywności szlaku kwasu malonowego. Związki fenolowe dzieli się zazwyczaj na proste fenole (fenolokwasy) i ich pochodne – taniny (garbniki), flawonoidy i izoflawony (3).
Pod względem farmakologicznym pochodne fenolowe są ważnym źródłem związków o aktywności przeciwutleniającej (obok znanych substancji o silnych właściwościach przeciwutleniających witamin: A, C, E i karotenów), nawet często przewyższającej aktywność witaminy E (4, 5).
Do roślinnych związków fenolowych o dużej aktywności przeciwutleniającej należą: flawonoidy, fenolokwasy oraz taniny i garbniki. Powszechnie występują one między innymi w postaci glikozydów, które są rozpuszczalne w wodzie. Stwarza to możliwość ich stosowania jako przeciwutleniaczy w środowisku wodnym w przeciwieństwie do witaminy E lub karotenów, które działają w środowisku o charakterze hydrofobowym. Jest to o tyle istotne, że błony komórkowe, jako naturalne układy biologiczne, występują w środowisku wodnym, w którym często powstają wolne rodniki tlenowe, np. rodnik hydroksylowy OH*. Związki fenolowe, jako tzw. wymiatacze wolnych rodników, eliminują je ze środowiska wodnego, nie dopuszczając do inicjacji bardzo szkodliwego procesu degradacji lipidów (5).
Materiał i metody
Surowiec do badań stanowiły liście i korzenie żeń-szenia pięciolistnego Panax quinquefolium L. zebrane w III i IV roku wegetacji z plantacji w Fajsławicach. Materiał roślinny wysuszono w miejscu zaciemnionym i przewiewnym.
Wyodrębnianie frakcji fenolokwasów i flawonoidów
W celu wyizolowania zespołu związków fenolowych (fenolokwasów i flawonoidów) z liści i korzeni żeń-szenia amerykańskiego przeprowadzono ekstrakcję typu ciecz-ciało stałe w aparatach Soxhleta, a następnie ekstrakcję typu ciecz-ciecz (6-8).
Sporządzono dwie gilzy z bibuły filtracyjnej, umieszczając w jednej naważkę suchych sproszkowanych liści o masie 50 g, a w drugiej naważkę sproszkowanych korzeni o tej samej masie. Następnie gilzy umieszczono w aparatach Soxhleta i ekstrahowano chloroformem w celu usunięcia związków balastowych. Wyciąg chloroformowy odrzucono, a surowce poddano wyczerpującej ekstrakcji metanolem w temperaturze wrzenia rozpuszczalnika. Otrzymane wyciągi metanolowe zagęszczono przez oddestylowanie rozpuszczalnika przy użyciu wyparki obrotowej, a pozostałości wytrawiono gorącą wodą (100 ml) i pozostawiono w lodówce na dobę. Otrzymane wyciągi wodne przesączono i ekstrahowano 10-krotnie eterem dietylowym w porcjach po 10 ml. Wyciągi eterowe zagęszczono i wytrząsano z 5% roztworem wodorowęglanu sodu (5x10 ml). Warstwy eterowe zawierające wolne aglikony flawonoidowe oddestylowano do sucha i rozpuszczono w 10 ml metanolu. Warstwy wodno-wodorowęglanowe zakwaszono kwasem solnym do pH 3 i ponownie ekstrahowano eterem dietylowym (10x10 ml). Wyciągi eterowe osuszono bezwodnym siarczanem sodu i przesączono. Rozpuszczalnik oddestylowano uzyskując frakcje wolnych kwasów fenolowych, które rozpuszczono w 10 ml metanolu.
Pozostałe po ekstrakcji eterem dietylowym wyciągi wodne ekstrahowano porcjami octanu etylu (10x10 ml), zbierając warstwę organiczną. Połączone frakcje osuszono bezwodnym siarczanem sodu, przesączono i oddestylowano rozpuszczalnik przy użyciu wyparki obrotowej. Uzyskane frakcje glikozydów flawonoidowych rozpuszczono w 10 ml metanolu.
Schemat procedur wyodrębniania wolnych kwasów fenolowych i związków flawonoidowych z liści i korzeni Panax quinquefolium przedstawia rycina 1.
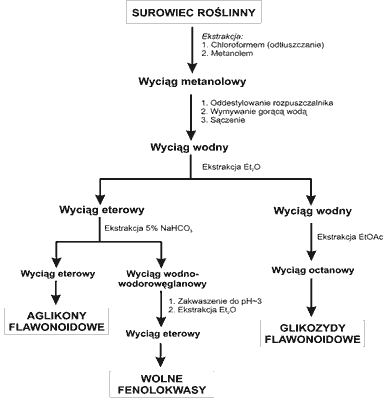
Ryc. 1. Schemat izolacji fenolokwasów i flawonoidów z liści i korzeni żeń-szenia amerykańskiego.
Wyciągi wodne pozostałe po ekstrakcji octanem etylu podzielono następnie na dwie równe części, z których jedną poddano hydrolizie kwaśnej, a drugą hydrolizie zasadowej, w celu uwolnienia związków fenolowych z połączeń glikozydowych (ryc. 2).
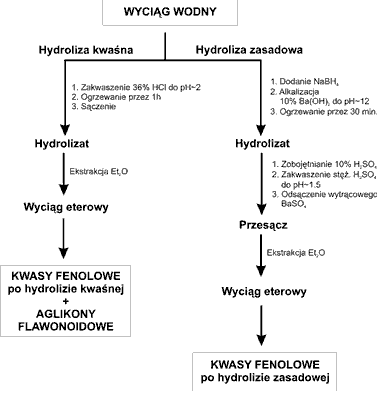
Ryc. 2. Schemat procedur hydrolitycznych zastosowanych w celu uwolnienia fenolokwasów i flawonoidów związanych glikozydowo.
Hydroliza kwaśna
Połowę wyciągu wodnego zakwaszono 36% HCl do pH ~ 2 i ogrzewano na wrzącej łaźni wodnej pod chłodnicą zwrotną przez 1 godz. Po tym czasie hydrolizat ostudzono, przesączono i ekstrahowano eterem dietylowym (10x10 ml). Połączone wyciągi eterowe osuszono bezwodnym Na2SO4, przesączono, po czym rozpuszczalnik oddestylowano do sucha. Uzyskane frakcje związków fenolowych (fenolokwasów i flawonoidów) uwolnionych po hydrolizie kwaśnej rozpuszczono w 10 ml metanolu.
Hydroliza zasadowa
Do drugiej części wyciągu wodnego dodano 1 g NaBH4, a następnie mieszaninę doprowadzono do pH ~12 przy pomocy 10% roztworu wodorotlenku baru i ogrzewano pod chłodnicą zwrotną przez 30 min. Hydrolizat ostudzono, zobojętniono 10% kwasem siarkowym, a następnie zakwaszono do pH ~1,5 stężonym kwasem siarkowym. Wytrącony osad siarczanu baru odsączono, a otrzymany przesącz poddano 10-krotnej ekstrakcji eterem dietylowym (porcje po 10 ml). Zebrane warstwy organiczne połączono, osuszono bezwodnym siarczanem sodu i po przesączeniu rozpuszczalnik oddestylowano przy użyciu wyparki obrotowej uzyskując frakcję kwasów fenolowych uwolnionych po hydrolizie zasadowej. Uzyskane frakcje rozpuszczono w 10 ml metanolu.
Wyodrębnianie frakcji tanin i garbników
W celu wyizolowania frakcji tanin i garbników z liści i korzeni żeń-szenia pięciolistnego, sporządzono wyciągi wodne stosując klasyczną ekstrakcję typu ciecz-ciało stałe. Otrzymane wyciągi ekstrahowano w układzie ciecz-ciecz porcjami octanu etylu (10x10 ml). Zebrane warstwy organiczne osuszono bezwodnym Na2SO4, a następnie rozpuszczalnik oddestylowano przy użyciu wyparki obrotowej. Suchą pozostałość rozpuszczono w 10 ml metanolu (9).
W celu wyodrębnienia frakcji kwasów fenolowych – podstawowych składników garbników hydrolizujących – przeprowadzono hydrolizę kwaśną surowca. 10 g korzeni i liści żeń-szenia umieszczono w kolbach okrągłodennych o pojemności 500 ml, dodano po 200 ml 4% roztworu kwasu siarkowego, po czym ogrzewano na wrzącej łaźni wodnej, pod chłodnicą zwrotną przez 4 godziny. Po tym czasie hydrolizaty ostudzono, przesączono i ekstrahowano eterem dietylowym (10x10 ml). Połączone wyciągi eterowe osuszono bezwodnym Na2SO4, przesączono, po czym rozpuszczalnik oddestylowano do sucha. Suchą pozostałość rozpuszczono w 10 ml metanolu (9).
Analiza ilościowa związków fenolowych
Analiza ilościowa obejmowała oznaczenia zawartości fenolokwasów, flawonoidów oraz garbników. Fenolokwasy i flawonoidy oznaczano wg FP VI (10), zaś garbniki metodą miareczkowo-wagową opisaną w FP IV (11).
Ocena składu jakościowego związków fenolowych metodą chromatografii cienkowarstwowej
Próbki na płytki chromatograficzne nanoszono autosamplerem ATS 3 (Camag, Szwajcaria). Wizualizację oraz detekcję związków na płytkach TLC prowadzono przy użyciu wideoskanera Reprostar 3 (Camag, Szwajcaria) oraz densytometru TLC Scaner III (Camag, Szwajcaria).
Analiza TLC fenolokwasów
Analizie chromatograficznej poddano frakcje wolnych fenolokwasów oraz uwolnionych w wyniku hydrolizy kwaśnej i zasadowej (ryc. 1 i 2), wyizolowane z liści i korzeni żeń-szenia pięciolistnego. Jednocześnie przygotowano roztwory wzorcowe kwasów fenolowych o stężeniu 0,2 mg/ml.
Badania TLC prowadzono na płytkach szklanych (10x20 cm), foliach aluminiowych (20x20 cm) pokrytych żelem krzemionkowym GF254 oraz na płytkach szklanych pokrytych celulozą (10x20 cm) w komorach pionowych. Do rozdziału chromatograficznego zastosowano następujące układy rozwijające:
– dla płytek pokrytych żelem krzemionkowym GF254:
1. toluen – mrówczan etylu – kwas mrówkowy, 5+4+1 (v/v) (12-14),
2. benzen – metanol – kwas octowy, 48+8+4 (v/v) (12),
3. octan etylu – keton etylo-metylowy – kwas mrówkowy – woda, 5+2+2+1 (v/v) (15),
4. toluen – acetonitryl, 5+5 (v/v) (12,14),
5. toluen – acetonitryl – kwas mrówkowy, 5+4+1 (v/v) (12),
6. toluen – dioksan – kwas mrówkowy, 7+2+1 (v/v) (16),
7. eter diizopropylowy – heptan – kwas mrówkowy, 5+4+1 (v/v) (17,14).
– dla płytek pokrytych celulozą:
8. mrówczan sodu – kwas mrówkowy – woda, 10+1+200 (v/v) (18,13).
Po rozwinięciu chromatogramy umieszczono pod lampą UV (λ=254 i λ=365 nm) zaznaczając fluoryzujące plamy. Następnie chromatogramy wywoływano przez spryskiwanie zdiazowanym kwasem sulfanilowym (1 g kwasu sulfanilowego w 1000 ml wody + 10 ml 36% HCl + 1 g azotynu sodu w 100 ml roztworu) a następnie 20% roztworem węglanu sodu. Identyfikację fenolokwasów prowadzono porównując współczynniki Rf plam fenolokwasów zawartych w analizowanych próbkach z wartościami współczynników Rf substancji wzorcowych.
Analiza TLC flawonoidów
Chromatografię cienkowarstwową wyodrębnionych frakcji zawierających związki flawonoidowe prowadzono na płytkach szklanych oraz foliach aluminiowych (10x20 cm; 20x20 cm) pokrytych żelem krzemionkowym GF254. Płytki rozwijano w następujących fazach ruchomych:
1. toluen – mrówczan etylu – kwas mrówkowy, 5+4+1 (v/v) (12-14),
2. benzen – metanol – kwas octowy, 48+8+4 (v/v) (12),
3. octan etylu – kwas mrówkowy – woda, 9+1+1 (v/v) (10, 14),
4. butanol – kwas octowy – woda, 4+1+1 (v/v) (12),
5. octan etylu – kwas mrówkowy – kwas octowy – woda, 100+11+11+26 (v/v) (14, 19),
6. chloroform – kwas octowy – metanol – woda, 60+32+12+8 (v/v) (19),
7. octan etylu – keton metylo-etylowy – woda – kwas mrówkowy, 5+3+1+1 (v/v) (20).
Po rozwinięciu chromatogramy oglądano pod lampą UV (λ=254 nm i λ=365 nm), a następnie spryskiwano odczynnikiem Naturstoffa (A: 1% roztwór odczynnika Naturstoffa w metanolu; B: 5% roztwór PEG 4000 w metanolu) i oglądano w świetle UV λ=366 nm. Identyfikację flawonoidów prowadzono porównując współczynniki Rf plam związków flawonoidowych zawartych w analizowanych próbkach z wartościami współczynników Rf substancji wzorcowych.
Analiza TLC tanin i garbników
Analizę jakościową TLC frakcji zawierających związki garbnikowe oraz kwasy fenolowe uwolnione z połączeń garbnikowych w wyniku hydrolizy kwaśnej, wykonano na płytkach o wymiarach 10x20 cm oraz 20x20 cm pokrytych żelem krzemionkowym GF254 i celulozą przy wykorzystaniu techniki jednokierunkowej. Identyfikację prowadzono przez porównanie wartości Rf związków występujących w badanych frakcjach z wartościami Rf dostępnych wzorców. W procesie rozdzielania wykorzystano następujące fazy ruchome:
– dla płytek pokrytych żelem krzemionkowym GF254:
1. toluen – mrówczan etylu – kwas mrówkowy, 5+4+1 (v/v) (12, 14),
2. octan etylu – kwas mrówkowy – woda – heksan, 9+0,5+0,5+0,15 (v/v) (14, 19),
3. chloroform – octan etylu – kwas mrówkowy, 5+4+1, (v/v) (21),
4. toluen – dioksan – kwas mrówkowy, 7+2+1, (v/v) (16),
5. octan etylu – kwas mrówkowy – kwas octowy – woda, 100+11+11+26 (v/v) (14, 19),
6. eter diizopropylowy – heptan – kwas mrówkowy, 5+4+1 (v/v) (17).
– dla płytek pokrytych celulozą:
7. woda – dioksan, 10+1 (v/v) (12),
8. benzen – kwas octowy – woda, 6+7+3 (v/v) (22).
Rozwinięte chromatogramy obserwowano w świetle UV (λ=254 nm i λ=365 nm), a następnie spryskiwano odczynnikiem Godina (5% roztwór H2SO4 w etanolu i 1% roztwór waniliny w etanolu) w przypadku garbników katechinowych i zdiazowanym kwasem sulfanilowym (A: 1 g kwasu sulfanilowego w 1000 ml wody + 10 ml 36% HCl + 1 g azotynu sodu w 100 ml roztworu; B: 20% roztwór węglanu sodu) w przypadku garbników hydrolizujących.
Ocena składu jakościowego związków fenolowych metodą wysokosprawnej chromatografii cieczowej
Analizę jakościową HPLC związków fenolowych tj. fenolokwasów, flawonoidów oraz tanin i garbników występujących w częściach nadziemnych i podziemnych żeń-szenia pięciolistnego, wykonano w oparciu o procedury wykorzystujące zoptymalizowane gradientowe warunki rozdzielania. Do badań wykorzystano chromatograf cieczowy 1050 Agilent Technologies (Niemcy) wyposażony w zawór dozujący typu Rheodyne oraz detektor UV. Do archiwizacji danych wykorzystano integrator 3396 (seria II).
Analiza HPLC fenolokwasów oraz tanin i garbników
Rozdzielenie frakcji kwasów fenolowych prowadzono na kolumnie ODS 18c firmy Waters (200x4,6 mm I.D., dp=5 μm), przy szybkości przepływu eluentu 1ml/min. Detekcję prowadzono przy długości fali λ=254 nm. Zastosowano nowoopracowaną gradientową metodę rozdzielania (tab. 1) przy wykorzystaniu dwuskładnikowej fazy ruchomej:
Tabela 1. Profil gradientu zastosowany w analizie HPLC frakcji kwasów fenolowych.
| Czas (min) | %A | %B |
0
10
15
30
45 | 10
10
20
30
10 | 90
90
80
70
90 |
– acetonitryl (A),
– woda z dodatkiem 1% kwasu octowego (B).
Do analizy wykorzystano metanolowe roztwory wzorcowych kwasów fenolowych o stężeniu 0,1 mg/ml. Średnie czasy retencji uzyskane dla wzorcowych substancji w zoptymalizowanych gradientowych warunkach rozdzielania przedstawia tabela 2.
Tabela 2. Średnie czasy retencji wzorcowych fenolokwasów.
| Lp. | Nazwa związku | Średni czas retencji (min) |
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13. | kwas galusowy
kwas protokatechowy
kwas gentyzynowy
kwas p-hydroksybenzoesowy
kwas wanilinowy
kwas kawowy
kwas izowanilinowy
kwas p-kumarowy
kwas ferulowy
kwas m-kumarowy
kwas salicylowy
kwas o-kumarowy
kwas trans-cynamonowy | 3,411
5,706
7,729
9,780
12,305
14,275
14,653
19,305
20,380
20,690
21,392
23,083
30,627 |
Identyfikację związków obecnych we frakcjach wyizolowanych z korzeni i liści żeń-szenia pięciolistnego prowadzono porównując czasy retencji pików związków obecnych na chromatogramach z czasami retencji pików substancji wzorcowych oraz metodą dodatku wzorca do badanej próbki.
Analiza HPLC flawonoidów
Rozdzielanie flawonoidów, podobnie jak kwasów fenolowych, prowadzono na kolumnie ODS 18c firmy Waters (200x4,6 mm I.D., dp=5 μm), przy szybkości przepływu eluentu 1 ml/min. Detekcję prowadzono przy długości fali λ=270 nm. Zastosowano gradientową metodę rozdzielania (tab. 3) opracowaną na podstawie piśmiennictwa (23) przy wykorzystaniu dwuskładnikowej fazy ruchomej:
Tabela 3. Profil gradientu zastosowany w analizie HPLC frakcji flawonoidów.
| Czas (min) | %A | %B |
0
25
35 | 16
35
40 | 84
65
60 |
– acetonitryl (A),
– woda z dodatkiem 1% kwasu octowego (B).
Identyfikację związków flawonoidowych obecnych w liściach i korzeniach Panax quinquefolium prowadzono w oparciu o czasy retencji substancji wzorcowych oraz metodą dodatku wzorca do badanej próbki. Średnie czasy retencji wzorcowych flawonoidów przedstawia tabela 4.
Tabela 4. Średnie czasy retencji wzorcowych flawonoidów.
| Lp. | Nazwa związku | Średni czas retencji (min) |
1.
2.
3.
4.
5.
6.
7.
8.
9.
10. | izoramnetyna
rutyna
hiperozyd
3-rutynozyd izoramnetyny
kwercytryna
3-glukozyd izoramnetyny
mirycetyna
3-ramnoglukozyd kemferolu
kwercetyna
kemferol | 3,308
7,576
8,555
10,231
11,007
11,298
13,097
16,262
19,445
26,039 |
Wyniki i omówienie
Zawartość procentowa fenolokwasów
Dane dotyczące analizy ilościowej fenolokwasów w różnych organach Panax quinquefolium w III i IV roku uprawy przedstawia tabela 5.
Tabela 5. Procentowa zawartość fenolokwasów w przeliczeniu na kwas kawowy w różnych organach Panax quinquefolium L. w III i IV roku wegetacji (SD dla n=3).
| Rok wegetacji | Zawartość fenolokwasów (%) |
| korzeń | liść | łodyga |
| III | 0,021 ? 0,002 | 0,168 ? 0,005 | 0,073 ? 0,002 |
| IV | 0,021 ? 0,003 | 0,262 ? 0,006 | 0,065 ? 0,008 |
Z danych przedstawionych w tabeli 5 wynika, że średnia zawartość fenolokwasów w korzeniach, liściach i łodygach żeń-szenia w III roku uprawy wynosi odpowiednio: 0,021, 0,168 i 0,073%, zaś w IV roku uprawy: 0,021, 0,262 i 0,065%. Zawartość fenolokwasów w 3- i 4-letnich korzeniach jest identyczna, w przypadku liści wzrosła o ok. 1,5-raza w IV roku wegetacji, natomiast zmalała z 0,073% w łodygach 3-letnich do 0,065% w łodygach 4-letnich.
Zawartość procentowa flawonoidów
Analizę zawartości flawonoidów wykonano w 3- i 4-letnich organach żeń-szenia pięciolistnego. Dane przedstawia tabela 6.
Tabela 6. Procentowa zawartość flawonoidów w przeliczeniu na kwercetynę w różnych organach Panax quinquefolium L. w III i IV roku wegetacji (SD dla n=3).
| Rok wegetacji | Zawartość flawonoidów (%) |
| korzeń | liść | łodyga |
| III | 0,0093 ? 0,0002 | 0,089 ? 0,004 | 0,011 ? 0,002 |
| IV | 0,0093 ? 0,0002 | 0,167 ? 0,010 | 0,038 ? 0,003 |
Jak wynika z tabeli 6 średnia zawartość flawonoidów w korzeniach 3- i 4-letnich jest identyczna i wynosi 0,0093%. Natomiast zawartość flawonoidów w częściach nadziemnych żeń-szenia jest wyższa u roślin w IV roku wegetacji: w przypadku liści o ok. 2 razy, a w przypadku łodyg o ok. 3 razy.
Zawartość procentowa tanin i garbników
Analizę zawartości tanin i garbników w liściach i korzeniach roślin IV letnich przeprowadzono metodą miareczkowo-wagową zgodnie z FP IV (1970). Wyniki przedstawia tabela 7.
Tabela 7. Procentowa zawartość tanin i garbników w liściach i korzeniach żeń-szenia pięciolistnego w IV roku wegetacji (SD dla n=3).
| Badana część rośliny | Zawartość tanin i garbników (%) |
| Liście | 9,937 ? 0,609 |
| Korzenie | 11,349 ? 0,213 |
Z danych przedstawionych w tabeli 7 wynika, że zarówno części nadziemne, jak i podziemne charakteryzują się znaczną zawartością frakcji garbnikowej. Procentowa zawartość tanin i garbników w przeliczeniu na suchą masę w liściach żeń-szenia wynosi 9,94%, zaś w korzeniach 11,35%.
Wyniki analizy chromatograficznej fenolokwasów
Analizę jakościową obecności kwasów fenolowych wykonano dla liści i korzeni żeń-szenia amerykańskiego ( Panax quinquefolium L.) w IV roku wegetacji. Badania wykonano stosując klasyczną chromatografię cienkowarstwową (TLC) oraz wysokosprawną chromatografię cieczową (HPLC). Przeprowadzone badania miały na celu wykazanie obecności, w obu badanych surowcach, zarówno fenolokwasów występujących w postaci wolnej, jak i kwasów fenolowych związanych glikozydowo, a uwalnianych z tych połączeń w wyniku hydrolizy kwaśnej i zasadowej.
Badania TLC prowadzono na płytkach pokrytych żelem krzemionkowym GF254 oraz na płytkach pokrytych celulozą. Spośród ośmiu testowanych faz ruchomych najlepsze wyniki rozdziału otrzymano dla układu Si60 GF254 (toluen – mrówczan etylu – kwas mrówkowy, 5+4+1; v/v). Wizualizację otrzymanych chromatogramów prowadzono pod lampą UV (λ=254 i λ=365 nm) zaznaczając fluoryzujące plamy, a następnie chromatogramy wywoływano przez spryskiwanie zdiazowanym kwasem sulfanilowym.
Spośród związków obecnych na chromatogramie frakcji wolnych kwasów fenolowych, wyodrębnionych z liści żeń-szenia pięciolistnego, zidentyfikowano kwas protokatechowy. We frakcji uwolnionej w wyniku hydrolizy kwaśnej zidentyfikowano kwas protokatechowy, natomiast spośród związków uwolnionych po hydrolizie zasadowej – kwas kawowy i ferulowy. Obecności kwasów: p-kumarowego, p-hydroksybenzoesowego i wanilinowego we frakcji otrzymanej po hydrolizie zasadowej, jak również we frakcji wolnych fenolokwasów, nie udało się potwierdzić metodą TLC ze względu na bardzo zbliżone wartości współczynników Rf we wszystkich testowanych układach.
Analiza TLC na obecność kwasów fenolowych w korzeniach żeń-szenia wykazała występowanie w tym surowcu kwasu protokatechowego i salicylowego w formie niezwiązanej. We frakcji fenolokwasów uwolnionych w wyniku hydrolizy kwaśnej zidentyfikowano kwas kawowy, zaś w wyniku hydrolizy zasadowej kwas ferulowy. Obecności kwasu p-kumarowego i wanilinowego w postaci wolnej i związanej nie udało się potwierdzić z uwagi na zbliżone wartości współczynników Rf oraz barwy plam tych związków. Przykładowy chromatogram TLC rozdziału kwasów fenolowych występujących w liściach Panax quinquefolium przedstawia rycina 3.
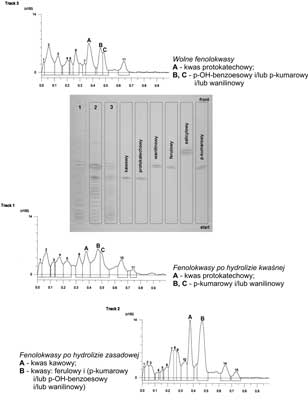
Ryc. 3. Chtomatogramy TLC fenolokwasów obecnych w liściach żeń-szenia amerykańskiego.
Układ rozwijający: Si60GF254 (toluen – mrówczan etylu – kwas mrówkowy (5:4:1, v/v)
Detekcja: zdiazowany kwas sulfonowy + 20% Na2CO3.
W celu potwierdzenia danych uzyskanych w wyniku analizy TLC wykonano analizę jakościową kwasów fenolowych metodą wysokosprawnej chromatografii cieczowej (HPLC). Wyniki analizy HPLC wolnych kwasów fenolowych oraz fenolokwasów uwolnionych w wyniku hydrolizy kwaśnej i zasadowej z liści i korzeni żeń-szenia amerykańskiego przedstawiają ryciny 4 i 5.
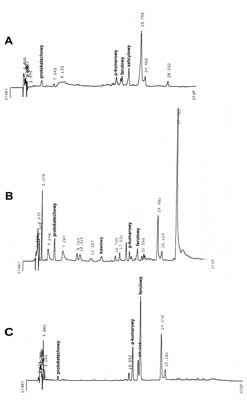
Ryc. 4. Chromatogramy HPLC fenolokwasów obecnych w korzeniu żeń-szenia amerykańskiego.
A – Wolne fenolokwasy, B – fenolokwasy uwolnione po hydrolizie kwaśnej, C – fenolokwasy uwolnione po hydrolizie zasadowej.

Ryc. 5. Chromatogramy HPLC fenolokwasów obecnych w liściach żeń-szenia amerykańskiego.
A – Wolne fenolokwasy, B – fenolokwasy uwolnione po hydrolizie kwaśnej, C – fenolokwasy uwolnione po hydrolizie zasadowej.
W wyniku analizy HPLC w korzeniach Panax quinquefolium zidentyfikowano następujące związki:
– wolne fenolokwasy: protokatechowy, p-kumarowy, ferulowy oraz salicylowy,
– fenolokwasy po hydrolizie kwaśnej: protokatechowy, kawowy, p-kumarowy i ferulowy,
– fenolokwasy po hydrolizie zasadowej: protokatechowy, p-kumarowy i ferulowy.
Analiza HPLC frakcji fenolokwasów wyodrębnionych z liści żeń-szenia wykazała obecność związków:
– wolne fenolokwasy: protokatechowy, p-hydroksybenzoesowy, salicylowy,
– fenolokwasy po hydrolizie kwaśnej: protokatechowy, ferulowy, salicylowy,
– fenolokwasy po hydrolizie zasadowej: protokatechowy, p-hydroksybenzoesowy, p-kumarowy, ferulowy, salicylowy.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Wolski T, Ludwiczuk A, Baj T i wsp. Rodzaj Panax – systematyka, skład chemiczny, działanie i zastosowanie oraz analiza fitochemiczna nadziemnych i podziemnych organów żeń-szenia amerykańskiego – Panax quinquefolium L.). Cz I. Post Fitoter 2008; 9(2):90-6. 2. Wolski T, Ludwiczuk A, Baj T i wsp. Rodzaj Panax – systematyka, skład chemiczny, działanie i zastosowanie oraz analiza fitochemiczna nadziemnych i podziemnych organów żeń-szenia amerykańskiego – Panax quinquefolium L.). Metody ekstrakcji i analizy ginsenozydów. Cz II. Post Fitoter 2008; 9(3):139-64. 3. Kopcewicz J, Lewak S. (ed.) Fizjologia roślin. PWN Warszawa, 2005, 806 pp. 4. Halliwell B, Gutteridge JNC. Plant phenols. In: Free radicals in biology and medicine. Oxford Uniwersity Press; 1993; p. 225-31. 5. Wolski T, Kalisz O, Gerkowicz M. Rola i znaczenie antyoksydantów w medycynie ze szczególnym uwzględnieniem chorób oczu. Post Fitoter 2008; 9(3):139-64. 6. Świątek L. Kwasy fenolowe i glukozydy irydoidowe w niektórych krajowych gatunkach leczniczych z rodzaju Plantago. Herba Pol 1977; 23(3):201-9. 7. Komorowski T, Mosiniak T, Kryszczuk Z i wsp. Kwasy fenolowe w krajowych gatunkach Viola tricolor L. i Viola arvensis. Murr. Herba Pol 1983; 29 (1):5-11. 8. Świątek L, Grabiał B, Rózga M. Fenolokwasy i kumaryny w Lithospermum arvense L. i Lycopus europaeus L. Herba Pol 1987; 33 (2):87-97. 9. Jerzmanowska Z. Substancje roślinne. Metody wyodrębniania. Tom II. PWN, Warszawa, 1970, pp. 200. 10. Farmakopea Polska VI (2002), PTFarm, Warszawa. 11. Farmakopea Polska IV (1970), tom 2, PZWL, Warszawa. 12. Borkowski B. (Rd.) Chromatografia cienkowarstwowa w analizie farmaceutycznej. PZWL, Warszawa, 1973, pp. 508. 13. Ziewiec A. Badania nad składem chemicznym części nadziemnych i podziemnych żeń-szenia amerykańskiego – Panax quinquefolium L. Praca magisterska, Akademia Medyczna w Lublinie, 2002, pp. 87. 14. Człowiekowska A. Analiza fitochemiczna związków fenolowych w częściach nadziemnych (liściach) i podziemnych (korzeniach) żeń-szenia amerykańskiego – Panax quinquefolium L. Praca magisterska, Akademia Medyczna w Lublinie, 2004, pp. 95. 15. Miłkowska K, Bazylko A, Strzelecka H i wsp. Korzenie bodziszka łąkowego ( Geranium pratense L., Geraniaceae) jako nowy surowiec garbnikowy. Herba Pol 1998; 44 (4):287-91. 16. Gleńsk M, Sawicka U, Mażol I, Cisowski W. 2D TLC – graft planar chromatography in the analysis of a mixture of phenolic acids. J Planar Chromatogr 2002; 15:463-5. 17. Sawicka U, Cisowski W, Matysik G i wsp. HPTLC of phenolic acids in Bistortae rhizoma, Polygoni avicularis herba, Rhei radix with densitometric determination. J Planar Chromatogr 2002; 15:442-8. 18. Klimek B, Majda T, Góra J i wsp. Badanie olejku eterycznego i związków fenolowych melisy lekarskiej ( Melissa officinalis L.) uprawianej w Polsce. Herba Pol 1998; 44(4):324-31. 19. Wagner H, Bladt S. Plant Drug Analysis. A Thin Layer Chromatography Atlas. Sprinder-Verlag, Berlin, Heidelberg, New-York, 1996, pp. 324. 20. Sroka Z, Cisowski W. Hydrogen peroxide scavenging, antioxidant and anti-radical activity of some phenolic acids. Food Chem Toxicol 2003; 41:753-8. 21. Strzelecka H, Glinkowska G, Skopińska-Różewska E i wsp. (1995), Aktywność immunotropowa wyciągów roślinnych. I. Wpływ wyciągów wodnych z wybranych surowców roślinnych na odpowiedź humoralną i komórkową. Herba Pol 1995; 41(1):23-32. 22. Drost-Karbowska K, Szaufer-Hajdrych M, Kowalewski Z i wsp. Fenolokwasy w rodzaju Aquilegia L. ( Ranunculaceae). Cz. I. Herba Pol 1994; 40 (4):141-7. 23. Dzido TH, Soczewiński E. Computer-aided optimization of high-performance liquid chromatographic analysis of flavonoids from some species of the genus Althaea. J Chromatogr 1991; 550, 71-6. 24. Kometsu M. Studies of the constituents of the herb P. ginseng. II. On the flavonoid compounds. Yakugaku Zasshi, 1969; 89(1):122-6. 25. Lee TM, Der Marderosian AH. Studies on the constituents of dwarf ginseng. Phytother Res 1988; 2(4):165-9. 26. Zheng YL, Zhang CX, Li XG et al. Comparison between Chinese Panax quinquefolius and imported Panax quinquefolium: Analysis of composition of essential oil in Panax quinquefolius. Acta Pharm Sinica 1989; 24:118-21. 27. Duke JA. Handbook of phytochemical constituents of GRAS herbs and other economic plants. CRC Press, Boca Raton, Florida 1992; 426-428. 28. Fujimoto Y, Wang H, Kirisawa M et al. Acetylenes from Panax quinquefolium. Phytochemistry 1992; 31(10):3499-3501. 29. Fujimoto Y, Wang H, Satoh M et al. Polyacetylenes from Panax quinquefolium. Phytochemistry 1994; 35(5):1255-7. 30. Wang HX, Ng TB. Quinqueginsin, a novel protein with anti-human immunodeficiency virus, antifungal, ribonuclease and cell-free translation-inhibitory activities from American ginseng roots. Biochem Biophys Res Commun 2000; 269:203-8. 31. Beveridge TH, Li TS, Drover JC. Phytosterol content in American ginseng seed oil. J Agric Food Chem 2002; 50(4):744-50. 32. Jung MY, Jeon BS, Bock JY. Free, estrified, and insoluble-bound phenolic acids in white and red Korean ginseng ( Panax ginseng C.A. Meyer). Food Chemistry 2002; 79:105-111. 33. Wolski T, Gliński J. Metabolity stresowe i inne substancje biologicznie czynne jako naturalne czynniki odporności roślin. Zesz Probl Post Nauk Roln 1998; 461:67-87. 34. Wolski T, Dyduch J. Znaczenie warzyw i owoców w profilaktyce i terapii chorób cywilizacyjnych. Annales UMCS, sec. EEE, 2000; 8 supll., 19-38. 35. Bartosz G. Druga twarz tlenu. PWN, Warszawa, 2003; pp. 447. 36. Han BH, Park MH, Han YN. Studies on the antioxidant components of Korean ginseng. III. Identification of phenolic acids. Arch Pharmacol Res 1981; 4(1):53-8. 37. Wee JJ, Park JD, Kim MW et al. Identification of phenolic antioxidant components isolated from Panax ginseng. J Korean Agric Chem Soc 1989; 32(1):50-6. 38. Wee JJ, Park JD, Kim MW et al. Isolation of phenolic antioxidant components from Panax ginseng. J Korean Agric Chem Soc 1989; 32(1):44-9. 39. Park MK, Park JH, Kim KH et al. Analysis of aromatic acids in Panax ginseng by gas chromatography. Yakhak Hoeji, 1994; 38(4):389-93. 40. Wolski T. Wykorzystanie odpadów przemysłowych do otrzymywania preparatów próchnicopodobnych. Zesz Probl Post Nauk Roln 1986; 315:325-40. 41. Wolski T, Gliński J. Modyfikacja odpadowej kory i keratyny w technologii produkcji nawozów organiczno-mineralnych. Zesz Probl Post Nauk Roln 1996; 437:353-7. 42. Wolski T, Gliński J, Orlikowski LB. Zmodyfikowane struktury ligninowo-celulozowe i keratynowe oraz możliwości ich zastosowania w nawożeniu i ochronie roślin. Post Nauk Roln 1997; 1:107-16. 43. Wolski T, Gliński J. Naturalne ekstrakty i preparaty w ochronie roślin. Annales UMCS, sec EEE, 2001; 9 supll:19-36. 44. Mowszowicz J. Żeń-szeń – korzeń życia. Wiad Ziel 1979; 2:13.





