© Borgis - Postępy Fitoterapii 2/2009, s. 113-121
Romuald Czerpak1, 2, *Anna Pietryczuk1, 2, Agata Jabłońska-Trypuć2, Katarzyna Obrębska2
Aktywność biologiczna izoflawonoidów i ich znaczenie terapeutyczne i kosmetyczne
BIOLOGICAL ACTIVITY OF ISOFLAVONOIDS AND THEIR THERAPEUTICAL AND COSMETICAL APPLICATION
1Zakład Biochemii Roślin i Toksykologii, Instytut Biologii, Uniwersytet w Białymstoku
Kierownik Zakładu: prof. dr hab. Romuald Czerpak
2Zakład Nauk Biologicznych Wyższej Szkoły Kosmetologii i Ochrony Zdrowia w Białymstoku
Kierownik Zakładu: prof. dr hab. Romuald Czerpak
Summary
Isoflavonoids are a group of chemical compounds which is widely distributed in a vegetable world. Their biological activity has found remarkable pharmaceutical, therapeutic, dietary and nutritional applications. They have also been found as useful cosmetic ingredients. Isoflavonoids make a group of natural, chemical compounds with non-steroid structure and estrogenic, anti-estrogenic, antioxidant, anticarcinogenic, preservative, anti-inflammatory, detoxication and immunological properties. They also regulate cells proliferation. Recently an increasing interest in isoflavoinoids, especially genistein, daidzein and biochanin A was observed. Numerous scientific investigations of the activity of this compounds indicate that isoflavonoids are useful in therapy and prophylaxis of many diseases, for example: diabetes, cancer, allergy, inflammation, bacterial and viral infections, cholesterol and triglyceride excess and reproductive system disorders. They are also used in cosmetic, because they delay the onset of ageing in human skin cells, stimulate collagen biosynthesis in fibroblasts and accelerate epidermis cells regeneration. Scientific research has confirmed that isoflavonoids are used in therapy of osteoporosis, excessive angiogenesis, lipid peroxidation in blood, fertility disorders, addictions and many other diseases. Future research should focus on the molecular aspects of their action in cells and possible side effects caused by isoflavonoids.

Wprowadzenie
Izoflawonoidy stanowią jedną z ważniejszych grup flawonoidów, które są coraz częściej stosowane do celów kosmetycznych i terapeutycznych. Najbardziej rozpowszechnione są u roślin należących do rodzin: paprotkowate ( Polypodiaceae), cyprysowate ( Cupressaceae), liliowate ( Liliaceae), trawy ( Gramineae), brzozowate ( Betulaceae), rdestowate ( Polygonaceae), jaskrowate ( Ranunculaceae), bobowate ( Fabaceae), jasnowate ( Lamiaceae), różowate ( Rosaceae), selerowate ( Apiaceae) i motylkowate ( Papilionaceae) (1, 2).
Do najbardziej znanych izoflawonoidów, ważnych pod względem terapeutycznym i kosmetycznym o dużej aktywności biologicznej, należą: genisteina, daidzeina, formononetyna, biochanina A, glicyteina, pueraryna, kumestrol należący do kumestanów i ekwol jako metabolit daidzeiny (ryc. 1). Ich struktura chemiczna jest bardzo zbliżona do 17-β-estradiolu i wykazują one aktywność estrogenną. Dlatego też nazwano je fitoestrogenami. Izoflawonoidy występują głównie w wakuolach komórkowych w postaci wolnej lub glikozydowej, związanej najczęściej z 1 do 5 cząsteczek cukrów prostych, bądź kwasów cukrowych. Spotykane są także połączenia estrowe izoflawonoidów przeważnie pochodne acetylowe i malonylowe.
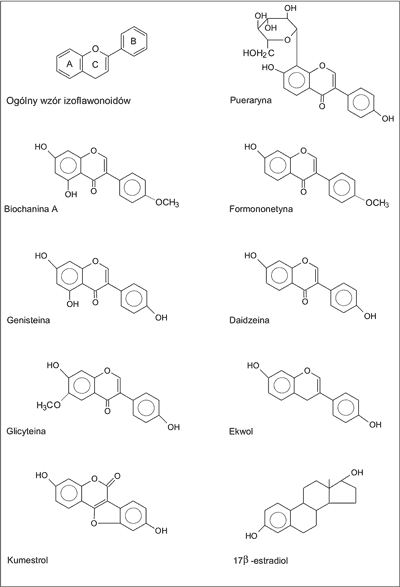
Ryc. 1. Wzory strukturalne najbardziej znanych izoflawonoidów oraz β-estradiolu (4, 9, 11, 29).
Pod względem chemicznym są to związki aromatyczne polifenolowe, których podstawowa struktura składa się z difenylopropanu (C6–C3–C6), w którym oprócz dwóch pierścieni benzenowych A i B znajduje się trzeci pierścień C powstały z połączenia trójwęglowego łańcucha z atomem tlenu. Układ pierścieniowy A pochodzi z acetylo~CoA, zaś układ fenylopropanu tworzy się ze szlaku kwasu szikimowego (1, 3, 4).
Estrogenne działanie głównego izoflawonoidu genisteiny opisano po raz pierwszy w 1931 roku po wyizolowaniu tego związku z janowca barwierskiego ( Genista tinctoria). Obecnie znanych jest ponad 300 gatunków roślin naczyniowych zawierających izoflawonoidy. Do najbogatszych źródeł izoflawonoidów należy zaliczyć: soję, soczewicę, groch włoski, fasolę szparagową, wąkrotę azjatycką, owies, chmiel, janowiec, kudzu, śliwę tarninę, lukrecję, lucernę i różne gatunki koniczyny. Od wielu lat izoflawonoidy stosowane są w dietetyce, kosmetyce i terapii niektórych chorób. W ostatnich latach obserwuje się coraz większe zainteresowanie izoflawonoidami, głównie genisteiną, daidzeiną i biochaniną A, ze względu na ich duży zakres aktywności biologicznej i farmakologicznej, zwłaszcza estrogenopodobnej (1, 2, 4).
Aktywność biologiczna izoflawonoidów na poziomie komórkowym i organizmalnym
Ze względu na chemiczne podobieństwo izoflawonoidów do żeńskich hormonów płciowych wykazują one zdolność łączenia się z receptorami estrogenowymi w jądrze komórkowym, co w efekcie prowadzi do ekspresji wielu genów, mających istotny wpływ na procesy fizjologiczno-metaboliczne organizmu ludzkiego bądź zwierzęcego. Receptory estrogenowe α i β wiążą nie tylko specyficzne ligandy pochodzenia endogennego, ale także podobne strukturalnie syntetyczne bądź naturalne związki, które hamując aktywność enzymu aromatazy przeciwdziałają przemianie androstendionu w estron. Związki te mogą działać jako agoniści bądź antagoniści wobec receptora estrogenowego, konkurując z estradiolem o miejsce wiązania. Obecność pierścienia fenolowego w analogicznej strukturze chemicznej fitoestrogenu jest niezbędnym warunkiem wiązania go z tym receptorem. Fitoestrogeny działają również poprzez mechanizmy nie związane z receptorami estrogenowymi (3, 5-13).
Powinowactwo poszczególnych izoflawonoidów do receptorów estrogenowych jest uzależnione od wielu czynników egzo- i endogennych środowiska. W organizmie ludzkim albo zwierzęcym, a także w glebie bądź wodzie, fitoestrogeny głównie pod wpływem działania enzymów przewodu pokarmowego i bakterii ulegają różnorodnym przemianom metabolicznym. Do niedawna uważano, że związki flawonoidowe, w tym także izoflawonoidy, wędrują przez przewód pokarmowy w niezmienionej formie, ulegając tylko enzymatycznej deglikozylacji. Badania ostatnich lat wykazały, że w absorpcji związków flawonoidowych uczestniczą co najmniej dwa elementy metaboliczne funkcjonujące w jelicie cienkim poprzez mechanizm hydrolityczny i transportowy. W błonach komórkowych kosmków jelita działa hydrolityczny enzym florydzyna, oznaczony symbolem LPH, a także zależny od obecności jonów sodowych przenośnik glukozy (SGLT1). W pierwszej reakcji uwalniane aglikony w bezpośrednim sąsiedztwie błony komórkowej na zasadzie dyfuzji wnikają do cytozolu. Wewnątrz komórki aglikony izoflawonoidowe są wiązane z kwasem glukuronowym albo anionem siarczanowym, a tylko niewielka część wiąże się z receptorami estrogenowymi, kinazami białkowymi lub topoizomerazami. Nadmierna ilość izoflawonoidów ulega w organizmie działaniu enzymów oksydacyjnych, głównie cytochromów, co zapoczątkowuje kaskadę reakcji ich degradacji (1, 4, 9, 14).
Środowisko, w którym żyją organizmy, zwłaszcza woda i gleba, mogą zawierać znaczne ilości związków estrogenowych, głównie fitoestrogenów pochodzących z rozkładu roślin i produktów wytworzonych przez człowieka. Poza tym niektóre grzyby, zwłaszcza pasożytnicze, wytwarzają tzw. mykoestrogeny, np. zearalenon, zearalenol oraz anteridiol i oogoniole – hormony płciowe grzybów z rodzaju Achlya i wiele innych. Znaczną grupę estrogenów środowiskowych stanowią ksenoestrogeny wytwarzane syntetycznie przez człowieka do celów terapeutycznych, kosmetycznych bądź dietetycznych. Większość estrogenów środowiskowych wykazuje znaczną aktywność biologiczną w stosunku do organizmów w nim żyjących zwłaszcza w hydrosferze, co ma istotny wpływ na kształtowanie stosunków ekologicznych i interakcji między organizmami. Na przykład doświadczalnie stwierdzono w hodowli glonu jednokomórkowej zielenicy Chlorella vulgaris stymulujący wpływ biochaniny A na wzrost i zawartość barwników chlorofilowych i karotenoidowych oraz metabolizm, głównie aktywację fotosyntezy (1, 9, 14, 15).
Oprócz działania poprzez system receptorowy komórek, izoflawonoidy są skutecznymi inhibitorami aktywności topoizomeraz I i II DNA oraz helikazy rozplatającej podwójną nić DNA, aby udostępnić miejsce dla enzymów replikacyjnych, bądź transkrypcyjnych. W ten sposób następuje zahamowanie procesów replikacji albo transkrypcji, a w efekcie zahamowanie procesu podziału komórek, ich proliferacji i wzrostu. Izoflawonoidy, podobnie jak pozostałe flawonoidy, wykazują silne właściwości antyoksydacyjne i dlatego jako naturalne antyoksydanty hamują reakcje utleniania i neutralizują wolne rodniki, przeważnie nadtlenkowe i wodoronadtlenkowe, które tworzą się najczęściej przy nadmiernej oksydacji nienasyconych kwasów tłuszczowych. Łatwo oddając wodór ze swoich grup hydroksylowych, redukują nadtlenki i wodoronadtlenki. Poza tym działają stymulująco na aktywność różnych enzymów antyoksydacyjnych, np. katalazy, peroksydazy glutationowej, dysmutazy nadtlenkowej i reduktazy glutationowej. Wszystkie flawonoidy ze względu na swoją strukturę chemiczną wykazują łatwość wiązania kompleksowego kationów metali, zwłaszcza dwuwartościowych, które katalizują reakcje utleniania. W ten sposób eliminowane są czynniki katalityczne reakcji utleniania zapoczątkowujące wolnorodnikowe reakcje łańcuchowe, które powodują uszkodzenie komórek i zakłócenia w funkcjonowaniu procesów fizjologiczno-metabolicznych (3, 5, 7, 8, 11, 12, 16, 17).
Fitoestrogeny mogą oddziaływać także na układ nerwowy, hormonalny, krwionośny, kostny i immunologiczny. W badaniach doświadczalnych wykonanych na myszach i szczurach stwierdzono między innymi zmiany w zachowaniu seksualnym oraz osłabienie agresji i spotęgowanie zachowania obronnego. Prócz tego w korze mózgu wykazano zwiększoną ekspresję genu odpowiedzialnego za biosyntezę enzymu acetylotransferazy cholinowej. Stwierdzono, że niektóre izoflawonoidy, np. daidzeina, działają hipoglikemicznie, gdyż wzmagają syntezę i wydzielanie hormonu insuliny, a także osłabiają jej wchłanianie poprzez hamowanie aktywności α-amylazy i α-glukozydazy – enzymów rozkładających skrobię w przewodzie pokarmowym. Stwierdzono również hamujące działanie fitoestrogenów na biosyntezę glukozy, czyli na glukoneogenezę w hepatocytach wątroby. Fitoestrogeny jako chemiczne analogi estrogenów wykazują duży wpływ na rozwój i funkcjonowanie żeńskiego układu rozrodczego człowieka i zwierząt, co ma istotny wpływ na rozrodczość i zachowanie seksualne. Stwierdzono także oddziaływanie fitoestrogenów na strukturę chemiczną krwi i naczyń krwionośnych. Na przykład genisteina jest inhibitorem mikrosomalnej peroksydacji lipidów oraz angiogenezy. Wykazują też wpływ na procesy metaboliczne i mineralizację, głównie odkładanie fosforanów wapnia w kościach, a także aktywują procesy odpornościowe. Niektóre izoflawonoidy, zwłaszcza genisteina i daidzeina, hamują proliferację niektórych komórek nowotworowych oraz indukują w nich proces apoptozy. Wykazują także działanie przeciwzapalne, antyalergiczne i hamujące rozwój niektórych wirusów. Na przykład genisteina hamuje tworzenie się tlenku azotu (NO) stymulowanego przez cytokiny, co ma istotne znaczenie w osłabianiu procesów zapalnych. Dlatego też w ostatnich latach izoflawonoidy, zwane potocznie fitoestrogenami, mają coraz większe znaczenie w terapii, kosmetyce i profilaktyce niektórych chorób człowieka (1, 9, 18-39).
Znaczenie terapeutyczne i kosmetyczne izoflawonoidów
Izoflawonoidy pochodzenia roślinnego, głównie genisteina, daidzeina, biochanina A, formononetyna, glicyteina, pueraryna i kumestrol, charakteryzują się szerokim zakresem aktywności biologicznej i farmakologicznej o dużej skuteczności działania leczniczego, kosmetycznego, bądź profilaktycznego. Poza ich działaniem jako fitoestrogenów, charakterystycznym dla hormonów płciowych, zwłaszcza 17-β-estradiolu, niektóre z nich wykazują właściwości antymutagenne, przeciwnowotworowe, przeciwutleniające, przeciwbakteryjne, przeciwgorączkowe, hipotensyjne, spazmolityczne, przeciwzapalne, antyalergiczne, immunostymulujące, przeciwmiażdżycowe i wiele innych. Dlatego coraz więcej ośrodków naukowych i medycznych w Europie, USA, Kanadzie, Chinach i Japonii zajmuje się szczegółowym poznaniem molekularnych mechanizmów działania izoflawonoidów pod kątem wykorzystania ich w terapii, bądź profilaktyce różnych chorób, a także w kosmetyce w celu poprawienia jakości i wyglądu zewnętrznego skóry i jej wytworów. Medyczne badania dietetyczno-statystyczne wykazały, że u ludzi mieszkających w Japonii i innych krajach Dalekiego Wschodu, których dieta jest bogata w składniki pokarmowe o dużej zawartości izoflawonoidów, zachorowalność na raka piersi i prostaty jest o wiele mniejsza w stosunku do ludności zamieszkałej w Europie i Ameryce Północnej (1, 3, 4, 14, 18, 37, 40-45).
Podobieństwo strukturalne izoflawonoidów, szczególnie daidzeiny i genisteiny, do płciowych hormonów steroidowych powoduje, że łatwo wiążą się one z receptorami estrogenów, a także androgenów, najprawdopodobniej na zasadzie mechanizmu kompetycyjnego. Fitoestrogeny te w stężeniach fizjologicznych, w zakresie od 10 nM do 1 μM, stymulują proliferację komórek normalnych oraz rakowych. Natomiast w stężeniach większych, przekraczających 10 μM, działają hamująco na podziały komórek nowotworowych, nawet w 50% na wzrost guza nowotworowego spowodowanego chemicznymi związkami rakotwórczymi środowiska.
Doświadczalnie wykazano, że w dużych stężeniach genisteina wiąże się z receptorami androgenów i hamuje aktywność biologiczną hormonów męskich, głównie testosteronu i dihydrotestosteronu, obniżając w granicach 50-80% stymulujący wpływ tychże hormonów na rozwój raka prostaty, a także raka gruczołu mlekowego. Stwierdzono też, że genisteina i daidzeina stosowane w dużych stężeniach hamują aktywność kinaz białkowych tyrozyno-swoistych, które odgrywają ważną rolę w stymulacji procesów proliferacji różnego typu komórek, w tym także nowotworowych. Jest to jeden z dodatkowych mechanizmów działania przeciwnowotworowego izoflawonoidów. Poza tym fitoestrogeny, a głównie genisteina, dotychczas najlepiej przebadana pod względem aktywności molekularnej działa hamująco na aktywność helikazy i topoizomeraz I i II DNA. To powoduje zahamowanie procesu replikacji DNA, a w dalszej konsekwencji dochodzi do osłabienia podziału komórek i ich wzrostu. W procesie rozrostu tkanki nowotworowej istnieje zjawisko angiogenezy, tj. rozwoju sieci naczyń krwionośnych, w celu zapewnienia komórkom nowotworowym dostatecznej ilości tlenu i składników odżywczych. Stwierdzono, że genisteina intensywnie hamuje angiogenezę, czyli rozwój naczyń krwionośnych wokół guza nowotworowego, poprzez kilkakrotne zmniejszenie tempa rozwoju komórek śródbłonka wyścielającego ściany tworzonych naczyń oraz stymulację degradacji białek macierzy pozakomórkowej wokół nowopowstającego naczynia (3, 4, 9, 16, 17, 21, 26, 30, 32, 36, 37, 43-47).
W niektórych badaniach wykazano, że genisteina, daidzeina i biochanina A stosowane w dużych stężeniach, rzędu 50-60 μM, działają inhibicyjnie na przebieg cyklu komórkowego, a także indukują proces apoptozy komórek w niektórych nowotworach, np. w leukemii, raku piersi, prostaty i żołądka. Ich działanie hamujące przebieg cyklu komórkowego zachodzi w punktach przejścia fazy G1 w S i G2 w M. Izoflawonoidy hamują aktywność cyklin – białek regulujących przebieg cyklu komórkowego oraz kinaz zależnych od cyklin (CDK). Mogą one również inaktywować CDK poprzez stymulację transkrypcji białka p21, które jest inhibitorem kinaz CDK-2 i CDK-4. Stymulacja transkrypcji białka p21 może odbywać się przy udziale białka p53, które jest aktywatorem transkrypcji genu odpowiedzialnego za biosyntezę białka p21. Niektóre flawonoidy, w tym także izoflawonoidy, powodując zwiększenie stężenia białka p53 i wydłużając okres jego żywotności, osłabiają rozwój komórek nowotworowych. Również fitoestrogeny, dzięki swym właściwościom przeciwutleniającym, ochraniają kinazę białkową A (PKA), która poprzez katalityczne działanie powoduje fosforylację czynnika transkrypcyjnego C/EBP β i działa stymulująco na transkrypcję białka p21, niezależnie od udziału białka p53 (ryc. 2) (3, 4, 9, 16, 21, 23, 25-27, 47-50).
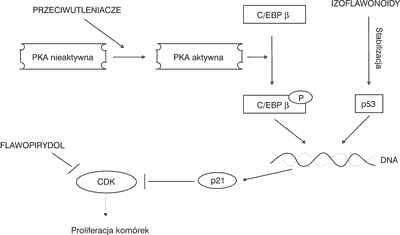
Ryc. 2. Wpływ izoflawonoidów na aktywność kinaz białkowych zależnych od cyklin (PKA – kinaza białkowa A; CDK – kinaza zależna od cyklin; C/EBP β – czynnik transkrypcyjny; p21 – białko inhibitor CDK-2 i CDK-4; p53 – białko aktywator transkrypcji genu białka p21; flawopirydol – inhibitor CDK) (3, 4, 49).
Genisteina jest wybiórczym inhibitorem kinaz tyrozynowych, które odgrywają ważną rolę w proliferacji i transformacji komórek. Aktywność kinazy tyrozynowej jest związana z funkcjonowaniem receptorów komórkowych, między innymi dla epidermalnego czynnika wzrostu (EGF), insuliny, fagocytów i wielu innych. Również aktywność tego enzymu jest skorelowana ze zdolnością retrowirusów do transformacji DNA komórek, powodującej wytworzenie produktów onkogennych. Aktywność kinaz tyrozynowych jest związana z ekspresją onkogenów raka piersi i prostaty. Dlatego też genisteina, hamując aktywność kinaz tyrozynowych działa inhibicyjnie na wzrost komórek nowotworowych. Informacje naukowe z ostatnich lat wskazują, że fitoestrogeny mogą znaleźć zastosowanie w terapii AIDS, ponieważ działają hamująco na aktywność enzymu odwrotnej transkryptazy, co znacznie osłabia namnażanie wirusa HIV. Prócz tego hamują działanie wirusowego białka Vpr powodującego niekorzystne zmiany w cyklu komórkowym gospodarza (9, 19, 21, 23, 25, 27, 35, 47, 48, 49, 50).
Izoflawonoidy zmniejszają ryzyko chorób układu krwionośnego, zwłaszcza choroby wieńcowej serca i miażdżycy naczyń krwionośnych. Pod wpływem fitoestrogenów następuje obniżenie we krwi poziomu całkowitego cholesterolu, lipoprotein o niskiej gęstości (LDL) i triglicerydów, a także zmniejszenie ilości endogennego cholesterolu. Na przykład daidzeina i pueraryna poprzez zmniejszenie lepkości krwi poprawiają mikrokrążenie obwodowe oraz zmniejszają ryzyko agregacji erytrocytów i płytek krwi w naczyniach krwionośnych. Działając jako antyoksydanty poprzez aktywację takich enzymów, jak katalaza, peroksydaza, dysmutaza nadtlenkowa i reduktaza glutationowa, hamują mikrosomalne utlenianie lipidów, zwłaszcza nienasyconych kwasów tłuszczowych, których oksydacja sprzyja tworzeniu się miażdżycy. Izoflawonoidy o silnych właściwościach hydrofobowych, podobnie jak cholesterol i witamina E łatwo wiążąc się z rdzeniem lipidowym błony komórkowej, wzmagają jej stabilność oraz zmniejszają płynność i mozaikowatość.
Dzięki tym związkom błona stanowi większą przestrzenną przeszkodę do wnikania wolnych rodników do wnętrza komórki oraz zmniejsza szybkość wolnorodnikowych reakcji redoksowych w obrębie komórki. Ponadto obecność wiązań podwójnych w difenolowych strukturach wszystkich flawonoidów sprzyja przyłączaniu do nich reaktywnych form tlenu. Ta zdolność zmiatania wolnych rodników ochrania elementy strukturalne i metaboliczne komórek przed oksydacyjnym działaniem silnych utleniaczy. W stanach zapalnych komórki wytwarzają cały szereg oksydantów w formie wolnych rodników, z którymi izoflawonoidy łatwo reagując, zmniejszają ryzyko oksydacyjnego uszkodzenia komórek, związanego ze stanem zapalnym. Takim przykładem jest hamowanie przez genisteinę tworzenia się tlenku azotu (NO) stymulowanego przez cytokiny, niezbędnego w przebiegu procesów zapalnych (1, 4, 7- 9, 11, 12, 17, 19, 20, 22, 29, 35, 36, 39, 51, 52).
Znane są również przypadki działania przeciwbakteryjnego i przeciwgrzybiczego izoflawonoidów. Empirycznie udowodniono, że genisteina, daidzeina i pueraryna, a także niektóre ich pochodne, hamują aktywność jednego z głównych enzymów, tj. β-galaktozydazy u bakterii z rodzaju Streptomyces, co uniemożliwia bakteriom obronę przed działaniem antybiotyków. Z przeprowadzonych badań wynika, że wymienione izoflawonoidy hamują wzrost patogennych szczepów bakterii Staphylococcus aureus i Staphylococcus epidermidis oraz grzybów: Aspergillus niger i Candida albicans.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kraszewska O, Nynca A, Kamińska B i wsp. Fitoestrogeny. I. Występowanie, metabolizm i znaczenie biologiczne u samic. Post Biol Kom 2007; 34:189-205. 2. Kohlmünzer S. Farmakognozja. PZWL, Warszawa, 2000. 3. Malińska D, Kiersztan A. Flawonoidy - charakterystyka i znaczenie w terapii. Post Bioch 2004; 50:182-96. 4. Czerpak R, Jabłońska A. Zastosowanie cytokinin i izoflawonoidów w kosmetyce i terapii (II). Med Estet i Przeciwstarz 2005; 4:121-9. 5. Grynkiewicz G, Gadzikowska M. Fitoestrogeny jako selektywne modulatory aktywności receptorów estrogenowych. Post Fitoter 2003; 4:10-4. 6. Polkowski K, Mazurek AP. Biological properties of genistein. A review of in vitro and in vivo data. Acta Pol Pharm 2000; 57:135-55. 7. Jha HC, Recklinghausen G, Zilliken F. Inhibition of in vitro microsomal lipid peroxidation by isoflavonoids. Biochem Pharmacol 1985; 34:1367-9. 8. Mitchell JH, Gardner PT, McPhail DB i wsp. Antioxidant efficacy of phytoestrogens in chemical and biological model systems. Arch Biochem Biophys 1998; 360:142-8. 9. Birt DF, Hendrich S, Wang W. Dietary agents in cancer prevention: flavonoids and isoflavonoids. Pharmacol Therap 2001; 90:157-77. 10. Breinholt U, Hossaini A, Svendsen GW i wsp. Estrogenic activity of flavonoids im mice. The importance of estrogen receptor distribution, metabolism and bioavailability. Food Chem Toxicol 2000; 38:555-64. 11. Yeung DKY, Leung WS, Xu YC i wsp. Puerarin, an isoflavonoid derived from Radix puerariae, potentiates endothelium-independent relaxation via the cyclic AMP pathway in porcine coronary artery. Europ J Pharmacol 2006; 552:105-11. 12. Miksicek RJ. Estrogenic flavonoids: structural requirements for biological activity. Proc Soc Exper Biol Med 1995; 208:44-50. 13. Tkaczyk M, Kalita K. Receptor estrogenowy - budowa, regulacja i funkcja. Post Biochem 2001; 47:72-78. 14. Adlercreutz H. Epidemiology of phytoestrogens. Baill Clin Endocrinol Metabol 1998; 12(4):605-23. 15. Czerpak R, Piotrowska A, Dobrzyń P i wsp. The effect of biochanin A on the chlorophylls and carotenoids content in the alga Chlorella vulgaris Beijerinck. Acta Physiol Plant 2003; 25:271-8. 16. Okura A, Arakawa H, Oka H i wsp. Effect of genistein on topoisomerase activity and on the growth of Ha-ras-transformed NIH3T3 cells. Biochem Biophys Res Commun 1988; 157:183-9. 17. Dixon RA, Ferreira D. Genistein. Phytochemistry 2002; 60:205-11. 18. Anderson JB, Anthony M, Messina M i wsp. Effect of phyto-oestrogens on tissue. Nutr Res Rev 1999; 12:75-116. 19. Asres K, Seyoum A, Veeresham C i wsp. Naturally derived anti-HIV agent. Phytother Res 2005; 19:557-81. 20. Noszczyk M. Wpływ estrogenów i fitoestrogenów na procesy związane ze starzeniem się skóry. Dermatol Estet 1999; 1:222-6. 21. Zhou HB, Chen JJ, Wang WX i wsp. Apoptosis of human primary gastric carcinoma cells induced by genistein. World J Gastroenterol 2004; 10(12):1822-5. 22. Wei H, Bowen R, Cai Q i wsp. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc Soc Exper Biol Med 1995; 208:124-30. 23. Watanabe T, Kondo K, Oishi M. Induction of in vitro differentiation of mouse erythroleukemia cells by genistein, an inhibitor of tyrosine protein kinases. Cancer Res 1991; 51:764-8. 24. Wietrzyk J. Wpływ izoflawonoidów na aktywność przeciwnowotworową witaminy D. Post Hig Med Dośw 2007; 61:253-60. 25. Merz-Demlow BE, Duncan AM, Wangen KE i wsp. Soy isoflavones improve plasma lipids in normocholesterolemic premenopausal women. Am J Clin Nutr 2000; 71:1462-9. 26. Yanagihara K, Ito A, Toge T i wsp. Antiproliferative effects of isoflavones on human cancer cell lines established from the gastrointestinal tract. Cancer Res 1993; 53:5815-21. 27. Uckun FM, Evans WE, Forsyth CJ i wsp. Biotherapy of -cell precursor leukemia by targeting genistein to CD 19-associated tyrosine kinases. Science 1995; 267:886-91. 28. Wocławek-Potocka I, Acosta TJ, Korzekwa A i wsp. Phytoestrogens modulate prostaglandin production in bovine endometrium: cell type specificity and intracellular mechanisms. Exp Biol Med 2005; 230:326-33. 29. Arora A, Nair MG, Strasburg GM. Antioxidant activities of isoflavones and their biological metabolites in a liposomal system. Arch Biochem Biophys 1998; 356:133-41. 30. Dave B, Eason RR, Till SR i wsp. The soy isoflavone genistein promotes apoptosis in mammary epithelial cells by inducing the tumor suppressor PTEN. Carcinogenesis 2005; 26:1793-803. 31. Haddad NG, Fuqua JS. Phytoestrogens: effects on the reproductive system. Endocrinologist 2001; 11:498-505. 32. Kim EJ, Shin HK, Park JH. Genistein inhibits insulin-like growth factor - I receptor signaling in HAT-29 human colon cancer cells: a possible mechanism of growth inhibitory effect of genistein. J Med Food 2005; 8:431-8. 33. Deluca D, Krazeisen A, Breitling R i wsp. Inhibition of 17-b-hydroxysteroid dehydrogenases by phytoestrogens: comparison with other steroid metabolizing enzymes. J Steroid Biochem Mol Biol 2005; 93:285-92. 34. Dusza L, Ciereszko R, Skarzyński DJ i wsp. Mechanism of phytoestrogen action in reproductive processes of mammals and birds. Reprod Biol (suppl) 2006; 6:151-74. 35. Lee KH, Choi EM. Biochanin A stimulates osteoblastic differentiation and inhibits hydrogen peroxide induced production of inflammatory mediators in MC3T3-E1 cells. Biol Pharm Bull 2005; 28:1948-53. 36. Middleton JE, Kandaswami C, Theoharides TC. The effect of plant flavonoids on mammalian cells: implications for inflammation, heart disease and cancer. Pharmacol Rev 2000; 52:673-751. 37. Magec PJ, Rowland JR. Phyto-estrogens, their mechanism of action: current evidence for a role in breast and prostate cancer. Brit J Nutr 2004; 91:513-31. 38. Urbaniak B, Marcisz C. Wpływ soi i izoflawonów sojowych na tarczycę. Post Fitoter 2006; 7(2):83-9. 39. Grzenkowicz J, Wojtkowiak D, Podhajska AJ. Zmiana czynnościowa komórek skóry w odpowiedzi na stan zapalny. Pol J Cosmetol 2002; 3:182-92. 40. Branca F. Dietary phyto-oestrogens and bone health. Proc Nutr Soc 2003; 62:877-87. 41. Setchell KDR. Fitoestrogeny - biochemia, fizjologia oraz wpływ izoflawonów sojowych na zdrowie człowieka (cz. 1). Dermatol Estet 2001; 2:88-94. 42. Setchell KDR. Fitoestrogeny - biochemia, fizjologia oraz wpływ izoflawonów sojowych na zdrowie człowieka (cz. 2). Dermatol Estet 2001; 3:130-41. 43. Lutowski J. Fitoestrogeny w miejsce hormonów syntetycznych. Post Fitoter 2001; 2:9-11. 44. Ososki AL, Kennelly EJ. Phytoestrogens: a review of the present state of research. Phytother Res 2003; 17:845-69. 45. Wang W, Liu LQ, Higuchi CM i wsp. Induction of NADPH: quinone reductase by dietary phytoestrogens in colonic Colo205 cells. Biochem Pharmacol 1998; 56:189-95. 46. Adlercreutz H. Phyto-oestrogens and cancer. Lancet Oncol 2002; 3:364-73. 47. Davis JN, Singh B, Bhuiyah M i wsp. Genistein-induced upregulation of p21, downregulation of cyclin B and induction of apoptosis in prostate cancer cells. Nutr Cancer 1998; 32:123-31. 48. Akiyama T, Ishida J, Nakagawa S i wsp. Genistein a specific inhibitor of tyrosine-specific protein kinases. J Biol Chem 1987; 262:5592-95. 49. Dean NM, Kanemitsu M, Boynton AL. Effects of the tyrosine-kinase inhibitor genistein on DNA synthesis and phospholipid-derived second messenger generation in mouse 1OT1/2 fibroblasts and rat liver T51B cells. Biochem Biophys Res Commun 1989; 165:705-801. 50. Liu XJ, Yang L, Mao YQ i wsp. Effects of the tyrosine protein kinase inhibitor genistein on the proliferation, activation of cultured rat hepatic stellate cells. World J Gastroenterol 2002; 8:739-45. 51. Fotsis T, Pepper M, Adlercreutz H i wsp. Genistein a dietary-derived inhibitor of in vitro angiogenesis. Proc Natl Acad Sci USA 1993; 90:2690-94. 52. Zhang R, Li V, Wang W. Enhancement of immune function in mice fed high doses of soy daidzein. Nutr Cancer 1997; 29:24-8. 53. Sato M, Tanaka H, Fujiwara S i wsp. Antibacterial property of isoflavonoids isolated from Erythrina variegata against cariogenic oral bacteria. Phytomedicine 2002; 9:427-33. 54. Mielczarek C, Brzezińska E. Flawonoidy w kosmetyce i kosmetologii, cz. 1. Właściwości biologiczne flawonoidów. Pol J Cosmetol 2000; 1(1):11-21. 55. Farhan H, Wähälä K, Adlercreutz H i wsp. Isoflavonoids inhibit catabolism of vitamin D in prostate cancer cells. J Chromatogr 2002; 777:261-68. 56. Mielczarek C, Brzezińska E. Flawonoidy w kosmetyce i kosmetologii, cz. 3. Praktyczne zastosowanie surowców flawonoidowych w kosmetyce. Pol J Cosmetol 2000; 1(3):156-63. 57. Kuczyński S. Hormony w kosmetykach. Beauty Forum 2003; 9:16-19.


