Zakład Neuroendokrynologii Katedry Endokrynologii Uniwersytetu Medycznego w Łodzi
Kierownik Zakładu: prof. dr hab. med. Michał Karasek
Angiotensyna II (Ang II) jest spostrzegana głównie jako ważny regulator układu krążenia i ważny czynnik w patogenezie nadciśnienia tętniczego oraz miażdżycy. Głównym źródłem krążącej Ang II jest ogólnoustrojowy układ renina-angiotensyna (renin – angiotensin system, RAS), złożony z wątroby, która wytwarza cząsteczkę prekursorową dla angiotensyny – angiotensynogen, aparatów przykłębkowych nerek – odpowiedzialnych za syntezę reniny, enzymu wytwarzającego z angiotensynogenu dekapeptyd angiotensynę I, oraz śródbłonków naczyniowych, będących głównym miejscem ekspresji enzymu konwertazy angiotensynowej (angiotensin converting enzyme, ACE) przekształcającego nieaktywną angiotensynę I w aktywny oktapeptyd Ang II. Współczesna wiedza na temat układu renina-angiotensyna jest znacznie szersza i obraz, który uwidacznia, jest znacznie bardziej złożony.
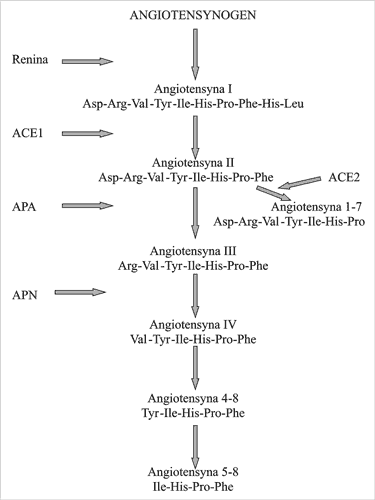
Pierwszym powodem tej złożoności jest występowanie – obok ogólnoustrojowego RAS – wielu lokalnych układów renina-angiotensyna, umożliwiających miejscową generację Ang II w różnych tkankach i narządach. Takie lokalne układy RAS wykryto m.in. w mózgu i przysadce (1), nadnerczach (2), jądrach i jajniku (3), najądrzu (4), gruczole krokowym (5, 6), trzustce (7), gruczole mlecznym (8). Jakkolwiek Ang II jest bez wątpienia najważniejszym produktem zarówno ogólnoustrojowego RAS, jak i układów miejscowych, jej metabolity powstające w wyniku działania aminopeptydaz, takie jak angiotensyna III (Ang III, fragment 2-8 Ang II) (9), angiotensyna IV (Ang IV , fragment 3-8 Ang II) (10, 11) oraz angiotensyna 1-7 (Ang 1-7) (12) są wbrew początkowym poglądom również aktywne biologicznie (ryc. 1). Najlepiej poznanymi receptorami dla angiotensyn są receptory AT1 i AT2 (13) Większość znanych efektów Ang II, w tym jej działanie naczyniowężące i pobudzające proliferację komórek mięśni gładkich ściany naczyniowej, zachodzi poprzez receptor AT1. Receptor AT1 jest pobudzany także przez Ang III, a z mniejszym powinowactwem także przez Ang IV. Receptor AT2 pośredniczy natomiast w działaniach częściowo przeciwstawnych do tych, które zachodzą poprzez receptor AT1. Jego pobudzenie prowadzi m.in. do hamowania proliferacji i nasilenia apoptozy komórek mięśni gładkich naczyń krwionośnych (14). Receptor AT2 wiąże także, poza Ang II, również Ang III. Poza „klasycznymi” receptorami AT1 i AT2 sugeruje się istnienie jeszcze innych, wiążących swoiście peptydy angiotensynowe o krótszym łańcuchu: receptor AT3, swoisty dla Ang III, AT4 , swoisty dla Ang IV oraz odrębny receptor dla Ang 1-7. Nowsze prace wskazują, ze receptorem AT4 może być enzym określany jako aminopeptydaza regulowana przez insulinę (insulin-regulated aminopeptidase, IRAP), znany także pod nazwami cystynoaminopeptydazy lub oksytocynazy (15). Z kolei jako receptor dla Ang 1-7 zidentyfikowano proto-onkogen Mas (16). Równolegle z wiedzą o peptydach angiotensynowych i ich receptorach poszerzała się także nasza znajomość ich funkcji. Obok „klasycznych” aspektów działania RAS, związanych z układem krążenia, coraz liczniejsze publikacje wskazują na rolę peptydów angiotensynowych jako czynników modulujących proliferację komórkową, także poza układem sercowo-naczyniowym. Najwcześniejsze obserwacje, dotyczące roli Ang II jako stymulatora wzrostu kory nadnerczy, zostały dokonane już w latach siedemdziesiątych ubiegłego stulecia (17). Opisano także pobudzający wpływ Ang II na proliferację komórek laktotropowych przysadki (18) oraz komórek zrębu prostaty (19). Nie tylko Ang II , lecz także fragmenty tego peptydu generowane pod wpływem aminopeptydaz, takie jak Ang III, Ang 1-7) oraz Ang IV , także modulują proliferację komórkową (20-24). Peptydy angiotensynowe wpływają także na proliferację komórek nowotworowych, co wzbudziło zainteresowanie związkiem między ogólnoustrojowym oraz lokalnymi RAS a chorobami nowotworowymi. Inhibitory konwertazy angiotensyny (ACE) oraz blokery receptora AT1, stosowane szeroko jako leki przeciwnadciśnieniowe, są obecnie rozważane jako potencjalne leki przeciwnowotworowe (25, 26).
Ryc.1 Układ renina-angiotensyna.
ACE1- enzym konwertujący angiotensynę 1; ACE2 – enzym konwertujący angiotensynę 2; APA- aminopeptydaza A; APN-aminopeptydaza N
Wzrost szeregu linii nowotworowych, takich jak ludzki neuroblastoma SH-SY5Y(27), ludzki rak piersi MCF-7(28), ludzki rak trzustki (29), mysi rak okrężnicy Colon 26 (30) i szczurzy glejak C6 (31) jest pobudzany in vitro przez Ang II, działającą poprzez swój klasyczny receptor AT1. AngII pobudza także proliferację komórek izolowanych ze szczurzego doświadczalnego guza prolaktynowego oraz z ludzkich gruczolaków prolaktynowych (32) Również mniejsze fragmenty Ang II mogą wpływać na wzrost linii nowotworowych. Wykazano, że Ang1-7 hamuje in vitro wzrost linii komórkowych raka płuc (33). W naszej pracowni stwierdzono hamujące działanie Ang III oraz Ang IV wywierają na wzrost komórek hormono-niezależnego raka prostaty DU-145 (34) i szczurzego guza przysadki GH3 (35). W przypadku komórek GH3 hamujące działanie wywierają także Ang 4-8 i Ang 5-8 . Podobny hamujący wpływ na wymienione nowotwory wywiera również Ang II, ale jej działanie jest osłabiane przez zastosowanie inhibitorów aminopeptydaz i prawdopodobnie zależy od generacji mniejszych fragmentów peptydowych.
Neoangiogeneza jest niezwykle ważnym procesem warunkującym progresję guzów nowotworowych, których wzrost in vivo jest zależny od rozwoju naczyń krwionośnych (36). W inicjowaniu procesu angiogenezy bierze udział szereg czynników humoralnych, z których za najważniejszy uważany jest czynnik wzrostu śródbłonków naczyniowych (vascular endothelial growth factor, VEGF). AngII nasila ekspresję VEGF, jego receptora VEGF-R2 oraz działającej synergicznie z VEGF angiopoetyny 2 w komórkach śródbłonkowych (37) oraz ekspresję VEGF w komórkach raka endometrium (38). Selektywne inhibitory receptora AT1 hamują z kolei ekspresję VEGF i neowaskularyzację nowotworów. Inhibitor AT1 kandesartan hamował rozwój przerzutów mysiego raka nerki do płuc, równolegle z zahamowaniem ekspresji VEGF (39). Kandesartan hamował także wydzielanie VEGF z komórek ludzkiego androgenoniezależnego raka prostaty C4-2 oraz waskularyzację i wzrost guza po przeszepieniu ww. raka u myszy (40). W naszych wcześniejszych badaniach stwierdziliśmy hamujący wpływ innego inhibitora AT1, losartanu, na unaczynienie guza przysadki wywoływanego dietylstilbestrolem estrogenami u szczura (41). Jakkolwiek działania proangiogenne Ang II wydają się zachodzić głównie przez receptory AT1, wykazano ostatnio, że w siatkówce również blokada receptora AT2 hamuje ekspresję VEGF (42). Także inhibitory ACE, które zmniejszają wytwarzanie endogennej Ang II, okazały się w wielu doświadczeniach efektywnymi inhibitorami wydzielania VEGF, angiogenezy i wzrostu nowotworów. Enalapryl hamuje wzrost szczurzego guza przysadki indukowanego dietylstilbestrolem (43). Inny inhibitor ACE, kaptopryl hamuje wzrost szczurzego mięsaka, guzków preneoplastycznych wątroby wywołanych dietylnitrozaminą u szczurów (44) oraz wzrost ludzkiego czerniaka przeszczepionego u myszy (45). Pod wpływem perindaprylu obserwowano supresję genu VEGF, angiogenezy i wzrostu mysiego raka wątroby (46).
Mechanizm działania antyangiogennego inhibitorów ACE może być bardziej złożony niż samo blokowanie syntezy endogennej Ang II. Wskazuje się tu na możliwość działania niektórych z nich jako inhibitorów metaloproteinaz macierzy zewnątrzkomórkowej (26, 47).
Ponadto kaptopryl jako donor grup sulfhydrylowych może także łącznie z aktywatorem plazminogenu generować angiostatynę, jeden z ważnych czynników anty-angiogennych .
Możliwy udział mniejszych fragmentów AngII w regulacji angiogenezy jest słabo poznany. Istnieją obserwacje wskazujące na możliwość antyangiogennego działania Ang1-7 (47).
Interesujące jest także spostrzeżenie, że transfekcja komórek raka endometrium leucyloaminopeptydazą, enzymem uczestniczącym w degradacji AngII, prowadzi do utraty ich zdolności do ekspresji VEGF (38). Podsumowując, pobudzający wpływ angiotensyny II na rozwój nowotworów in vivo jest wypadkową jej bezpośredniego działania na komórki nowotworowe oraz pośredniego działania proangiogennego.
1. Saavedra J.M.: Brain and pituitary angiotensin Endocrine Rev., 1992; 13:329-80.
2. Fallo F., Postorello M., et al.: In vitro evidence for local generation of renin and angiotensin II/III immunoreactivity by the human adrenal gland Acta. Endocrinol., 1991; 125: 319-30.
3. Leung P.S., Sernia C.: The renin-angiotensin system and male reproduction: new functions for old hormones J. Mol. Endocrinol., 2003; 30:263-270.
4. Leung P.S., Wong T.P., Sernia C.: Angiotensinogen expression by rat epididymis: evidence for an intrinsic, angiotensin generating system Mol. Cell. Endocrinol., 1999; 155: 115-122.
5. O´Mahony O.A., Barker S., et al.: Synthesis and secretion of angiotensin II by the prostate gland in vitro Endocrinology 2005; 146:392-8.
6. Dinh D.T., Frauman A.G., et al.: Evidence for activation of the renin-angiotensin system in the human prostate: increased angiotensin II and reduced AT1 receptor in benign prostatic hyperplasia J. Pathol., 2002; 196: 213-219.
7. Leung P.S., Chan W.P., et al.: Expression and localization of renin – angiotensin system in the rat pancreas J. Endocrinol., 1999; 160: 13-19.
8. Tahmasebi M., Barker S., et al.: Localization of renin-angiotensin system (RAS) components in breast Br. J. Cancer 2006; 95:67-74.
9. Reaux A., Fournie-Zaluski M.C., Llorens-Cortes C.: Angiotensin III: a central regulator of vasopressin release and blood pressure Trends Endocrinol. Metab., 2001; 12: 157-162.
10. Wright J.W., Krebs L.T., et al.: The angiotensin IV system: functional implications Front Neuroendocrinol 1995; 16: 23-52.
11. Lachowicz-Ochędalska A., Rębas E., et al.: Angiotensins II and IV stimulate the activity of tyrosine kinases In estrogen-induced pituitary tumors Biochem. Biophys. Res. Commun., 2002; 297: 931-933.
12. Santos R.A.S., Campagnole-Santos M.J., et al.: Angiotensin-(1-7): an update Reg. Peptides 2000; 91: 45-62.
13. Dinh D.T., Frauman A.G., Andrade S.P.: Angiotensin receptors: distribution, signalling and function Clinical Science 2001; 100: 481-492.
14. De Gasparo M., Siragy H.M.: The AT2 receptor: fact, fancy and fantasy Reg. Peptides 1999; 81: 11-24.
15. Lew R.A., Mustafa T., et al.: Angiotensin AT4 ligands are potent, competetive inhibitors of insulin regulated aminopeptidase (IRAP) J. Neurochem., 2003; 86: 344-50.
16. Santos R.A.S., Simoes e Silva A.C., et al.: Angiotensin – (1-7) is an endogenous ligand for the G protein-coupled receptor Mas. Proc. Natl. Acad. Sci., USA 2003; 100: 8258-63.
17. Gill G.N., Ill C.R., Simonian M.H.: Angiotensin stimulation of bovine adrenocortical cell growth Proc. Natl. Acad. Sci., USA 1977; 74: 5569-73.
18. Kunert-Radek J., Pawlikowski M.: Angiotensin II stimulation of the rat pituitary tumoral cell in vitro Biochem. Biophys. Res. Commun., 1992; 183: 27.
19. Wennemuth G., Aumuller G.: Angiotensin II-mediated calcium signals and mitogenesis in human prostate stromal cell line hPCPs Br. J. Pharmacol., 2005; 144:3-10.
20. Freeman E.J., Chisolm G.M., Ferrario C.M.: Angiotensin (1-7) inhibits vascular smooth muscle cell growth Hypertension 1996; 28: 104-108.
21. Pawlikowski M., Kunert-Radek J.: Angiotensin IV stimulates the proliferation of rat anterior pituitary cells in vitro Biochem. Biophys. Res. Commun., 1997; 232: 292-29.
22. Pawlikowski M., Mełeń-Mucha G., Mucha S.: The involvement of the renin-angiotensin system in the regulation of cell proliferation in the rat endometrium Cell. Mol. Life. Sci., 1999; 55: 506-510.
23. Pawlikowski M., Gruszka A., et al.: Angiotensin II and IV stimulate the rat adrenocortical cell proliferation acting via different receptors Endocr. Regul. 2001; 35: 139-142.
24. Pawlikowski M., Mełeń-Mucha G., Mucha S.: The involvement of angiotensins in the control of prostate epithelial cell proliferation in the rat Folia Histochem. Cytobiol. 2001; 39: 341-343.
25. Abali H., Gullu I.H., Engin H.: Old hypertensives as novel antineoplastics: angiotensin I converting enzyme inhibitors and angiotensin II type 1 receptor antagonists Med. Hypotheses 2001; 59: 344-345.
26. Molteni A., Haffelfinger S., Moulder J.E.: Potential deployment of angiotensin. I converting enzyme inhibitors and angiotensin II type 1 and 2 receptor blockers in cancer chemotherapy Anticancer Agents Med. Chem., 2006; 6: 451-460.
27. Chen L., Re R.N., Prakash O., et al.: Angiotensin-converting enzyme inhibition reduces neuroblastoma cell growth rate Proc. Soc. Exp. Biol. Med., 1991; 196:280-283.
28. Muscella A., Greco S., Elia M.G., et al.: Angiotensin II stimulation of Na/K ATPase actvity and cell growth by calcium-independent pathway in MCF-7 breast cancer cells J. Endocrinol., 2002; 173: 315-323.
29. Fujimoto Y., Sasaki T., Tsuchida A., et al.: Angiotensin II type 1 receptor expression in human pancreatic cancer and growth inhibition by angiotensin II type 1 receptor antagonist FEBS Lett 2001; 495: 197-200.
30. Yasumaru M., Tsuji S., Tsuji M., et al.: Inhibition of angiotensin II activity enhanced antitumor effect of cyclooxygenase -2 inhibitors via insulin-like growth factor receptor pathway Cancer Res., 2003; 63:6726-6734.
31. Rivera E., Arrieta O., Guevara P., et al.: AT1 receptor is present in glioma cells: its blockage reduces the growth of rat glioma Br. J. Cancer 2001; 85:1396-1399.
32. Pawlikowski M., Kunert-Radek J., et al.: Effect of angiotensin II on proliferation of estrogen-induced rat pituitary tumor and human prolactinoma cells in vitro Neuroendocrinol. Lett., 1994;16: 103-109.
33. Gallagher P.E., Tallant E.A.: Inhibition of human lung cancer cell growth by angiotensin 1-7 Carcinogenesis, 2004; 25: 2045-2052.
34. Ławnicka H., Potocka A.M., et al.: Angiotensin II and and its fragments (angiotensins III and IV) decrease the growth of DU-145 prostate cancer cells in vitro Med. Sci. Monit., 2004; 10: 410-413.
35. Ptasińska-Wnuk D.: Badania nad rolą układu renina-angiotensyna w patogenezie gruczolaka prolaktynowego przysadki szczurzej oraz regulacji wzrostu komórek linii GH3 (praca doktorska – UM Łódź 2006).
36. Folkman J.: Angiogenesis and breast cancer J. Clin. Oncol., 1994; 12:441-443.
37. Otani A., Tagaki H., et al.: Angiotensin II induces expression of the tie2 receptor ligand, angiopoietin-2 in bovine retinal endothelial cells Diabetes 2001; 50: 867-875.
38. Watanabe Y., Shibata K., et al.: Adipocyte-derived leucine aminopeptidase suppresses angiogenesis in human endometrial carcinoma via renin-angiotensin system Clin. Cancer Res., 2003; 9: 6497-6503.
39. Miyajima A., Kosaka T., et al.: Angiotensin II type I antagonist prevents pulmonary metastasis of murine renal cancer by inhibiting tumor angiogenesis Cancer Res., 2002; 62: 4176-9.
40. KosakaT., Miyajima A., et al.: Angiotensin II type 1 receptor antagonist as an angiogenic inhibitor in prostate cancer Prostate 2007; 67: 41-49.
41. Pawlikowski M., Grochal M., et al.: The effect of angiotensin II receptor antagonists on diethylstilbestrol-induced vascular changes in the rat anterior pituitary gland: a quantitative evaluation Histol. Histopathol., 1996; 11: 909-913.
42. Zhang N., lassila M., et al.: Retinal expression of vascular endothelial growth factor is mediated by angiotensin type 1 and type 2 receptors Hypertension 2004; 43: 276-281.
43. Pawlikowski M., Mucha S., et al.: Is estrogen – induced pituitary hyperplasia and hyoperpolactinaemia mediated by angiotensin II? w: Tissue renin-angiotensin systems, Mukhopadyay A.K., Raizada M.K. (red.) Raven Press, New York 1995: 371-78.
44. Volpert O.V., Ward W.F., et al.: Captopril inhibits angiogenesis and slows the growth of experimental tumors in rats. J. Clin. Invest., 1996; 98: 671-9.
45. de Groot-Besseling R.R., Ruers T.J., et al.: Anti-tumor activity of a combination of plasminogen activator and captopril in a human melanoma xenograft model. Int. J. Cancer 2004; 112, 329-34.
46. Yoshiji H., Yoshii J., et al.: Suppression of the renin–angiotensin system attenuates vascular endothelaial growth factor-mediated tumor development and angiogenesis in murine hepatocellular carcinoma cells. Int. J. Oncol., 2002; 20: 1227-31.
47. Machado R.D.P., Santos R.A.S., Andrade S.P.: Opposing actions of angiotensins on angiogenesis Life Sci., 2000; 66: 67-76.
48. De Paepe B., Verstraeten V.L., et al.: Growth stimulatory angiotensin II type-1 receptor is upregulated in breast hyperplasia and in situ carcinoma but not in invasive carcinoma Histochem. Cell. Biol., 2001; 116: 247-54.
49. De Paepe B., Verstraeten V.L., et al.: Increased angiotensin II type-2 receptor density in hyperplasia, DCIS and invasive carcinoma of the breast is paralleled with increased iNOS expression Histochem. Cell. Biol., 2002; 117: 13-19.
50. Amaya K., Ohta T., et al.: Angiotensin II activates MAPkinase and NF-KappaB through angiotensin II type 1 receptor in human pancreatic cancer cells. Int., J. Oncol., 2004; 25: 849-56.
51. Fujimoto Y., Sasaki T., et al.: Angiotensin II type 1 receptor in human pancreatic cancer and growth inhibition by angiotensin II type 1 receptor antagonist FEBS Lett., 2001; 495: 197-200.
52. Marsigliante S., Resta L., et al.: AT1 angiotensin II receptor in the human larynx squamus cell laryngeal carcinoma Cancer Lett 1996; 110: 19-27.
53. Opocher G., Rocco S., et al.: Angiotensin II receptors in cortical and medullary adrenal tumors J. Clin. Endocrinol. Metab., 1997; 82: 865-9.
54. Schubert B., Fassanacht M., et al.: Angiotensin II type 1 receptor and ACTH receptor expression in human adrenocortical neoplasms. Clin. Endocrinol., 2001; 54: 627-632.
55. Koh W.P., Yuan J.M., et al.: Polymorphisms in angiotensin II type 1 receptor (AGTR1) and angiotensin I- convertibng enzyme (ACE) genes and breast cancer risk among chinese women in Singapore Carcinogenesis 2005; 26: 459-64.
56. Medeiros R., Vasconcelos A., et al.: Linkage of angiotensin I-converting enzyme gene insertion/deletion polymorphism to the progression of human prostate cancer J. Pathol., 2004; 202: 330-335.
57. Moskowitz D.W., Johnson F.E.: The central role of angiotensin I-convering enzyme in vertebrate pathophysiology Curr. Topics. Med. Chem., 2004; 4: 1433-54.
58. Friis S., Sorensen H.T., et al.: Angiotensin – converting enzyme inhibitors and the risk of cancer: a population – based cohort study in Denmark Cancer 2001; 92: 2462-70.
59. Fitzpatrick A.L., Daling J.R., et al.: Hypertension, heart rate, use of antihypertensives and incident prostate cancer Ann. Epidemiol., 2001; 11: 534-42.
60. Ronquist G., Rodrigues L.A., et al.: Association between captopril, other hypertensive drugs and risk of prostate cancer Prostate 2004; 58: 50-56.
61. Yoshiji H., Kuriyama S., Noguchi R., et al.: Angiotensin I converting enzyme inhibitors as potential anti-angiogenic agents for cancer therapy. Curr. Cancer. Drug. Targets., 2004; 4: 555-567.
62. Uemura H., Nagaiawa N., et al.: Antiproliferative efficacy of angiotensin II receptor blockers in prostate cancer. Curr. Cancer. Drug. Targets., 2005; 5: 307-23.
63. Molteni A., Ward W.F., et al.: Cytostatic properties of some angiotensin. I converting enzyme inhibitors and of angiotensin II type 1 receptor antagonists Curr. Pharm. Des., 2003; 9:751-61.