© Borgis - Postępy Nauk Medycznych 11/2007, s. 445-452
*Edward Zawisza
Choroby alergiczne
Allergic diseases
Poradnia Chorób Zapalnych i Alergicznych Oddział Laryngologiczny, Szpital Bielański
Kierownik Oddziału: dr n. med. Jan Bardadin
Kierownik Poradni: prof. dr hab. med. Edward Zawisza
Streszczenie
Uwaga lekarzy i pacjentów jest skupiona na wzrastającym trendzie zachorowań na choroby alergiczne oraz na patomechanizmie tych chorób, który do końca nie jest wyjaśniony. Praca przedstawia mediatorowo-komórkowe zjawiska w atopii. Głównie te, które toczą się na błonach śluzowych górnych dróg oddechowych.
Summary
There is continuing confusion over what is covered by term allergy or atopy in clinical practice. Doctors and patients frequently encounter allergic disorders. The reason for this rising trends is unknown. This review describe the mediator and cellular mechanisms involved in allergic and atopic disorders. Especially those involving the respiratory mucous membrane of the upper respiratory airways.

Badania epidemiologiczne wykazują, że częstość chorób alergicznych gwałtownie wzrasta. Do chwili obecnej nie są dokładnie poznane tego przyczyny.
Choroby alergiczne górnych dróg oddechowych obejmują w niektórych krajach ponad 30% populacji (Anglia 37%, USA 34%). Podobnie też choroby alergiczne skóry występują u ponad 20% populacji. Dotyczy to szczególnie dzieci. Do chorób alergicznych zaliczamy rhinitis, sinusitis, astma, hypersensitivity pneumonitis, (zewnątrzpochodne zapalenie pęcherzyków płucnych), zapalenie spojówek, pokrzywki, kontaktowe i atopowe zapalenie skóry, obrzęki naczynioruchowe (angioedema), alergiczne i migrenowe bóle głowy oraz niektóre choroby przewodu pokarmowego. W większości tych jednostek chorobowych mamy do czynienia ze wzrostem poziomu totalnych i swoistych IgE. Pojęcie chorób alergicznych jest znacznie szersze niż chorób atopowych. Te ostatnie są mediowane przez IgE. Natomiast wiele chorób alergicznych jest IgE-niezależnych.
Alergeny
Klasycznie dzielimy je na alergeny wziewne, pokarmowe oraz tak zwane reakcje polekowe.
Pyłki roślin
Wywołują sezonowe (okresowe) objawy alergiczne ze strony górnych (pyłkowice) i dolnych (astmy sienne) dróg oddechowych. Pyłki roślin odpowiedzialne za tzw. gorączkę sienną to: pyłki drzew liściastych, traw i zbóż oraz chwastów.
Pyłkowice należą do rodziny Betulaceae (brzoza, olcha, leszczyna). Na przykład w Australii 80% ludzi z pyłkowicami reaguje na antygeny Betulaceae. Główny antygen brzozy brodawkowatej.
Betula verrucosa, Bet.v.1 – jest polipeptydem o ciężarze cząsteczkowym 17 kd. Występuje on w cytosolu dojrzałego pyłku roślin. Ponad 90% pacjentów uczulonych na drzewa buduje przeciwciała klasy IgE na Bet.v.1, a 60% wykazuje wyłączną reakcję na ten główny antygen. Pyłek brzozy ma wielkość 22 mm, dlatego też z trudem dostaje się do dolnych dróg oddechowych. Objawy pyłkowic wywołanych Betula verrucosa dotyczą głównie błony śluzowej nosa i spojówek. Znaleziono jednak w atmosferze drobne cząsteczki tego antygenu niezwiązane z pyłkiem. Mówimy o tzw. pozapyłkowych źródłach alergenu pyłkowego.
Stężenie tych drobnych cząsteczek zwiększa się po opadach deszczu. Podejrzewa się, że pyłek brzozy pod wpływem kropel deszczu pęka. Wydostają się na zewnątrz drobne ziarenka cytoplazmy tworzące tzw. mgłę pyłkową. Jednak w badaniach doświadczalnych nie udało się potwierdzić pękania pyłków brzozy pod wpływem wody. Natomiast udowodniono, że występują olbrzymie ilości pyłków na liściach rośliny. Po deszczu dochodzi do rozwoju tzw. tuby pyłku. Tworzy się łagiewka pyłkowa ( pollen tubes). Tuba ta w czasie wysychania liścia pęka. Wysypują się olbrzymie ilości antygenu pyłkowego, który jest na tyle mały, że penetruje do płuc dając objawy tzw. astmy siennej. Rycina 1 ilustruje te zjawiska. Badania wykonano w Australii pomiędzy 16 października a 12 listopada.
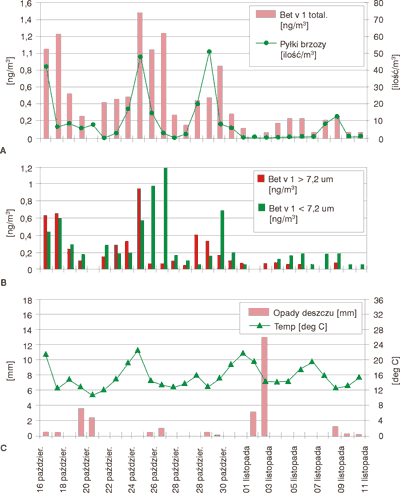
Ryc. 1. Mgła pyłkowa.
Podobne zjawiska występują w przypadku pyłków traw i chwastów. Trawy ( Poaceae), ze względu na swoją wiatropylność należą do najważniejszych roślin interesujących alergologów.
Pyłki traw charakteryzują się jeszcze dodatkową właściwością polegającą na łatwej dyfuzji alergenu w roztworach izotonicznych (np. wydzielinie z nosa). Ta dyfuzja na błonach śluzowych jest odpowiedzialna za natychmiastowe reakcje (kichanie, katar, świąd oczu i zaczerwienienie spojówek). Natomiast drobne cząsteczki wydostające się w mechanizmie „pollen tube”, penetrują głęboko do płuc dając objawy tzw. astmy siennej. Podobnie też zachowują się pyłki chwastów (bylice i komosy).
Roztocza
W klimacie umiarkowanym obok pyłków, decydującym alergenem są roztocza kurzu domowego. Są one odpowiedzialne za całoroczne (przewlekłe) zapalenia alergiczne górnych dróg oddechowych, astmy i atopowe zapalenie skóry. Unikanie (karencja) kontaktu z roztoczami znacznie zmniejsza objawy chorobowe. Szczególnie w klimacie umiarkowanym odpowiedzialne są trzy gatunki: Dermatophagoides farinae, Dermatophagoides pteronyssinus i Euroglyphus maynei. Natomiast w klimacie tropikalnym dominuje Blomia tropicalis. Jest to tzw. roztocz magazynowy (storage mites).
Inne rzadsze źródła alergenu roztoczowego to: Glycyphagus domesticus, Lepidoglyphus destruktor, Tyrophagus putrescentie i Acarus siro.
Naskórki zwierząt
Antygen Fel.d.1 jest znajdowany zarówno w domach z kotem jak i bez kota. Chociaż w tym pierwszym przypadku jest więcej. Rycina 2 przedstawia to graficznie.
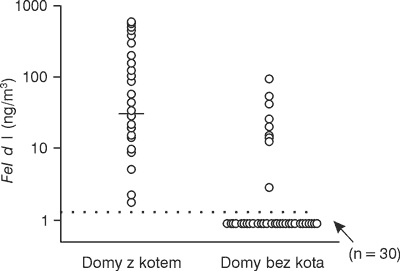
Ryc. 2. Naskórki zwierząt.
Pleśnie
Ponad 80 gatunków grzybów może wywoływać objawy ze strony układu oddechowego. Najważniejsze z nich należą do 3 specyficznych grup.
1. Ascomycetes,
2. Basidiomycetes,
3. Denteromycetes ( fungi imperfecti).
Grzyby różnią się, co do warunków wymaganych do ich wzrostu. Niektóre z nich ( Penicillium i Aspergillus) wymagają do swojego wzrostu relatywnie suchego klimatu. Nazywamy je kserofilicznymi. Natomiast inne takie jak Stachybotrys są hydrofiliczne, wymagające do swojego wzrostu wysokiej zawartości wody. Gatunki takie jak Alternaria, Cladosporium, Epicoccum i Aureobasidium mogą rosnąć na powierzchni liści drzew i innych roślin. Wiele grzybów używa drewna i celulozy jako źródła azotu. Grzyby saprofityczne rosną na rozpadających się resztkach roślin zawierających celulozę. Są też takie, które odżywiają się żywymi tkankami roślinnymi, w czasie wilgotnej pogody dobrze rosną Fusarium i Phoma. Także niektóre Ascorpores i Basidispores. W czasie suchej i wietrznej pogody dobre warunki do wzrostu mają: Alternaria, Cladosporium, Echinococum, Helminthosporium i Drechslera.
Grzyby a alergia
Wiele badań wykazało, że objawy alergiczne, szczególnie ze strony górnych dróg oddechowych nasilają się, gdy stężenie zarodników pleśni jest wysokie. Z grzybów występujących poza domem najsilniejsze reakcje alergiczne wywołują: Alternaria alternata, Stemphylium botryosum, Botrytis cinerea, Cladosporium herbarium i Cladosporium cladosporoides. Z grzybów występujących wewnątrz domów najsilniejsze reakcje wywołują Rhodotorula rubra, Sporobolomyces salmonicolort, Chaetomium globoscum i Cladosporium Sphaerospermum, Penicillium i Aspergillus.
Jady owadów
Uczulenie na jady owadów błonoskrzydłych obejmuje około 3% populacji. Najczęstsze są uczulenia na jady osy, pszczoły i szerszeni. Reakcje mogą występować jako obrzęk i zaczerwienienie w miejscu wkłucia. Mogą też mieć charakter wstrząsu anafilaktycznego.
Ważne jest ocenianie czynników ryzyka, które są odpowiedzialne za wystąpienie reakcji anafilaktycznej. Czynniki ryzyka klasyfikujemy na 4 grupy: do pierwszego zaliczamy ciężkość poprzedniej reakcji. Reisman w badaniach prospektywnych obejmujących 220 pacjentów, którzy przy poprzednim wkłuciu wykazywali rozległą, uogólnioną reakcję anafilaktyczną, a nie byli poddani immunoterapii, udowodnił, że następna ekspozycja na jad także kończy się wstrząsem anafilaktycznym.
Drugim czynnikiem wpływającym na ciężkość reakcji jest wiek. Większość zgonów po ukłuciach owadów występuje u ludzi dorosłych. Trzecim czynnikiem jest gatunek owada. Doświadczenie wskazuje, że jad pszczół jest znacznie bardziej patogenny niż jad osy. Czwartym czynnikiem jest odległość w czasie pomiędzy pierwszym a drugim ukąszeniem. Immunoterapia jest leczeniem z wyboru przy ukąszeniach na jady owadów. Nie jest do niej wskazaniem nawet duża, rozległa reakcja. Nie można też jej stosować, jeżeli nie znamy gatunku owada, który do niej doprowadził. Należy przeprowadzić odpowiednie testy skórne oraz ocenę poziomu IgE w surowicy krwi. Wskazaniem do immunoterapii są zagrażające życiu reakcje anafilaktyczne, obejmujące objawy ze strony układu sercowo-naczyniowego i oddechowego.
Alergeny pokarmowe
Alergia pokarmowa występuje u 8% dzieci poniżej 2 roku życia i około 2% ludzi dorosłych. Jest to choroba częsta. Dzieci są zwykle uczulone na jajka, mleko, orzechy ziemne, soję i pszenicę. Dorośli na orzechy (laskowe, ziemne i kasztanowe), ryby, owoce morza i niektóre owoce i warzywa. Uczulenie na niektóre alergeny (mleko i jajka) z wiekiem ustępuje.
Natomiast uczulenie na orzechy i ryby utrzymuje się często do końca życia. Reakcje na pokarmy mogą być mediowane przez IgE lub przez inne nieatopowe mechanizmy. Jednak o prawdziwej reakcji alergicznej na pokarmy mówimy wówczas, gdy jest ona IgE-zależna. Alergia pokarmowa występuje u pacjentów atopowych tzn. takich, u których występuje jedna lub więcej chorób atopowych (pyłkowice, astmy, atopowe zapalenie skóry). Choroba ta też ma tendencje do występowania rodzinnego.
Typowym obrazem alergii pokarmowej jest OAS ( oral allergy syndrom). Jest to świąd i pieczenie błony śluzowej policzków podniebienia przy spożywaniu świeżych owoców i jarzyn. Często też występują nudności i wymioty. Niektórzy pacjenci skarżą się na zmiany skórne i napady duszności. W cięższych przypadkach dochodzi do wystąpienia wstrząsu anafilaktycznego. Wstrząs ten jest trudny do wykrycia gdyż często jego objawy występują bez manifestacji skórnej. Inną ważną manifestacją alergii pokarmowej jest atopowe zapalenie skóry. Częste próby prowokacyjne antygenami pokarmowymi zaostrza objawy A.Z.S. (atopowe zapalenie skóry).
Mechanizmy
Alergia (atopia) jest klasycznie rozpatrywana jako IgE mediowana reakcja na alergeny środowiskowe. Jednak współcześnie uważa się, że alergeny ze względu na ich proteolityczną aktywność mogą bezpośrednio aktywować komórki tuczne i bazofile. Wykazano, że antygeny kurzu domowego mogą bezpośrednio stymulować komórki nabłonkowe nosa i oskrzeli. Indukują one uwalnianie z tych komórek cytokin i chemokin, które wywołują alergiczne zapalenie błon śluzowych z pominięciem mechanizmu IgE. Antygen Der.p.I jest także zdolny do rozluźnienia ścisłych połączeń pomiędzy komórkami nabłonkowymi, zwiększając przepuszczalność nabłonka dla antygenów. Rola mechanizmów IgE-niezależnych jest niedoceniana.
IGE
U człowieka wysoki poziom IgE jest uważany jako prognostyczny czynnik nasilający zachorowania na rhinitis, astmę i A.Z.S. Pozytywne testy skórne lub obecność podwyższonych swoistych IgE, badanych testem RAST lub ELIZA jest cechą mierzącą u pacjenta stan atopii. W badaniach na bliźniętach ustalono, że poziom totalnego IgE jest uwarunkowany genetycznie. Na poziom totalnego IgE wpływa też wiek, płeć, rasa oraz ekspozycja na alergeny środowiskowe. Także dym tytoniowy i narażenia zawodowe podwyższają poziom totalnego IgE. Dramatyczny wzrost IgE obserwujemy przy zakażeniach pasożytniczych oraz w zaawansowanych stadiach AIDS. Produkcja IgE jest ściśle regulowana. Synteza antygenowo specyficznych przeciwciał klasy IgE jest determinowana przez kompleks MHC II (HLA-DR i DQ). Natomiast synteza totalnego IgE jest uregulowana obecnością receptorów o wysokiej aktywności FcERI na komórkach tucznych i bazofilach. Aktywacja komórek pomocniczych Th odgrywa także dużą rolę. Th dzielimy na 2 fenotypy Th1 i Th2. Wydzielane przez Th2 cytokiny IL-4 i IL-13 indukują zmianę syntezy immunoglobuliny IgM na IgE. Proces ten odbywa się w komórkach B i jest wspomagany przez IL-5. Cytokiny te obdarzone też są właściwością mechanizmu zwrotnego na rozwój komórek helperowych Th1 w kierunku fenotypu Th2. Należy pamiętać, że stymulacja receptorów FcERI na komórkach tucznych i bazofilach nasila uwalnianie przez te komórki IL-4, która ułatwia zmianę fenotypu Th0 i Th1 na Th2. Bazofile mogą też indukować syntezę IgE przez limfocyty B poprzez bezpośredni kontakt Ligantu CD40L (limfocyt B) z antygenem CD40 (mastocyty i bazofile).
Na chromosomie 5q31 istnieje skupisko genów odpowiedzialnych za transkrypcję IL-4, IL-5 i IL-13. Geny te odgrywają zasadniczą rolę w ujawnianiu się choroby alergicznej.
Typy reakcji alergicznej (Klasyfikacja Gell-Coombs)
Typ I. (Natychmiastowy)
W typie tym antygen reaguje z umocowanymi na komórce tucznej i bazofilach cząsteczkami IgE. IgE łączy się z umiejscowionymi na mastocytach i komórkach tucznych receptorach FcERI. Połączenie to indukuje uwalnianie z komórek mediatorów magazynowanych (histamina, serotonina, proteaza) i nowogenerowanych (leukotrieny, prostaglandyny, tromboksany).
Typ II dzielimy na 2 podtypy:
Typ IIa – reakcje cytolityczne i cytotoksyczne pierwotnie opisane przez Gell i Coombs´a.
Typ IIb – w którym dochodzi do zmiany sygnałów we wnętrzu komórki pod wpływem przeciwciał.
Typ III Artusa
Choroba kompleksów immunologicznych, zaangażowane są w niej antygeny, IgG i komórki fagocytujące.
Typ IV, podobnie jak typ II dzielimy na 2 podtypy:
Typ IVa1 – klasyczna reakcja opóźniona i IVb – w którym dochodzi do uszkodzenia tkanek pod wpływem limfocytów cytotoksycznych. W typie IVa1 komórka prezentująca antygen (APC) stymuluje komórkę CD4+T, z udziałem MHCII. W przebiegu tej stymulacji dochodzi do produkcji cytokin takich jak IFN-γ. IFN-γ aktywuje makrofagi, które z kolei produkują swoje własne mediatory (monokiny) takie jak IL-1. W typie IVb komórki cytotoksyczne CD8+T reagują z antygenem związanym z błoną komórkową. Odbywa się to przy współudziale cząsteczki MHCI. Prowadzi to do śmierci komórki, zwykle w procesie apoptozy. Przewlekłe zapalenie alergiczne obejmuje udział komórek CD4Th2 i produkcję cytokin IL-5. Powstaje eozynofilowe uszkodzenie tkanek. Mówimy wówczas o typie IVa2.
Mastocyty i bazofile
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Borish L, et al.: Th1/Th2 lymphocytes: doubt some more. J. Allergy Clin. Immunol., 1997; 99: 161-164.
2. Byron KA, et al.: Dermatophagoides pteronyssinus II – induced interlaukin – 4 and interferon – g expressin by freshly isolated lymphocytes of atopic individuals. Clin. Exp. Allergy 1994; 24: 878-83.
3. Birnbaum J, et. al.: Rapid Hymenoptera venom immunotherapy; comparative safety of three protocols. Clin. Exp. Allergy 1993; 23: 226-30.
4. Hay DWP, et al.: Cysteinyl leukotrienes in asthma; old mediators uo to new tricks. Trends. Oharmacol. Sci., 1995; 16: 304-309.
5. Holgate ST, et. al.: Leukotriene antagonists and synthesis inhibitors: new directions in asthma therapy. J. Allergy Clin. Immunol., 1996; 98: 1-13.
6. Jutel M, et. al.: Bee venom immunotherapy results in decrease oh IL-4 and IL-5 and inincrease pf IFN-y secretion in specific allergen – stimulated T cell cultures. J. Immunol., 1995; 154, 4: 187-194.
7. Muller U, et. al.: Premedication with antihistaminesmay enhance efficacy of specific-allergen immunotherapy. J. Allergy Clin. Immunol., 2001; 107: 81-6.
8. Timonen M, et. al.: Presence of atopy in first-degree relatives as a predictor of a female proband´s depression: Results from the Northern Finland 1966 Birth Cohort. Perinatai risk factors for bronchiai hyperresponsiveness and atopy after a follow-up of 20 years Vonk JM, Boezen HM. Journal of Allergy and Clinical Immunology. 2003; 111, 6, 1249-1254.
9. Postma PS, et al.: Journal of Allergy and Clinical Immunology. 2004; 114, 2, 270-276.
10. Siltanen M, et. al.: Prematurity at birth reduces the long-term risk of atopy. Journal of Allergy and Clinical Immunology. 2001; 107, 2, 229-234.
11. Tariq SM, et. al.: The prevalence of and risk factors for atopy in early childhood: A whole population birth cohort study. Journal of Allergy and Clinical Immunology. 1998; 101, 5, 587-593.
12. Joseph-Bowen J, et. al.: Relationship of asthma, atopy, and bronchial responsiveness to serum eosinophil cationic proteins in early childhood. Journal of Allergy and Clinical Immunology. 2004; 114, 5, 1040-1045.
13. Shin HD, et al.: Association of thromboxane A2 receptor (TBXA2R) with atopy and asthma. Journal of Allergy and Clinical Immunology. 2003; 112, 2, 454-457.
14. Linneberg A, et. al.: IgG antibodies against microorganisms and atopic disease in Danish adults: The Copenhagen Allergy Study. Journal of Allergy and Clinical Immunology. 2003; 111, 4, 847-853.
15. Subject index: The Index to the abstracts of the scientific sessions of the 62nd annual meeting of the American Academy of Allergy, Asthma and Immunology is located in the February, part 2, issue. The Journal of Allergy and Clinical Immunology.2006; 117, 6, 1541-1583.
16. von Hertzen L, et. al.: Growing disparities in atopy between the Finns and the Russians: A comparison of 2 generations, 4 October 2005. The Journal of Allergy and Clinical Immunology. 2006; 117, 1, 151-157.
17. Sunyer J, et. al.: Geographic variations in the effect of atopy on asthma in the European Community Respiratory Health Study, 1 October 2004. or the European Community Respiratory Health Survey Study Group Journal of Allergy and Clinical immunology. 2004; 114, 5, 1033-1039.
18. Bousquet J, et. al.:Allergic Rhinitis and Its Impact on Asthma. Journal of Allergy and Clinical immunology. 2001; 108, 5, 147-334.
19. Ramsey CD, et al.: Respiratory illnesses in early life and asthma and atopy in childhood, 27 October 2006. The Journal of Allergy and Clinical immunology. 2007; 119, 1, 150-156.
20. Khoo SK, et al.: Associations of a novel IL4RA polymorphism, Aia57Thr, in Greenlander Iniiit, 30 June 2006 the Greenlandic Population Study Group The Journal of Allergy and Clinical Immunology. 2006; 118, 3, 627-634.
21. Flohr C, et al.: How atopic is atopic dermatitis? Journal of Allergy and Clinical Immunology. 2004; 114, 1, 150-158.
22. Jalaludin B, et al.: Association between Der p 1 concentration and peak expiratory flow rate in children with wheeze: A longitudinal analysis Journal of Allergy and Clinical Immunology. 1998; 102, 3, 382-386.
23. Gore C, et al.: Urinary eosinophilic protein X, atopy, and symptoms suggestive of allergic disease at 3 years of age. The Journal of Allergy and Clinical Immunology. 2003; 112, 4, 702-708.
24. Hertzen LC, Haahtela T: Immunization and atopy: Possible implications of ethnicity von Journal of Allergy and Clinical Immunology.2004; 113, 3, 401-406.


