© Borgis - Postępy Nauk Medycznych 1/2002, s. 82-92
Mariusz Pytkowski
Inwazyjna diagnostyka i leczenie chorych z częstoskurczami nadkomorowymi
Methods of invasive diagnosis and treatment of patients with supraventricular tachycardias
Klinika Choroby Wieńcowej, Instytutu Kardiologii w Warszawie
Kierownik Kliniki: prof. dr hab. med. Hanna Szwed
Streszczenie
Tachyarytmie występujace w przebiegu zespołu Wolffa-Parkinsona-White´a, napadowy częstoskurcz węzłowy oraz częstoskurcz przedsionkowy obniżają jakość życia chorych, mogą być przyczyną istotnych objawów hemodynamicznych, utrat przytomności, a nawet nagłego zgonu sercowego. Artykuł omawia rodzaje częstoskurczów nadkomorowych (SVT), oraz analizuje mechanizmy tych tachyarytmii. Ponadto, przedstawione są współczesne wskazania do wykonywania inwazyjnego badania elektrofizjologicznego i jednoczasowego zabiegu ablacji u chorych z SVT. Wnioski poparte są doświadczeniem klinicznym autorów, którzy wykonali 200 zabiegów ablacji przeznaczyniowej u chorych z SVT.
Summary
Supraventricular tachycardias (SVT): Wolff-Parkinson-White syndrome, atrio-ventricular nodal re-entrant tachycardia, atrial tachycardia and inappropriate sinus node tachycardia may result in decreasing quality of life, syncope and in rare cases sudden cardiac death. In this paper mechanisms and diagnostic issues concerning supraventricular tachycardias are presented. The contemporary indications to invasive curative procedures in patients with SVT are supported by authors clinical experience with 200 patients treated with transcatheter ablation for SVT.

WSTĘP
Głębsze zrozumienie mechanizmów tachyarytmii oraz nowe techniki lokalizacji obszarów arytmogennych umożliwiły wprowadzenie ablacyjnych technik leczenia zaburzeń rytmu serca. Jednocześnie, wyniki randomizowanych badań leków antyarytmicznych wskazują na istotne zagrożenia jakie niesie ze sobą farmakoterapia arytmii serca (3). Proarytmia oraz brak możliwości radykalnego wyleczenia chorego przy pomocy farmakoterapii, skłaniają coraz większą liczbę klinicystów do przewartościowania wskazań do niefarmakologicznych sposobów leczenia tachyarytmii (7). W 1981 roku wykonano pierwszą doświadczalną przezżylną ablację łącza przedsionkowo-komorowego, a wkrótce potem zastosowano tę technikę leczenia u ludzi (25). Źródłem energii niszczącej było wewnątrzsercowe wyładowanie defibrylatora. W drugiej połowie lat osiemdziesiątych, ze względu na stosunkowo liczne powikłania ablacji wysokoenergetycznej (18, 19), opracowano nową technikę przeznaczyniowego niszczenia struktur arytmogennych, ablację prądami wysokich częstotliwości (RFA). Efekt niszczący RFA jest wynikiem działania podwyższonej temperatury w miejscu zetknięcia elektrody ablacyjnej z tkanką. Uszkodzenie komórek dokonuje się stopniowo dzięki energii termicznej. RFA okazała się bardzo skuteczną i bezpieczną metodą terapeutyczną (7, 17, 23). Obecnie RFA stosuje się do radykalnego leczenia częstoskurczów nadkomorowych (SVT) w przypadkach: częstoskurczów związanych z istnieniem drogi dodatkowej (zespół Wolffa-Parkinsona-White´a – WPW), częstoskurczów nawrotnych w obrębie łącza przedsionkowo-komorowego (częstoskurcze węzłowe – AVNRT), ogniskowych częstoskurczów przedsionkowych (AT) oraz typowego trzepotania przedsionków (Aflu). Ze względu na jednoznacznie zdefiniowany cel ablacji (np. droga dodatkowa w WPW, czy szlak wolnoprzewodzący w przypadku AVNRT) osiąga się w tych przypadkach SVT skuteczność powyżej 90% trwałych wyleczeń (7, 23).
RODZAJE CZĘSTOSKURCZÓW NADKOMOROWYCH
Tachyarytmie występujące w przebiegu zespołu WPW
W tachyarytmie występujące w przebiegu zespołu WPW zaangażowane są droga(-gi) dodatkowa(-e) oraz prawidłowy układ bodźco-przewodzący serca. Ze względu na rolę dodatkowego połączenia przedsionkowo-komorowego wyróżniamy dwie główne grupy tachyarytmii występujących w przebiegu zespołu WPW:
1. Droga dodatkowa jest integralną częścią pętli reentry (częstoskurcz ortodromowy, częstoskurcz antydromowy, częstoskurcz wykorzystujący więcej niż jedną drogę dodatkową oraz stały częstoskurcz „łączowy”);
2. Droga dodatkowa nie jest konieczna do podtrzymania tachyarytmii i pełni rolę biernego przekaźnika impulsów (tachyarytmie przedsionkowe, częstoskurcz z łącza przedsionkowo-komorowego, częstoskurcz komorowy).
Częstoskurcz ortodromowy
Pętlę reentry podczas częstoskurczu ortodromowego tworzą: mięsień przedsionków, układ bodźco-przewodzący, mięsień komór i wstecznie pobudzana droga dodatkowa. W związku z tym zrozumiałe jest, że w większości przypadków częstoskurczu ortodromowego zespoły QRS są wąskie. Dla zaistnienia warunków do częstoskurczu wystarczy obecność drogi dodatkowej przewodzącej impulsy wstecznie, z komór do przedsionków (jawne i utajone dodatkowe połączenia przedsionkowo-komorowe), a także odpowiedniej różnicy refrakcji łącza przedsionkowo-komorowego i drogi dodatkowej (1, 4, 20) (ryc. 1).
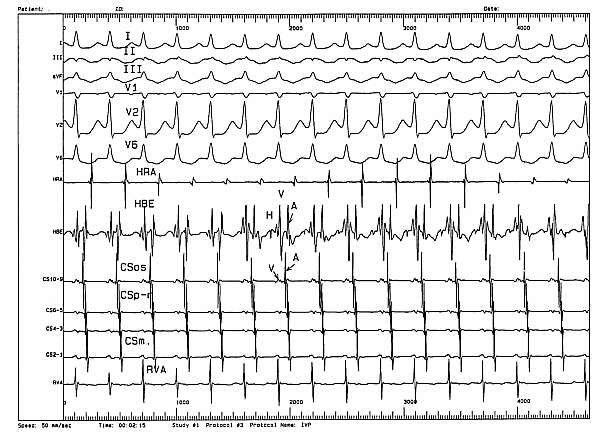
Ryc. 1. Inwazyjne badanie elektrofizjologiczne. Częstoskurcz ortodromowy przedsionkowo-komorowy u chorego z zespołem WPW i przegrodową drogą dodatkową.
Objaśnienia: HRA - elektrogram z prawego przedsionka; HBE - elektrogram z poziomu p. Hisa; CS - elektrogram z zatoki wieńcowej (os. - ujście; p-m - pozycja proksymalna i środkowa, m - pozycja środkowa); RVA - elektrogram z koniuszka komory prawej; A - elektrogram przedsionkowy; V - elektrogram komorowy; H - elektrogram pęczka Hisa; I, II, III...V6 - zapis EKG 50 mm/sek.
Częstoskurcz antydromowy
Jest to stosunkowo rzadko spotykany rodzaj częstoskurczu (6-10% pacjentów) u chorych z zespołem WPW. Warunkiem koniecznym jest przewodzenie poprzez drogę dodatkową w kierunku zstępującym. Impuls powraca do przedsionków poprzez wsteczną aktywację układu bodźco-przewodzącego. W zapisie EKG podczas częstoskurczu antydromowego uwidacznia się maksymalna preekscytacja komór co daje szerokie zespoły QRS (4, 20).
Częstoskurcze w przypadkach mnogich dodatkowych połączeń przedsionkowo-komorowych
W przypadku istnienia więcej niż jednej drogi dodatkowej rodzaj częstoskurczu zależny jest od roli jaką mnogie drogi spełniają podczas tachyarytmii. Dlatego występują tutaj rożne rodzaje tachyarytmii:
– częstoskurcz z obrazem preekscytacji (jedna z dróg przewodzi w kierunku zstępującym, druga wstępującym; jedna z dróg przewodzi w kierunku zstępującym druga nie jest zaangażowana w częstoskurcz);
– tachyarytmia przedsionkowa z obrazem preekscytacji wykorzystuje drogi dodatkowe jako przekaźniki pobudzeń do komór, dlatego często spotykamy różne rodzaje zespołów QRS z obecną preekscytacją, co ułatwia diagnostykę mnogich połączeń przedsionkowo-komorowych (4, 20).
Stały częstoskurcz „łączowy”
W pętlę reentry zaangażowana jest przewodząca wstecznie droga dodatkowa o właściwościach podobnych do włókien łącza przedsionkowo-komorowego (przewodzenie z dekrementem). Dlatego częstoskurcz wykazuje zmienną częstość i ma charakter stały. Charakterystyczną cechą tego częstoskurczu jest odwrócenie załamków P w odprowadzeniach III i aVF oraz czas przewodzenia przez drogę dodatkową dłuższy niż przez łącze przedsionkowo-komorowe (czas RP´>P´R). Częstą formą patologii spotykaną u chorych ze stałym częstoskurczem łączowym jest kardiomiopatia arytmogenna o typie kardiomiopatii rozstrzeniowej, która cofa się po ablacji drogi dodatkowej (5, 6) (ryc. 2).
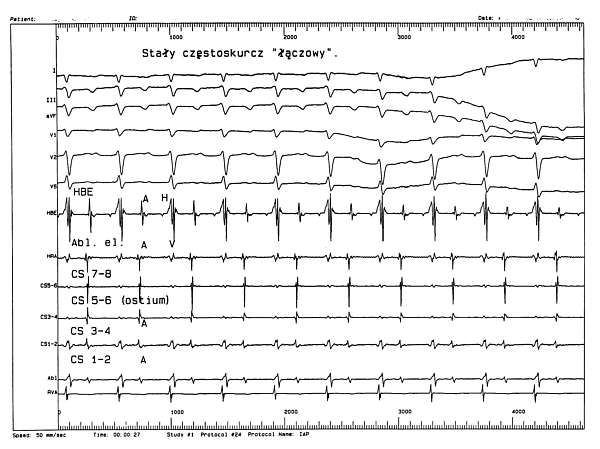
Ryc. 2. Inwazyjne badanie elektrofizjologiczne. Stały częstoskurcz łączowy PJRT.
Objaśnienia: HBE - elektrogram z pozycji pęczka Hisa; Abl. el. - elektroda ablacyjna, zapis z okolicy ujścia zatoki wieńcowej; CS 1-8 - elektrogramy z zatoki wieńcowej (ostium: ujście zatoki wieńcowej) ; A - elektrogram przedsionkowy; H - elektrogram pęczka Hisa; V - elektrogram komorowy; I, II, III...V6 - zapis EKG (50 mm/sek.).
Migotanie i trzepotanie przedsionków
Migotanie/trzepotanie przedsionków (Af/flu) występujace u 11,5 do 32% chorych z zespołem WPW, jest częstsze niż w normalnej populacji. Czynność komór podczas Af przewodzonego zstępująco drogą dodatkową zależy od refrakcji szlaku dodatkowego, refrakcji komór oraz napięcia układu sympatycznego. Należy także pamiętać, że takie leki jak preparaty naparstnicy, katecholaminy skracają refrakcję komór oraz drogi dodatkowej i w ten sposób zwiększają zagrożenie wystąpienia migotania komór indukowanego przez Af (5). Podczas badania elektrofizjologicznego Af wywołuje się w celu sprawdzenia odpowiedzi komór w warunkach kontrolowanych. W przypadku zarejestrowania minimalnego odstępu R-R<250 msek. pacjenta należy zaliczyć do grupy zwiększonego ryzyka nagłym zgonem sercowym i kwalifikować do leczenia niefarmakologicznego (12, 22) (ryc. 3).
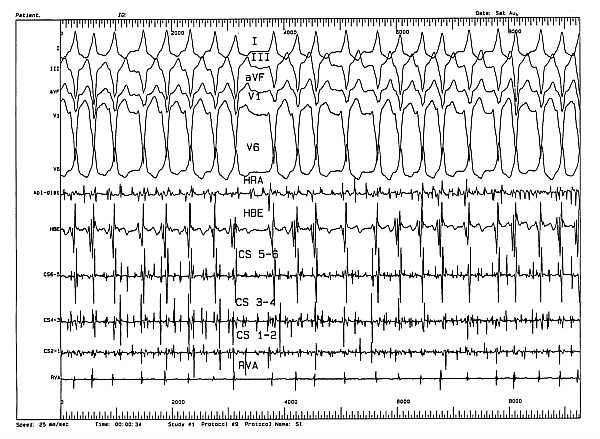
Ryc. 3. Migotanie przedsionków u chorego z zespołem WPW wywołane w czasie inwazyjnego badania elektrofizjologicznego.
Objaśnienia: HRA - elektrogram z prawego przedsionka; HBE - elektrogram z pozycji pęczka Hisa; CS 1-6 - elektrogramy z zatoki wieńcowej; RVA - elektrogram z koniuszka komory prawej; I, II, III...V6 - zapis EKG (25 mm/sek.).
Charakterystyka częstoskurczu reentry z łącza przedsionkowo-komorowego
Reentry w łączu przedsionkowo-komorowym powstaje na podłożu istnienia dwóch czynnościowo różnych szlaków przewodzenia: szlaku szybko przewodzącego, beta oraz wolno przewodzącego, alfa. Przy określonym sprzężeniu impuls pobudzający przedsionek blokuje się w kierunku zstępującym w szlaku szybko przewodzącym o długim okresie refrakcji (szlak szybki-beta) i rozprzestrzenia się do pęczka Hisa szlakiem wolno przewodzącym alfa, o krótkim okresie refrakcji. Tak więc, impuls szerzy się do komór wolno przewodzącym szlakiem, a wraca do przedsionków – szybkim. Powyższa sekwencja jest charakterystyczna dla najczęściej występującego AVNRT typu I „slow-fast”. Jedynie w 4-5% przypadków spotykamy odwrotną sekwencję krążenia pobudzenia. W kierunku zstępującym impuls kieruje się szlakiem beta, a we wstępującym szlakiem alfa (tzw. typ II AVNRT „fast-slow”). Wówczas w 12-odprowadzeniowym EKG widzimy ujemne załamki P w odpr. II, III, aVF przed zespołem QRS z krótkim czasem PR oraz czasem RP dłuższym niż PR. W przypadku AVNRT z ujemnymi załamkami P oraz długim czasem PR z jednoczesnym RP´ krótszym lub równym PR mamy do czynienia z trzecią odmianą częstoskurczu „slow-slow” (ryc. 4).
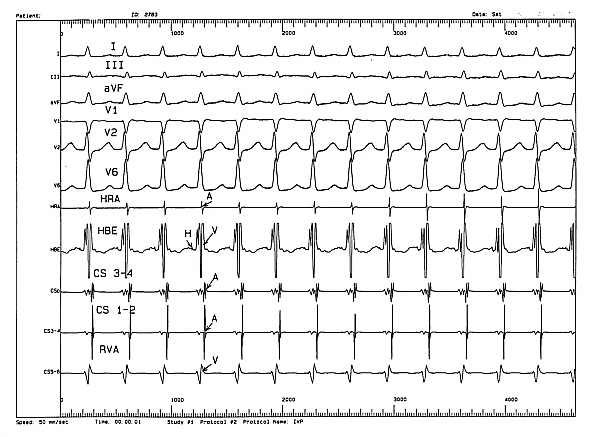
Ryc. 4. Częstoskurcz węzłowy typu I wywołany w czasie inwazyjnego badania elektrofizjologicznego.
Objaśnienia: HRA - elektrogram z prawego przedsionka; HBE - elektrogram z pozycji pęczka Hisa; CS 1-4 - elektrogramy z zatoki wieńcowej; A - elektrogram przedsionkowy; H - elektrogram pęczka Hisa; V - elektrogram komorowy; I, II, III...V6 - zapis EKG (50 mm/sek.).
Częstoskurcze przedsionkowe
Częstoskurcze przedsionkowe (AT) są najrzadziej spotykanymi w praktyce klinicznej częstoskurczami nadkomorowymi. Poza przeważającymi AT w mechanizmie pętli reentry, nierzadko występują także ogniskowe częstoskurcze przedsionkowe na podłożu automatyzmu patologicznego. W rzadkich przypadkach na skutek ciągłego AT może dojść do rozstrzeni lewej komory na podłożu arytmii (11). Ognisko AT może być zlokalizowane w lewym lub prawym przedsionku, jednak najczęściej występuje w obrębie „crista terminalis”, wokół pierścieni zastawek przedsionkowo-komorowych, ujść żył płucnych oraz przegrody międzyprzedsionkowej (26). W rzadkich przypadkach gdy pętla reentry znajduje się w strefie węzła zatokowego obraz załamków P nie różni się od załamków P rytmu zatokowego (14, 16). Specyficznym rodzajem AT jest częstoskurcz reentry wokół blizny, gdzie łata po zamknięciu otworu międzyprzedsionkowego lub blizna po zabiegu chirurgicznym jest podłożem dla powstania fali nawrotnej (24) (ryc. 5).
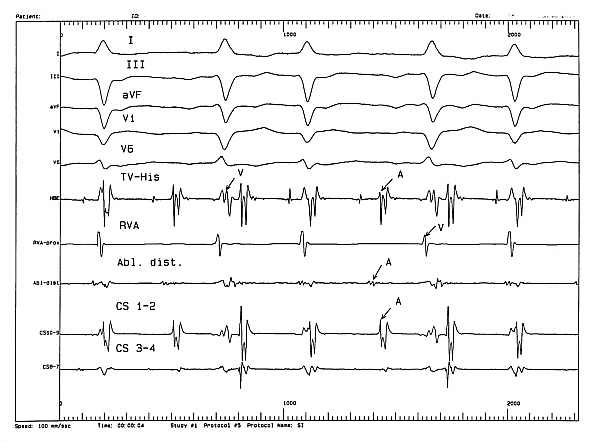
Ryc. 5. Częstoskurcz przedsionkowy wywołany w czasie inwazyjnego badania elektrofizjologicznego.
Objaśnienia: TV-His - elektrogram z poziomu zastawki trójdzielnej w pobliżu p. Hisa; CS 1-4 - elektrogramy z zatoki wieńcowej; Abl - zapis z elektrody ablacyjnej umieszczonej w pobliżu ogniska AT; A - elektrogram przedsionkowy; V - zapis potencjału komorowego; I, II, III...V6 - zapis EKG (50 mm/sek.).
PROBLEMY KLINICZNE ZWIĄZANE Z WYSTĘPOWANIEM CZĘSTOSKURCZÓW NADKOMOROWYCH
Najczęściej występującymi dolegliwościami u chorych z SVT są: uczucie kołatania serca, zawroty głowy, zasłabnięcia, rzadziej utraty przytomności. Napadowy charakter dolegliwości często prowadzi do zachowań nerwicowych i rodzi problemy w miejscu pracy chorego. Duża nieregularność napadów SVT rzadko skłania chorego i lekarza do podejmowania decyzji o ciągłym leczeniu preparatami antyarytmicznymi, a manewry zwiększające napięcie nerwu błędnego są skuteczne u ograniczonej liczby chorych. Dlatego, u większości chorych z SVT, mamy do czynienia ze znacznym obniżeniem komfortu życia. Groźne objawy występują jedynie u nielicznych chorych z SVT bez organicznej choroby serca. Wyróżniamy wśród nich kardiomiopatię rozstrzeniową, powstającą na podłożu arytmii takich jak: ciągły, ogniskowy częstoskurcz przedsionkowy (AT), ciągły częstoskurcz „łączowy” (PJRT), częstoskurcz ektopowy z łącza przedsionkowo-komorowego. Rozstrzeń lewej komory prowadzi nie tylko do stopniowego rozwoju niewydolności serca, ale istotnie zwiększa ryzyko nagłego zgonu sercowego (SCD). Spośród pacjentów bez organicznej choroby serca ryzyko SCD jest istotne jedynie w zespole Wolffa-Parkinsona-White´a (WPW) (27). U chorych z jawnym WPW i krótką refrakcją drogi dodatkowej (AP) może dojść do przejścia migotania/trzepotania przedsionków (AF/AFlu) w migotanie/trzepotanie komór. Czynniki ryzyka SCD u chorych z WPW to przede wszystkim właściwości elektrofizjologiczne AP: krótka refrakcja AP (poniżej 250 msek) oraz minimalny odstęp R-R podczas napadu AF/AFlu poniżej 220 msek. Ponadto do czynników ryzyka zalicza się: obecność dwóch dróg dodatkowych, występowanie u tego samego chorego napadów AF/AFlu i częstoskurczu nawrotnego z udziałem AP (AVRT). Według niektórych autorów położenie AP w okolicy przegrodowej tylnej i wolnej ścianie lewej komory wiąże się ze zwiększonym ryzykiem SCD (12).
INWAZYJNE BADANIA ELEKTROFIZJOLOGICZNE I ABLACJE PRZEZNACZYNIOWE CZĘSTOSKURCZÓW NADKOMOROWYCH
W dniu dzisiejszym ablacja przeznaczyniowa składa się z części diagnostycznej: inwazyjnego badania elektrofizjologicznego (EPS) oraz właściwego zabiegu ablacji przeznaczyniowej (RFA).
Wskazania do zabiegu ablacji przeznaczyniowych obejmują:
1. Utraty przytomności i zasłabnięcia związane z napadami tachyarytmii;
2. Czynniki zagrożenia życia stwierdzone podczas diagnostyki u chorych z zespołem WPW;
3. Nieskuteczne leczenie farmakologiczne i/lub objawy uboczne farmakoterapii;
4. Życzenie chorego (np. obawa przed działaniami niepożądanymi leków antyarytmicznych).
Poza typowymi analizami: morfologii krwi obwodowej i badań biochemicznych, przed i po RFA powinno się ocenić: 12-odprowadzeniowe EKG, rtg klatki piersiowej i badanie echokardiograficzne u wszystkich chorych. Do wykonania RFA SVT używa się czterech lub pięciu elektrod. Elektrody diagnostyczne 6F zakłada się w celu rejestracji i stymulacji różnych miejsc serca. Poprzez wkłucia do żyły udowej prawej pod kontrolą obrazu skopii rentgenowskiej i kierując się zapisem wewnątrzsercowego EKG umieszcza się je w koniuszku komory prawej (RVA), w prawym przedsionku (HRA) oraz pod zastawką trójdzielną w celu rejestracji potencjału pęczka Hisa (HBE). Dla lepszej orientacji anatomicznej i mapowania pierścienia mitralnego wprowadza się elektrodę wielobiegunową 6F do zatoki wieńcowej z dojścia przez spływ żyły głównej górnej (żyłę odłokciową, żyłę szyjną wewnętrzną, żyłę podobojczykową). Przed wykonaniem RFA wykonuje się badanie elektrofizjologiczne w celu różnicowania tachyarytmii, lokalizacji strefy arytmogennej oraz oceny typowych parametrów elektrofizjologicznych: refrakcji przedsionka, prawej komory, łącza przedsionkowo-komorowego, punktu Wenckebacha.
Inwazyjne badanie elektrofizjologiczne u chorych z SVT
Zespół WPW
Celem inwazyjnego badania elektrofizjologicznego w zespole WPW jest potwierdzenie obecności oraz ocena liczby dodatkowych połączeń przedsionkowo-komorowych. Do istotnych zadań badania elektrofizjologicznego zaliczamy także lokalizację drogi dodatkowej i ocenę współistniejących arytmii. Badanie to jest szczególnie ważne w związku z koniecznością wyboru taktyki postępowania.
W wyniku wstępnej analizy (według metodyki przedstawionej we wcześniejszych publikacjach – 21, 22) otrzymujemy położenie drogi dodatkowej w 4 podstawowych strefach rowka przedsionkowo-komorowego: przegrodowej-przedniej, prawostronnej-bocznej, przegrodowej-tylnej oraz lewostronnej-bocznej. Kolejnym krokiem jest uściślenie położenia szlaku dodatkowego w jednej z 4 stref rowka przedsionkowo-komorowego podczas mapingu endokardialnego.
Ciągły częstoskurcz „łączowy” (PJRT). Potwierdzenia wymaga istnienie wstecznie przewodzącej drogi dodatkowej, co różnicuje PJRT z typem II AVNRT oraz z częstoskurczem przedsionkowym. W przypadku PJRT, stymulując podczas częstoskurczu bodźcem pojedynczym koniuszek komory prawej, w czasie gdy p. Hisa znajduje się w refrakcji, uzyskamy wsteczne przewodzenie do przedsionków co potwierdza istnienie drogi dodatkowej (5).
Częstoskurcz re-entry z łącza przedsionkowo-komorowego
Anatomicznie droga szybko przewodząca położona jest w przednio-górnej części przegrody międzyprzedsionkowej, ponad pęczkiem Hisa, natomiast szlak wolno przewodzący w okolicy ujścia zatoki wieńcowej, wzdłuż przegrodowej części pierścienia zastawki trójdzielnej.
Charakterystycznym zjawiskiem występującym podczas stymulacji przedsionków u 60-70% chorych z AVNRT typu I jest nagłe wydłużenie o ponad 45 msek. odstępu A-H, (odstęp pomiędzy elektrogramem przedsionkowym i elektrogramem pęczka Hisa) zwykle z jednoczesnym wystąpieniem AVNRT. Wiąże się to z podłużnym rozkojarzeniem łącza p-k, a wyraża się zmianą toru przewodzenia przedsionkowo-komorowego z drogi szybko przewodzącej na wolno przewodzącą. Wywołanie częstoskurczu u tych chorych nie nastręcza zwykle trudności. U pozostałych chorych z AVNRT typu I oraz u chorych z AVNRT typu II nie obserwujemy widocznej zmiany toru przewodzenia ze względu na skróconą refrakcję drogi szybko przewodzącej, a do wywołania częstoskurczu musimy często używać bardziej agresywnego protokołu stymulacji przedsionków.
Częstoskurcz przedsionkowy
Mechanizm AT ocenia się na podstawie odpowiedzi na stymulację programowaną: gdy brak jest wpływu stymulacji na częstoskurcz, najbardziej prawdopodobnym mechanizmem AT jest automatyzm patologiczny. Kolejnymi dowodami na istnienie AT jest blok p-k II° podczas częstoskurczu, zjawisko „warm up” oraz brak przerwania częstoskurczu przedsionkowego podaniem Adenozyny i.v.
Ablacja przeznaczyniowa
W Pracowni Rentgenowskiej Wszczepień Stymulatorów i Elektrofizjologii Kliniki Choroby Wieńcowej Instytutu Kardiologii w Warszawie stosowano następujący schemat postępowania: Do zabiegów przezskórnej ablacji używano generatora prądów wysokich częstotliwości firmy P. Osypka – HAT 200S z elektrodami Polaris (Mansfield) do roku 1996 oraz w latach 1997-2000 generatora firmy Medtronic – ATAKR z elektrodami Marinr (Medtronic). W trakcie zabiegu podawano środki uspokajające i przeciwbólowe (midazolam, fentanyl). Na dobę przed i 4 tygodnie po zabiegu podawano kwas acetylosalicylowy w dawce 170 mg/dobę przez 4 tygodnie. heparynę stosowano tylko w przypadkach ablacji z dostępu lewostronnego i utrzymywano jej dożylny wlew przez 12 godzin po zabiegu, a od 1999 roku podawano Heparynę podczas RFA (usunięcie koszulki z tętnicy udowej po normalizacji aPTT).
Metodyka ablacji przeznaczyniowych u chorych z zespołem WPW
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Cain M.E. et al.: PACE 1992, 15:801.
2. Calkins H. et al.: Circulation 1991, 84:2376-2382.
3. Cardiac Arrhythmia Suppression Trial (CAST) Investigators: Preliminary report: effect of encainide and flecainide on mortality in randomized trial of arrhythmia suppression after myocardial infarction. N. Engl. J. Med. 1989, 321(6):406-412.
4. Gallagher J.J. et al.: Prog. Cardiovasc. Dis. 1978, 20, 285.
5. Gallagher J.J., Sealy W.C.: Eur. J. Cardiol. 1978, 8:413.
6. Gallagher J.J. et al.: Variants of preexcitation: Update 1989. W: Zipes D.P.,Jalife J.: Cardiac Electrophysiology - From Cell to Bedside. W.B. Saunders, Philadelphia, 1990, 480.
7. Haissaguerre M., Saoudi N.: Current Opinion in Cardiol. 1994, 9:40-52.
8. Hidricks G. on behalf of the Multicenter European Radiofrequency Survey (MERFS) Investigators of the Working Group on Arrhythmias of the European Society of Cardiology.: Incidence of complete atrioventricular block following attempted radiofrequency catheter modification of the atrioventricular node in 880 patients. Eur. Heart J. 1996, 17:82-88.
9. Hogenhuis W. et al.: Circulation 1993, 88-2:437-446.
10. Jazayeri M. et al.: Circulation 1992. 85:1318-1328.
11. Kay N.G. et al.: J. Am. Coll. Cardiol. 1993, 21:901-909.
12. Klein G.J. et al.: N. Engl. J. Med. 1979, 301:1080.
13. Kuck K.H., Schluter M.: Lancet 1993. 341:1386-1391.
14. Lee R.J. et al.: Circulation 1995, 92:2919-2928.
15. Lee M.A. et al.: Circulation 1991, 83:827-835.
16. Lesh M.D. et al.: Circulation 1994, 89:1074-1089.
17. Lesh M.D. et al.: Am. J. Cardiol. 1992, 19:1303-1309.
18. Morady F. et al.: Circulation 1989, 79:1160.
19. Morady F. et al.: Circulation 1985, 72:170.
20. Prystowsky E.N., Packer D.L.: Pre-excited tachycardias. W: Zipes D.P., Jalife J.: Cardiac Electrophysiology – From Cell to Bedside. W.B. Saunders, Philadelphia, 1990, 472.
21. Pytkowski M. i wsp.: Klinika 1994, 6:17-19.
22. Pytkowski M. i wsp.: Kardiol. Pol. 1994, 40:289.
23. Pytkowski M. i wsp.: Nowa Medycyna 1999, 86:16-22.
24. Sanders W.E. et al.: J. Am. Coll. Cardiol. 1994, 23:926-934.
25. Scheinman M.M. et al.: JAMA 1982. 248:851-855.
26. Tada H. et al.: PACE 1998, 21(Pt. II), 2431-2439.
27. Torner P.M.: Na podstawie: European Registry on Sudden Death in Wolff-Parkinson-White syndrome: Ventricular fibrillation in the Wolff-Parkinson-White syndrome. PACE 1988, 11:46.
28. Wathen M. et al.: Am. J. Cardiol. 1992, 70:886-889.
29. Zipes D.P. et al.: JACC 1995, 26, 2:555-573.





