© Borgis - Medycyna Rodzinna 2/2010, s. 39-45
*Rafał Piotr Piprek
Determinacja płci komórek germinalnych – molekularny mechanizm indukcji mejozy
Determination of germ cell sex – molecular mechanism of meiosis induction
Zakład Anatomii Porównawczej, Instytut Zoologii, Uniwersytet Jagielloński, Kraków
Kierownik Zakładu: prof. dr hab. Wojciech Witaliński
Summary
Germinal sex determination, switching either oo- or spermatogenesis, consists of induction or suppression of meiosis in fetal gonads. For a long time, research has been focused on searching for substances that either induce meiosis or prevent it. It appears that in mice meiosis is induced by retinoic acid which deffuses to gonads from mesonephros. In the early ovary retinoic acid induces the expression of genes driving meiosis. While in the testis germ cells are tightly enclosed by Sertoli cells which degrade retinoic acid owing to CYP26B1 enzyme. Some data suggest the existence of other factors that influence the sex of germinal cells and show that germ cell fate at the embryonic stage is subordinate to the inner gonadal environment. Research on germinal sex are benefited from in vitro cultures and genetic techniques resulting in sex reversals and contribute to understanding of the molecular mechanisms of germ cell tumors.

Wstęp
Komórki rozrodcze są wyjątkowymi komórkami, gdyż dzięki nim możliwe jest rozmnażanie płciowe, a więc przedłużanie istnienia gatunku oraz przekazywanie genów kolejnym pokoleniom. Powstają one na drodze skomplikowanego podziału komórkowego zwanego mejozą, a wszystkie ich komórki prekursorowe tworzą szereg komórek germinalnych lub komórek linii płciowej. Pierwszymi z komórek linii płciowej są komórki prapłciowe (PGC, primordial germ cells), których różnicowanie rozpoczyna się zawsze w rejonach zarodka odległych od gonad, po czym komórki te migrują i zasiedlają zawiązki gonad rozpoznając drogę dzięki chemoatraktantom oraz kontaktom z sąsiednimi komórkami (1). Komórki prapłciowe posiadają materiał genetyczny z zakodowaną płcią genetyczną, niemniej jednak są one niezróżnicowane płciowo na poziomie morfologicznym i w takim stanie wnikają do gonad także jeszcze niezróżnicowanych płciowo. U myszy następuje to w około 10 dpc ( dies post coitum, dni po kopulacji). W tym czasie występują już różnice w ekspresji genów w gonadach osobników XX i XY. W gonadach osobników XY rozpoczyna się ekspresja genu Sry (2). Dzień później dostrzegalne są już morfologiczne symptomy płciowego różnicowania się gonad. Wyraźne zmiany dotyczą jądra ( testis), gdzie komórki linii płciowej (germinalne) otoczone zostają przez różnicujące się komórki Sertoliego (ryc. 1). Tworzą się w ten sposób wydłużone struktury zwane sznurami jądrowymi, które są zawiązkami kanalików plemnikotwórczych. W zarodkowym jajniku komórki linii płciowej tworzą skupiska otoczone komórkami somatycznymi, a struktury zwartych sznurów nie są wyraźnie dostrzegalne, przez co komórki germinalne w różnicujących się jajnikach nie są odseparowane od interstycjum gonady (3, 4). W następnych dniach po rozpoczęciu płciowego różnicowania somatycznej części gonady (u myszy w 13,5 dpc) pojawiają się pierwsze symptomy płciowego różnicowania się komórek germinalnych (ryc. 2). Otóż w zarodkowym jajniku komórki te wchodzą w profazę pierwszego podziału mejotycznego, podczas gdy mejoza w gonadzie męskiej rozpoczyna się dopiero podczas okresu dojrzewania płciowego, co u myszy następuje tydzień po narodzinach, a u ludzi w ok. 11. roku życia (5). Przez wiele lat usiłowano dowiedzieć się co determinuje płeć komórek linii płciowej, a więc płeć germinalną. Oogeneza, a więc proces powstawania komórek jajowych, polega na rychłym wejściu oogoniów w stadium profazy mejozy i zatrzymaniu się oocytów I° na tym etapie, aż do momentu owulacji. Pociąga to za sobą bardzo wczesne ustalenie liczby komórek rozrodczych żeńskich i wyczerpanie zapasu ich komórek prekursorowych. Spermatogeneza, a więc proces powstawania plemników, charakteryzuje się zahamowaniem podziałów spermatogoniów po zamknięciu ich w sznurach jądrowych i wznowieniem ich proliferacji w okresie dojrzewania płciowego oraz późnym wejściem w mejozę z zachowaniem spermatogoniów, które są ciągłym źródłem prekursorowych komórek spermatogenicznych (ryc. 2). Wskazuje to na odmienne mechanizmy gametogenezy w jajnikach oraz jądrach i nasuwa myśl, że determinacja płci komórek germinalnych, a więc skierowanie ich na drogę oogenezy lub spermatogenezy, polega na indukcji lub zahamowaniu mejozy.
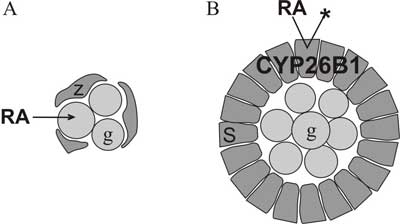
Ryc. 1. Organizacja komórek w zarodkowych gonadach.
A. W jajniku znajdują się gniazda germinalne składające się z komórek linii płciowej (g) luźno otoczonych prekursorowymi komórkami ziarnistymi (z). Kwas retinowy (RA) swobodnie wnika do komórek, indukując mejozę.
B. Zarodkowe jądro wypełniają sznury jądrowe, zawierające komórki germinalne ściśle otoczone komórkami Sertoliego (S), które rozkładają kwas retinowy poprzez enzym CYP26B1. Nie dopuszcza to do indukcji mejozy.

Ryc. 2. Zróżnicowanie losów komórek germinalnych w gonadach żeńskich i męskich. Komórki prapłciowe kończą fazę silnej proliferacji i migracji, wnikając do gonad tuż przed okresem determinacji płci, który u myszy przypada na około 10,5 dpc. Dwie doby później różnicujące się komórki Sertoliego zaczynają tworzyć sznury jądrowe. W 13,5 dpc komórki te zapobiegają inicjacji mejozy i przyczyniają się do zahamowania podziałów mitotycznych komórek germinalnych poprzez rozkład substancji MIS i produkcję substancji MPS. W tym czasie MIS indukuje mejozę w jajniku, po czym oocyty zostają uśpione w stadium profazy aż do narodzin, kiedy to wznowiona zostaje mejoza w jajnikach oraz mitoza spermatogoniów w jądrach myszy.
Pierwotnie poszukiwano odpowiedzi na pytanie czy to otoczenie, a więc komórki somatyczne gonad, czy zapisana w komórkach germinalnych informacja genetyczna determinuje los komórek, które dadzą początek komórkom rozrodczym. Szybko okazało się, że skierowanie komórek na drogę oogenezy lub spermatogenezy zależy raczej od otoczenia, w którym znajdują się te komórki, niż od płci genetycznej. Wskazują na to odwrócenia płci oraz osobniki chimeryczne, u których płeć gonady jest niezgodna z płcią genetyczną. W tych przypadkach płeć germinalna jest zgodna z płcią gonadalną, ale jest przeciwna niż płeć genetyczna (6). Sugeruje to wydzielanie przez komórki somatyczne substancji kierujących płciowym różnicowaniem się komórek germinalnych. Hipotetyczną substancję indukującą mejozę nazwano MIS ( meiosis-inducing substance), natomiast substancję, która ma zapobiegać mejozie w zarodkowym jądrze określono jako MPS ( meiosis-preventing substance).
Badania, polegające na wywołaniu odwrócenia płci gonad za pośrednictwem określonych substancji lub mutacji, wskazały na istnienie okresu, w którym możliwe jest odwrócenie płci komórek germinalnych (7). Okres finalnego ustalenia ich płci przypada u myszy na 12,5 dpc, co zbiega się z zamknięciem tych komórek przez komórki Sertoliego w procesie tworzenia sznurów jądrowych. Komórki germinalne XY mogą różnicować się w oocyty jedynie przed 12,5 dpc. Powstanie zwartej warstwy komórek Sertoliego wskazuje na stworzenie specyficznej niszy i odseparowanie spermatogoniów od reszty gonady oraz od wpływu hipotetycznych czynników indukujących mejozę w zarodkowej gonadzie (MIS). Płeć komórek germinalnych XX zostaje ustalona w 13,5 dpc, kiedy tracą one zdolność do przejścia na drogę spermatogenezy i wchodzą w mejozę. Tak więc oocyt nie może stać się komórką spermatogeniczną, podobnie jak zamknięte w sznurach jądrowych spermatogonia nie wejdą w oogenezę.
Rola śródnercza w indukcji mejozy
Liczne badania wskazują na szereg substancji mających wpływ na komórki germinalne, co pozwoliło ustalić kilka substancji potencjalnie indukujących i hamujących mejozę. Niestety rezultaty eksperymentów prowadzonych w różnych ośrodkach badawczych są sprzeczne. Już wczesne badania wykazały, że zarodkowa nerka, a więc śródnercze ( mesonephros), jest konieczna do zainicjowania mejozy. Wycięcie śródnerczy skutkuje brakiem mejozy w zarodkach XX, co sugeruje wydzielanie przez ten organ substancji indukujących mejozę (8). Kolejne badania z wykorzystaniem gonad hodowanych in vitro wraz ze śródnerczami lub bez nich potwierdzają tę hipotezę. Obserwacje te pokazały także, że śródnercze nie jest konieczne dla prawidłowego przebiegu spermatogenezy i zapobiegania mejozie w rozwijających się jądrach. Co ciekawe komórki germinalne XY w zarodkowych jądrach wchodzą w mejozę po uszkodzeniu sznurów jądrowych lub komórek Sertoliego (9). Tak więc wyniki wskazują, że hipotetyczna substancja indukująca mejozę (MIS) jest wydzielana przez śródnercze, skąd dyfunduje do gonad, podczas gdy czynnik zapobiegający wejściu w mejozę (MPS) jest produkowany w gonadzie męskiej przez komórki somatyczne sznurów jądrowych. Przeszczepianie komórek germinalnych XY z młodego jądra do śródnercza osobnika XY nie powoduje wejścia tych komórek w mejozę (8). Sugeruje to, że substancja MPS wydzielana przez sznury jądrowe może dyfundować do pobliskich narządów, w tym do śródnercza lub śródnercze jest źródłem także substancji hamujących mejozę. Do błędnej interpretacji roli MIS w indukcji mejozy mogą doprowadzić wyniki badań komórek germinalnych hodowanych in vitro w różnych pożywkach oraz z innymi tkankami. Okazało się, że komórki linii płciowej w otoczeniu komórek płuc i nadnercza, jak również w niektórych pożywkach wchodzą w mejozę, co mogłoby sugerować, że komórki te mają wewnętrzną zdolność wchodzenia w ten podział komórkowy (10-12). Dalsze badania pokazały jednak, że substancje indukujące mejozę odpowiadają także za rozwój płuc, co wyzwoliłoby mejozę w hodowli in vitro. Pokazało to, że komórki germinalne nie posiadają wrodzonej zdolności wejścia w mejozę i w tym procesie podlegają wpływom komórek sąsiednich.
Poznanie wpływu śródnercza na indukcję mejozy oraz opisanie rozwoju śródnercza, który jest procesem postępującym od przodu ku tyłowi tego narządu, tłumaczy pojawienie się komórek mejotycznych (mejocytów), a konkretnie oocytów I°, najpierw w dogłowowym rejonie jajnika i postępowanie mejozy w kierunku tylnym (13). Najwcześniejsze kanaliki śródnercza rozwijają się w rejonie przednim tego narządu i dlatego w rejonie przednim jajnika najwcześniej pojawia się substancja MIS i tym samym pierwsze mejocyty. Postępujący rozwój kolejnych kanalików śródnercza ku tyłowi skutkuje dyfuzją MIS do coraz bardziej tylnych regionów gonady. Jednak z drugiej strony można przypuszczać, że komórki prapłciowe zasiedlają najpierw przednią część zawiązku gonady, a później jej środkowy i tylny odcinek, dlatego komórki te są dojrzalsze w przedniej części jajnika i wcześniej wchodzą tu w mejozę. Co ciekawe także w przednim biegunie jądra pojawiają się komórki mejotyczne. Można przypuszczać, że w tym rejonie substancja MIS pojawia się jeszcze przed zamknięciem komórek germinalnych w sznurach jądrowych. W tym miejscu tworzy się sieć jądra ( rete testis), będąca siecią płonnych kanalików wyprowadzających plemniki z jądra. Badania pokazują, że komórki mejotyczne w jądrze destabilizują sznury jądrowe, doprowadzając do ich rozkładu (13). Dlatego można zaproponować mechanizm rozwojowy, który polega na indukcji mejozy przez MIS pochodzący z najwcześniejszych kanalików śródnercza, a następnie destabilizacji sznurów jądrowych w tym miejscu i ich przekształceniu w sieć jądra.
Kwas retinowy indukuje mejozę
Kolejne badania identyfikowały geny ulegające ekspresji w komórkach wchodzących w mejozę. Wykazano, że w jajnikach w 12,5 dpc wzrasta ekspresja genu Stra8 ( stimulated by retinoic acid 8) (14, 15). Wiadomo już było, że ekspresja tego genu jest indukowana przez kwas retinowy (RA), który jest pochodną witaminy A. Kwas retinowy jest więc związkiem tłuszczowym odgrywającym istotną rolę w niektórych procesach rozwoju, regulując ekspresję genów po związaniu się z jego białkami receptorowymi RAR. Znane są 3 dehydrogenazy odpowiedzialne za syntezę tego kwasu z retinaldehydu oraz 3 enzymy z grupy CYP26 (cytochrom P450RAI, hydroksylaza kwasu retinowego), które rozkładają kwas retinowy (16). Wykazano, że RALDH2, będący głównym enzymem syntetyzującym kwas retinowy w zarodkach ssaków, jest obecny w kanalikach śródnercza myszy (14). Wskazuje to wpływ kwasu retinowego syntetyzowanego w śródnerczu na mejozę w młodych gonadach. W celu określenia roli kwasu retinowego w rozwoju gonad przeprowadzono doświadczenia polegające na hodowli gonad wyizolowanych z zarodków mysich w pożywkach z dodatkiem antagonistów receptorów RAR. Okazało się, że kwas retinowy jest kluczowym induktorem mejozy, gdyż zablokowanie jego funkcji skutkuje brakiem ekspresji genu Stra8oraz brakiem mejozy (14, 15). Zrodziło się pytanie, jak kwas retinowy indukuje mejozę jedynie w jajniku, mimo że jest syntetyzowany w śródnerczach obu płci. Ponadto zarówno komórki germinalne jądra, jak i jajnika mogą być regulowane przez kwas retinowy, jako że posiadają receptory RAR. Badania ujawniły ekspresję genu kodującego enzym CYP26B1 w komórkach Sertoliego jądra myszy od 12,5 dpc (14). Enzym ten rozkłada kwas retinowy w siateczce śródplazmatycznej. Sugeruje to, że kwas retinowy dyfunduje zarówno do jajnika, jak i jądra, ale w gonadzie męskiej jest rozkładany w komórkach Sertoliego, które otaczają komórki germinalne, tworząc specyficzną niszę (ryc. 1). Tłumaczy to dlaczego uszkodzenie sznurów jądrowych skutkuje wyzwoleniem mejozy w zarodkowych jądrach. Enzym CYP26B1 jest obecny w komórkach somatycznych zawiązków gonad XX i XY jeszcze przed okresem determinacji płci chroniąc komórki germinalne przed niepożądanym wejściem w mejozę. Wskazuje to, że szlak determinacji płci żeńskiej doprowadza do wyciszenia ekspresji genu Cyp26b1umożliwiając regulację różnicowania jajnika przez kwas retinowy.
Hodowla gonad XY w 11,5 dpc w pożywce z dodatkiem kwasu retinowego i inhibitorów enzymu CYP26B1, takich jak ketokonazol, skutkuje apoptozą komórek germinalnych oraz niewielkim (1%) wzrostem liczby mejocytów (14, 15). Substancje te nie wpływają na losy komórek germinalnych męskich po 12,5 dpc, gdy komórki te są już zamknięte w sznurach jądrowych. Sugeruje to także, że kwas retinowy jest konieczny dla proliferacji i przeżywalności komórek linii płciowej. Kolejnego dowodu na rolę CYP26B1 w zapobieganiu mejozie w młodych jądrach dostarczyły badania z zakresu genetyki funkcjonalnej. Znokautowanie genu Cyp26b1u myszy doprowadziło do pojawienia się oocytów w gonadach męskich (17), co poparte zostało badaniami in vitro (18).
Badania przeprowadzone na zarodkach kur wykazały, że w jajnikach tych ptaków kwas retinowy pochodzi z komórek kory gonady; jest więc syntetyzowany niejako na miejscu i nie dyfunduje ze śródnercza (19). W jądrach kurczaków kwas retinowy powstaje w komórkach sznurów jądrowych i jest od razu w tych samych komórkach rozkładany, aby nie doprowadzić do wejścia komórek germinalnych w mejozę. Wskazuje to na pewne różnice w miejscu syntezy czynników determinacji płci germinalnej jednak sam mechanizm indukcji mejozy wydaje się dość uniwersalny wśród zwierząt.
Interesujące okazały się także badania indukcji mejozy w jądrach osobników dojrzewających. W okresie dojrzewania komórki Sertoliego przestają wykazywać ekspresję enzymów degradujących kwas retinowy natomiast pojawiają się w nich enzymy syntetyzujące ten kwas (20). Enzymy CYP26, rozkładające kwas retinowy, występują z kolei w komórkach peritubularnych otaczających kanaliki nasienne. Dlatego przypuszcza się, że to retinal, czyli aldehyd witaminy A, dociera do komórek Sertoliego, które redukują go do kwasu retinowego wiązanego następnie w spermatogoniach przez białko CRABP1 ( cellular RA-binding protein 1). Tak więc także w dojrzałych jądrach kwas retinowy indukuje ekspresję genu Stra8i tym samym mejozę, działając na drodze parakrynowej. Tłumaczy to związek deficytu witaminy A z bezpłodnością u myszy i szczurów.
Pozostałe substancje zaangażowane w determinację płci komórek germinalnych
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. McLaren A: Primordial germ cells in the mouse. Dev Biol 2003; 262: 1-15. 2. Sekido R et al.: SOX9is up-regulated by the transient expression of SRY specifically in Sertoli cell precursors. Dev Biol 2004; 274: 271-279. 3. Loffler KA, Koopman P: Charting the course of ovarian development in vertebrates. Int J Dev Biol 2002; 46: 503-510. 4. Piprek RP: Molecular machinery of mammalian gonad differentiation. Int J Dev Biol 2010; 54: 779-786. 5. Bloodworth JMB: Endocrine Pathology. The Williams and Wilkins Co., Baltimore 1968. 6. Piprek RP: Genetyczne podłoże zaburzeń determinacji płci i rozwoju gonad. Endokrynol Pol 2008; 59: 502-514. 7. Adams IR, McLaren A: Sexually dimorphic development of mouse primordial germ cells: switching from oogenesis to spermatogenesis. Development 2002; 129: 1155-1164. 8. McLaren A: Meiosis and differentiation of mouse germ cells. Symp Soc Exp Biol 1984; 38: 7-23. 9. Evans CW et al.: Regulation of meiosis in the foetal mouse gonad. J Embryol Exp Morph 1982; 68: 59-67. 10. McLaren A, Southee D: Entry of mouse embryonic germ cells into meiosis. Dev Biol 1997; 187: 107-113. 11. Chuma S, Nakatsuji N: Autonomous transition into meiosis of mouse fetal germ cells in vitro and its inhibition by gp130-mediated signaling. Dev Biol 2001; 229: 468-479. 12. Farini D et al.: Growth factors sustain primordial germ cell survival, proliferation and entering into meiosis in the absence of somatic cells. Dev Biol 2005; 285: 49-56. 13. Yao HH, DiNapoli L, Capel B: Meiotic germ cells antagonize mesonephric cell migration and testis cord formation in mouse gonads. Development 2003; 130: 5895-5902. 14. Bowles J et al.: Retinoid signaling determines germ cell fate in mice. Science 2006; 312: 596-600. 15. Koubova J et al.: Retinoic acid regulates sex-specific timing of meiotic initiation in mice. Proc Natl Acad Sci USA 2006; 103: 2474-2479. 16. Hasebeck RJ, Hoffmann I, Duester G: Distinct function for Aldh1 and Raldh2 in the control of ligand production for embryonic retinoid signaling pathways. Dev Genet 1999; 25: 353-364. 17. McLean G et al.: Apoptotic extinction of germ cells in testes of CYP26B1 knockout mice. Endocrinology 2007; 148: 4560-4567. 18. Trautmann E et al.: Retinoic acid prevents germ cell mitotic arrest in mouse fetal testes. Cell Cycle 2008; 7: 656-664. 19. Smith CA et al.: Onset of meiosis in the chicken embryo; evidence of a role for retinoic acid. BMC Dev Biol 2008; 8: 85. 20. Vernet N et al.: Retinoic acid metabolism and signaling pathways in the adult and developing mouse testis. Endocrinology 2006; 147: 96-110. 21. Best D et al.: Sdmg1 is a conserved transmembrane protein associated with germ cell sex determination and germline-soma interactions in mice. Development 2008; 135: 1415-1425. 22. Molyneaux KA, Schaible K, Wylie C: GP130, the shared receptor for the LIF/IL6 cytokine family in the mouse, is not required for early germ cell differentiation, but is required cell-autonomously in oocytes for ovulation. Development 2003; 130: 4287-4294. 23. Colvin JS et al.: Male-to-female sex reversal in mice licking fibroblast growth factor 9. Cell 2001; 104: 875-889. 24. Chassot AA et al.: Activation of b-catenin signaling by Rspo1 controls differentiation of the mammalian ovary. Hum Mol Genet 2008; 17: 1264-1277. 25. Piprek RP: Molecular mechanisms underlying female sex determination – antagonism between female and male pathway. Folia Biologica 2009; 57: 105-113. 26. Tsuda M et al.: Conserved role of nanos protein in germ cell development. Science 2003; 301: 1239-1241. 27. Suzuki A, Saga Y: Nanos2 suppresses meiosis and promotes male germ cell differentiation. Genes Dev 2008; 22: 430-435. 28. Vainio S et al.: Female development in mammals is regulated by Wnt-4 signaling. Nature 1999; 397: 405-409. 29. Ottolenghi C et al.: Foxl2is required for commitment to ovary differentiation. Hum Mol Genet 2005; 14: 2053-2062. 30. Couse JF et al.: Postnatal sex reversal of the ovaries in mice lacking estrogen receptors alpha and beta. Science 1999; 286: 2328-2331. 31. Dupont S et al.: Effect of single and compound knockouts of estrogen receptors alpha (ERaphfa) and beta (ERbeta) on mouse reproductive phenotypes. Development 2000; 127: 4277-4291. 32. Dupont S et al.: Expression of Sox9in granulosa cells lacking the estrogen receptors, ERalpha and ERbeta. Dev Dyn 2003; 226: 103-106. 33. Britt KL et al.: Estrogen regulates development of the somatic cells phenotype in the eutherian ovary. FASEB J 2002; 16: 1389-1397. 34. Britt KL et al.: The effects of estrogen on the expression of genes underlying the differentiation of somatic cells in the murine gonad. Endocrinology 2004; 145: 3950-3960. 35. Britt KL, Findlay JK: Regulation of the phenotype of ovarian somatic cells by estrogen. Mol Cell Endocrinol 2003; 202: 11-17. 36. Cattanach BM, Pollard CE, Hawker SG: Sex-reversed mice: XX and XO males. Cytogenetics 1971; 10: 318-337. 37. Lue Y et al.: XXY male mice: an experimental model for Klinefelter syndrome. Endocrinology 2001; 142: 1461-1470. 38. Mahadevaiah SK et al.: Mouse homologues of the human AZF candidate gene RBM are expressed in spermatogonia and spermatids, and map to a Y chromosome deletion interval associated with a high incidence of sperm abnormalities. Hum Mol Genet 1998; 7: 715-727. 39. Turner JMA et al.: Silencing of unsynapsed meiotic chromosomes in the mouse. Nat Genet 2005; 37: 41-47. 40. Cools M et al.: Germ cell tumors in the intersex gonad: old paths, new directions, moving frontiers. Endocr Rev 2006; 27: 468-484. 41. Wu Z, Luby-Phelps K, Bugde A: Capacity for stochastic self-renewal and differentiation in mammalian spermatogonial stem cells. J Cell Biol 2009; 187: 513-524.


