© Borgis - Postępy Nauk Medycznych 3/2010, s. 222-226
*Joanna Matuszkiewicz-Rowińska
Zasady leczenia nerkozastępczego w ostrym uszkodzeniu nerek
Principles for renal replacement therapy in acute kidney injury
Katedra i Klinika Nefrologii, Dializoterapii i Chorób Wewnętrznych Warszawskiego Uniwersytetu Medycznego
Kierownik Katedry i Kliniki: prof. dr hab. med. Joanna Matuszkiewicz-Rowińska
Streszczenie
Pomimo istotnego postępu technicznego w leczeniu nerkozastępczym i rozwoju medycyny intensywnej śmiertelność w ciężkich postaciach ostrego uszkodzenia nerek (AKI – acute kidney injury) utrzymuje się na wysokim poziomie. Wypracowanie spójnych zasad terapii utrudnia obecność kontrowersji niemal we wszystkich jej aspektach: wyboru metody, wielkości dawki leczenia nerkozastępczego i momentu jego rozpoczęcia. W pracy przedstawiono obecnie stosowane techniki nerkozastępcze i omówiono wyniki dotychczasowych badań, dotyczących dawki i momentu rozpoczęcia terapii.
Summary
Despite a substantial technical progress in renal replacement therapy and intensive care medicine the mortality rate for severe acute kidney injury (AKI) remains very high. Moreover there is a lot of controversy in almost all therapeutic issues: the technique which should be used, the dosage of renal replacement therapy which should be given, and the moment when the therapy should be started. In this article the current renal replacement techniques are reviewed and the existing data on their dose and timing of initiation of the therapy are discussed.

Śmiertelność w ostrym uszkodzeniu nerek (AKI – acute kidney injury) jest bardzo duża, i choć w ostatnich latach nieco się zmniejszyła, to jednak nadal utrzymuje się na bardzo wysokim poziomie, średnio wynosząc ok. 30%, a w ciężkich przypadkach, u pacjentów oddziałów intensywnej terapii siegając 80% (1). W odróżnieniu od izolowanej postaci choroby, która jest na ogół stosunkowo prosta do leczenia, grupa pacjentów z oddziałów intensywnej terapii, u których niewydolność nerek stanowi zwykle część zespołu uszkodzeń wielonarządowych, może stwarzać istotne problemy terapeutyczne (patrz ryc. 1). Należą do niej przypadki ciężkiej sepsy lub wstrząsu septycznego, chorzy po zabiegach kardiochirurgicznych, rozległych operacjach brzusznych, urazach i ciężkich oparzeniach, a także osoby z gwałtownie postępującą niewydolnością wątroby oraz po przeszczepieniu narządów i komórek macierzystych. Pacjenci z tej grupy znajdują się często w stanie krytycznym i charakteryzują się znaczną niestabilnością hemodynamiczną oraz hyperkatabolizmem. Wymagają oni często agresywnego leczenia wieloma lekami, żywienia pozajelitowego i stosowania różnych urządzeń, podtrzymujących podstawowe funkcje życiowe. Z tego ostatniego powodu, a także ze względu na ciężki stan ogólny, chorzy ci zwykle nie nadają się do transportu i leczenie musi być u nich prowadzone w macierzystym oddziale, przy łóżku.
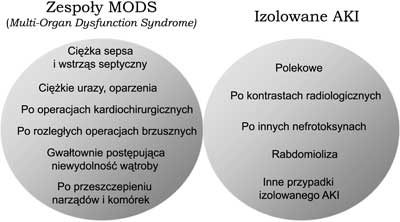
Ryc. 1. Grupy przyczyn ostrej niewydolności nerek: zespoły uszkodzeń wielonarządowych (MODS) i izolowane AKI.
Od wielu lat nefrolodzy, starając się wypracować zasady leczenia, próbują znaleźć odpowiedzi na następujące pytania: Jaka technika nerkozastepcza jest optymalna? Kiedy powinno sie zaczynać leczenie? Jaka powinna być jego dawka? Niestety do tej pory, mimo wielu przeprowadzonych badań, nie udało się uzyskać odpowiedzi na żadne z tych pytań.
Wybór techniki nerkozastępczej
W tabeli 1 przedstawiono metody leczenia nerkozastępczego stosowane w praktyce klinicznej u chorych z AKI. Podstawową i najszerzej stosowaną formą terapii pozostaje tu standardowa przerywana hemodializa (IHD – intermittent hemodialysis). Jest ona techniką bardzo wydajną, jednakże właśnie przez swoją intensywność prowadzi ona do dużych zmian w osmolalności płynów ustrojowych, przez co sprzyja zarówno niestabilności hemodynamicznej, jak i zwiększeniu ciśnienia śródczaszkowego, z ryzykiem rozwoju obrzęku mózgu.
Tabela 1. Techniki nerkozastępcze stosowane obecnie w praktyce klinicznej u chorych z AKI.
Przerywana hemodializa (IHD)
Techniki ciągłe (CRRT)
? Ciągła żylno-żylna hemofitracja (CVVHF)
? Ciągła żylno-żylna hemodiafiltracja (CVVHDF)
Tzw. techniki hybrydowe
? Powolna niskoprzepływowa hemodializa (SLED)
? Powolna niskoprzepływowa hemodiafiltracja (SLED-f)
Dializa otrzewnowa (DO)
? Wysokoobjętościowa dializa otrzewnowa |
Techniki ciągłe. Konwekcyjne techniki ciągłe, takie jak ciągła żylno-żylna hemofiltracja (CVVHF – continuous veno-venous hemofiltration) i hemodiafiltracja (CVVHDF – continuous veno-venous hemodiafiltration), zapewniają większą stabilność hemodynamiczną. Prowadzi się je z założenia przez całą dobę (z wyjątkiem czasu potrzebnego na zmianę filtru i na ew. inne zabiegi diagnostyczne), w związku z czym proces wyrównywania zaburzeń odbywa się tu wolno, co sprzyja stabilności hemodynamicznej i poprawia tolerancję ultrafiltracji. Do innych zalet CVVHF/CVVHDF należą: dobra kontrola mocznicy i istotnie wyższe niż w IHD klirensy średnich cząsteczek, a także fakt, że nie wymagają one stacji uzdatniania wody. Niestety techniki te mają istotne wady. Podstawową wadą jest wysoki koszt zabiegów, kilkukrotnie większy w stosunku do IHD, na co składa się głównie koszt płynu substytucyjnego i filtrów. Istotne problemy może stwarzać konieczność stałej heparynizacji; tutaj pewnym rozwiązaniem tego problemu może być zastosowanie regionalnej antykoagulacji za pomocą cytrynianów. Zabiegi ciągłe wymagają stałej czujności personelu. Należy też pamiętać, że ich skuteczność jest wysoka pod warunkiem, że są one rzeczywiście ciągłe czyli stosowane bez przerwy, co czasami jest trudne do osiagnięcia, gdyż chorzy często wymagają wykonania róznych zabiegów diagnostycznych i terapeutycznych.
Najczęstsze sytuacje, w których wybiera się techniki ciągłe to: stany przebiegające z niestabilnością hemodynamiczną, sepsa i wstrząs septyczny, oraz stany z podwyższonym ciśnieniem śródczaszkowym i zagrożeniem obrzękiem mózgu (marskość wątroby). Takim kluczowym elementem, jest tu zapewnienie przez nie łagodnego spadku osmolalności osocza. W badaniach Davenporta i wsp. u chorych leczonych za pomocą CVVHF z ultrafiltracją ok. 2 l/godz. spadek osocza po godzinie zabiegu wynosił średnio 1,9 mOsm/kg, podczas gdy po godz IHD siegał on aż 7,2 mOsm/kg (p<0,05) (2). Taka powolna redukcja osmolalności powodowała znacznie mniejsze zmiany w obrębie ciśnienia śródczaszkowego, w odróżnieniu od IHD, podczas której obserwowano wyraźny jego wzrost w trzeciej godzinie zabiegu.
Niestety, pomimo licznych przeprowadzonych do tej pory badań nie udało się uzyskać dowódów przewagi technik ciągłych nad standardową IHD. W latach 90. przeprowadzono szereg badań obserwacyjnych na ten temat, zwykle jednak badane grupy okazywały się nieporównywalne, tzn. chorzy leczeni w sposób ciągły byli ciężej chorymi, co istotnie wpływało na śmiertelność (3-5). Po zastosowaniu różnych analiz wieloczynnikowych różnice, co do przeżycia i czasu trwania niewydolności nerek, znikały.
Badań randomizowanych porównujących metody leczenia nerkozastępczego w AKI było niewiele, a ich wyniki są sprzeczne. Mehta i wsp. porównywali skuteczność CVVHDF i codziennej IHD u 166 pacjentów oddziału intensywnej terapii i stwierdzili większą śmiertelność zarówno w czasie pobytu w oddziale intensywnej terapii (59,5 vs 41,5%, p<0,02), jak i wewnątrzszpitalną (65,5 vs 47,6%, p<0,02) w grupie osób leczonych za pomocą CVVHDF (1). Jednakże, mimo randomizacji grupy różniły się istotnie i po skorygowaniu tych różnic zarówno przeżycie chorych, jak i czas trwania niewydolności nerek okazały się podobne. W badaniu Augustine i wsp. nie stwierdzono również istotnych różnic pod względem przeżycia, natomiast w grupie leczonej za pomocą technik ciągłych obserwowano mniej epizodów niestabilnośći hemodynamicznej i lepszą kontrolę stanu nawodnienia chorych (6). Istotnych danych nie wniosło również największe z dotychczasowych badań – HEMODIAFE Study, które objęło łącznie 360 chorych (7).
Techniki hybrydowe. Metody te stanowią interesującą alternatywę do hemofiltracyjnych technik ciągłych. Najbardziej znaną z nich jest technika dyfuzyjna zwana powolną niskowydajną dializą (SLED – slow low-efficiency dialysis). Podstawą jest tu duże zwolnienie tempa dializy, które uzyskuje się dzięki znacznemu zwolnieniu przepływu płynu dializacyjnego. Im wolniej płynie płyn, tym dłużej trwa zabieg, konieczne jest bowiem zachowanie pożądanych klirensów. Przepływ krwi wynosi zwykle 100-200 ml/min. Przy bardzo dużych zaburzeniach hemodynamicznych, we wstrząsie, dializę taką można prowadzić w sposób ciągły przy minimalnym przepływie płynu (nawet do 30 ml/min), wszystkie zmiany zachodzą wówczas bardzo łagodnie. Odmianą tej techniki jest SLED-f, czyli dializa typu SLED wzbogacona o hemofiltrację.
Metoda SLED łączy zalety przerywanej hemodializy i technik ciągłych, z jednoczesnym wyeliminowaniem szeregu ich wad. Pozwala na leczenie chorych z niestabilnością hemodynamiczną, zapewniając dobrą tolerancję ultrafiltracji. Jednocześnie, w przeciwieństwie do technik ciągłych, może być ona wykonywana bez heparyny, a prowadzona najczęściej przez 10-12 godzin/dobę – zostawia margines wolnego czasu, kiedy chory nie jest podłączony do maszyny, na różnego typu zabiegi pielęgnacyjne i diagnostyczne. Dzięki tym zaletom, SLED ma duże szanse wyprzeć CVVHF/CVVHDF z wielu sytuacji klinicznych, jako tańsza, mniej brutalna i znacznie prostsza technika.
Dializa otrzewnowa. Dializa otrzewnowa (DO) jest stosowana u chorych z AKI rzadko. Ma ona wiele zalet. Zapewnia stabilność hemodynamiczną, nie wymaga antykoagulacji systemowej, ani skomplikowanego sprzętu i można ją wykonać wszędzie. Problemem jest jednak jej mała wydajność, co czyni ją nieprzydatną u chorych z hiperkatabolizmem (8). Uważa się, że wykonanie DO można rozważyć u chorych po urazach głowy, z niestabilnością hemodynamiczną, czynnymi krwawieniami lub ich ryzykiem i we wszystkich sytuacjach, gdy nie ma możliwości przeprowadzenia zabiegu pozaustrojowego.
W ostatnich latach pojawiły się próby zwiększenia wydajności tej metody poprzez zastosowanie tzw. wysokoobjętościowej ciągłej DO (9-11). Gabriel i wsp. wykazali, że wysokoobjętościowa DO jest porównywalna z prowadzoną codziennie standardową IHD zarówno pod względem metabolicznym, jak i co do przeżycia chorych (12). Śmiertelność wynosiła 58% vs 53%. Przy czym okres leczenia (5,5 ± 2,7 vs 7,5 ± 3,1 dnia; p=0,02) i czas trwania AKI (7,2 ± 2,6 vs 10,6 ± 4,7 dni; p=0,04) były krótsze w grupie leczonej otrzewnowo.
Generalnie uważa się, że w sytuacji braku dowodów przewagi którejkolwiek techniki dializacyjnej nad innymi, wybór powinien zależeć od możliwości danego ośrodka i stanu klinicznego pacjenta. W Katedrze i Klinice Nefrologii i Dializoterapii Warszawskiego Uniwersytetu Medycznego, w której dysponujemy wszystkimi omówionymi metodami, u chorych będących w ciężkim stanie ogólnym, z hipotonią, otrzymujących aminy katecholowe, a także wszędzie tam, gdzie należy liczyć się z niestabilnością hemodynamiczną wykonujemy zabiegi typu SLED, które prowadzimy w systemie Genius(r). Natomiast droższe i bardziej skomplikowane techniki ciągłe, rezerwujemy dla chorych z ciężką sepsą i wstrząsem septycznym. W pozostałych przypadkach wykonujemy zabiegi standardowej IHD. Czasem w różnych okresach leczenia stosujemy różne techniki, zależnie od zmieniającego się stanu klinicznego danego pacjenta.
Rozpoczynanie leczenia
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Mehta RL, McDonald B, Gabbai FB et al for Collaborative Group for Treatment of ARF in the ICU: A randomized clinical trial of continuous versus intermittent dialysis for acute renal failure. Kidney Int 2001; 60: 1154-63.
2. Davenport A: Renal replacement therapy for the patient with acute traumatic brain injury and severe acute kidney injury. Contrib Nephrol 2007; 156: 333-339.
3. van Bommel EF, Bouvy ND, So KL et al.: Acute dialytic support for the critically III: intermittent hemodialysis versus continuous arteriovenous hemodiafiltration. Am J Nephrol 1995; 15: 192-200.
4. Bellomo R, Farmer M, Parkin G et al.: Severe acute renal failure: a comparison of acute continuous hemodiafiltration and conventional dialytic therapy. Nephron 1995; 71: 59-64.
5. Guérin C, Girard R, Selli JM, Ayzac L: Intermittent versus continuous renal replacement therapy for acute renal failure in intensive care units: results from a multicenter prospective epidemiological survey. Intensive Care Med 2002; 28: 1411-8.
6. Augustine JJ, Sandy D, Seifert TH, Paganini EP: A randomized controlled trial comparing intermittent with continuous dialysis in patients with ARF. Am J Kidney Dis 2004; 44: 1000-1007.
7. Vinsonneau C, Camus C, Combes A et al on behalf of the Hemodiafe Study Group: Continuous venovenous haemodiafiltration versus intermittent haemodialysis for acute renal failure in patients with multiple organ dysfunction syndrome: a multicentre randomised trial. Lancet 2006; 368: 379-85.
8. Phu NH, Hien TT, Mai NTH et al.: Hemofiltration and Peritoneal Dialysis in Infection-Associated Acute Renal Failure in Vietnam. N Engl J Med 2002; 347: 895-902.
9. Chitalia V, Almeida AF, Rai H et al.: Is peritoneal dialysis adequate for hypercatabolic acute renal failure in developing countries? Kidney Int 2002; 61: 747-757.
10. Gabriel DP, Nascimento GVR, Caramori JT et al.: High volume peritoneal dialysis for acute renal failure. Perit Dial Int 2007; 27: 277-282.
11. Gabriel DP, Caramori JT, Martin LC et al.: Continuous peritoneal dialysis compared with daily hemodialysis in patients with acute kidney injury. Perit Dial Int 2009; 29: S62-S71.
12. Gabriel DP, Caramori JT, Martim LC et al.: High volume peritoneal dialysis vs daily hemodialysis: a randomized, controlled trial in patients with acute kidney injury. Kidney Int Suppl 2008; 108: S87-93.
13. Teschan PE, Baxter CR, O'Brien TF et al.: Prophylactic hemodialysis in the treatment of acute renal failure. Ann Intern Med 1960; 53: 992-1016.
14. Schiffl H, Lang SM, Fischer R: Daily hemodialysis and the outcome of acute renal failure. N Engl J Med 2002; 346: 305-10.
15. Ronco C, Bellomo R, Homel P et al.: Effects of different doses in continuous veno-venous haemofiltration on outcomes of acute renal failure: a prospective randomised trial. Lancet 2000; 356: 26-30.
16. Bouman CS, Oudemans-Van Straaten HM, Tijssen JG et al.: Effects of early high-volume continuous venovenous hemofiltration on survival and recovery of renal function in intensive care patients with acute renal failure: a prospective, randomized trial. Crit Care Med 2002; 30: 2205-11.
17. Tolwani AJ, Campbell RC, Stofan BS et al.: Standard versus high-dose CVVHDF for ICU-related acute renal failure. J Am Soc Nephrol 2008; 19: 1233-1238.
18. Palevsky PM, Zhang JH, O'Connor 5. TZ et al.: Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008; 359: 7-20.
19. The RENAL Replacement Therapy Study Investigators: Intensity of continuous renal-replacement therapy in critically ill patients. N Engl J Med 2009; 361: 1627-1638.

