© Borgis - Postępy Nauk Medycznych 11/2010, s. 851-853
*Tadeusz Dębniak, Jan Lubiński
Clinical genetics of malignant melanoma
Genetyka kliniczna czerniaka
International Hereditary Cancer Centre, Department of Genetics and Pathology, Pomeranian Medical University, Szczecin, Poland
Head of Department of Genetics and Pathology: prof. dr hab. med. Jan Lubiński
Streszczenie
Czerniak złośliwy jest jednym z najbardziej agresywnych nowotworów, jego częstość wzrasta gwałtownie w ostatnich latach. Zwiększone ryzyko zachorowania na czerniaka u potomstwa osób chorych na ten nowotwór jak również rodzinne agregacje tego nowotworu sugerują, że predyspozycja genetyczna jest istotnym czynnikiem uczestniczącym w patogenezie czerniaka. Rodzinny czerniak stanowi najprawdopodobniej heterogenną grupę przypadków o różnym typie dziedziczenia, w większości przypadków wielogenowym. Nierzadko obserwuje się jednak rodzinne agregacje wykazujące cechy autosomalnie dominującego typu dziedziczenia, charakterystycznego dla chorób jednogenowych o wysokiej penetracji. Podłoże genetyczne czerniaka jest złożone i zależne od wielu genów. Głównym genem ryzyka jest CDKN2A. Częsta konstytucyjna zmiana tego genu – A148T, zwiększa ryzyko zachorowania na czerniaka niezależnie od nowotworowego wywiadu rodzinnego. Mutacje genów ARF oraz CDK4, związane z wysokim ryzykiem zachorowania na MM, są niezwykle rzadkie i nie mają istotnego znaczenia w praktyce klinicznej. W większości rodzinnych czerniaków mutacje genu CDKN2A nie występują, co wskazuje na potrzebę identyfikacji nowych genów związanych z predyspozycją do tego nowotworu. Poznano kilka genów/mutacji umiarkowanie modyfikujących ryzyko MM. Ich lista obejmuje XPD, MC1R, BRCA2. Wdrożenie odpowiednich programów diagnostyczno-profilaktycznych oraz leczniczych może zmniejszyć zachorowalność i śmiertelność. Testy genetyczne oraz analizy danych rodowodowo-klinicznych powinny być wykonywane u wszystkich pacjentów z rozpoznanym czerniakiem, także w przypadkach z ujemnym wywiadem rodzinnym.
Summary
Malignant melanoma (MM) represents one of the most aggressive neoplasms and its frequency is increasing rapidly. Increased melanoma risk among relatives of MM patients and familial aggregations of this malignancy point at genetic predisposition as an important factor of MM pathogenesis. Familial MM constitutes most probably a heterogenous group of disorders characterized by occurrence of MM among relatives. The mode of inheritance is controversial and most likely polygenic, however not infrequently, within large families aggregations of MM is consistent with autosomal dominant inheritance.
The genetic basis of MM is complex and appears to involve multiple genes. CDKN2A is regarded as the major MM susceptibility gene. In the Polish population common CDKN2A variant (A148T) increases significantly melanoma risk regardless of the cancer family history. Mutations of other high risk genes, ARF and CDK4 are extremely rare and thus clinically insignificant. In majority of MM cases CDKN2A mutations are not found. It is thus necessary to perform association studies focused on identifying genetic markers that could be used in identifying patients with a high risk of MM. List of other genes that carry mutations, which are believed to be associated with moderate MM risk include XPD, MC1R, BRCA2. The management with individuals being at increased MM risk involves clinical screening according to carefully planned surveillance schedule and early treatment of MM tumour. The appropriate management may reduce morbidity and mortality. Genetic testing and clinical evaluation should be performed, and family history should be obtained in all patients affected with MM, also in those with apparently sporadic tumours.

Malignant melanoma (MM) represents one of the most aggressive neoplasms. Each year over 2 thousand new cases are diagnosed in Poland (1). Its incidence has increased dramatically over the past years in Caucasian population worldwide up to a 10-fold increase since 1950s (2). Well-established environmental risk factor of MM is ultraviolet radiation (3). Exposure in childhood seems to be an especially dangerous (4). Additional risk factors include: 1) dysplastic nevi, 2) large number of pigmented nevi (> 100), 3) fair skin (type 1 and 2 according to Fitzpatrick) (5, 6).
Increased risk of melanoma occurrence for offspring of affected parents (7, 8) as well as familial aggregations of this malignancy point that genetic susceptibility is another major MM risk factor. There are two distinct ways of defining familial melanoma: 1) occurrence of melanoma in at least two first-degree relatives; or 2) families with at least two melanomas irrespective of the degree of relationship. Approximately 3-15% of all MM are familial cases of any type (9). In our center among 810 unselected MM patients 26 cases (3.2%) had at least one first-degree relative affected.
In several families the co-occurrence of melanoma of the skin and the eye is reported (10). The question whether ocular melanoma is also part of the familial melanoma syndrome remains unanswered (fig. 1)
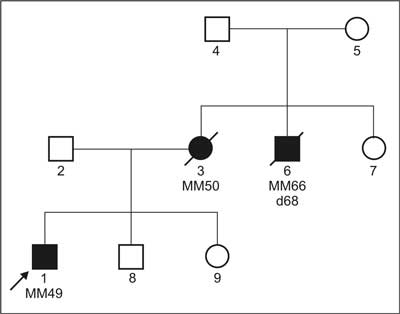
Fig. 1. Familial aggregation of melanoma among I degree relatives of the patent with MM.
Aggregations of MM and other malignancies have been reported by many authors, such as pancreatic cancer, brain tumors or breast cancer (11, 12, 13, 14). Results of studies performed in our center suggest an increased risk of breast cancer among first-degree relatives of MM probands diagnosed before 55 from families with strong cancer familial aggregation has been suggested.
Familial MM constitutes most probably a heterogeneous group of disorders characterized by different patterns of inheritance, in majority of cases polygenic one (15). Not infrequently, within large families aggregations of MM are consistent with autosomal dominant inheritance with high penetrance.
Malignant melanoma caused by germline CDKN2A mutations
The incidence of malignant melanoma is significantly increased among CDKN2A mutatation carriers (16, 17). The penetrance of this gene shows some variations and depends on the age and geographic origin (18). Germline CDKN2A mutatios have been detected in 46% of Frenach melanoma-prone families and in 18% of US familial cases. Among Swedish families only 8% of cases were found to harbour alterations in the CDKN2A gene, among Polish less than 6% (19, 20, 21, 22, 23). It is estimated that the frequency of the CDKN2A mutations correlates with the number of MM cases in the family and a young age at diagnosis (<50) (24). Selection criteria for genetic assessment of patients with familial melanoma include: 1) occurrence of three or more primary melanomas, 2) patients with three or more melanomas in aggregate among first or second degree relatives, 3) families with the presence of three or more cases of melanoma and/or pancreatic cancer on the same side of the family (25).
Other genes conferring risk of MM development
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Zatoński W, Tyczyński J: Cancer in Poland in 2003. The Maria-Skłodowska-Curie Memorial Cancer Center, Department of Epidemiology and cancer Prevention, National Cancer Registry, Warsaw 2004.
2. Weinstock MA: Issues in the epidemiology of melanoma. Hematol Oncol Clin North Am 1998; 12: 681-98.
3. English DR, Armstrong BK, Kricker A et al.: Sunlight and cancer. Review. Cancer Causes Control 1997; 8: 271-83.
4. Whiteman DC, Whiteman AC, Green AC: Childhood sun exposure as a risk factor for melanoma – a systematic review of epidemiological studies. Cancer causes control 2001; 12: 69-82.
5. Wachsmuth RC, Harland M, Bishop JA: The atypical-mole syndrome and predisposition to melanoma. N Engl J Med 1998; 339: 348-9.
6. Grange F, Chompret A, Guilloud-Bataille M et al.: Comparison between familial and nonfamilial melanoma in France. Arch Dermatol 1995; 131: 1154-9.
7. Hemminki K, Li X, Plna K et al.: The nation-wide Swedish family-cancer database-updated structure and familial rates. Acta Oncol 2001; 40: 772-7.
8. Goldgar DE, Easton DF, Cannon-Albright LA et al.: Systematic population-based assessment of cancer risk in first-degree relatives of cancer probands. J Natl Cancer Inst 1994; 86: 1600-8.
9. Berwick M, Wiggins C: The current epidemiology of cutaneous malignant melanoma. Front Biosci 2006; 11: 1244-54.
10. de Snoo FA, Bergman W, Gruis NA: Familial melanoma: a complex disorder leading to controversy on DNA testing. Fam Cancer 2003; 2: 109-16.
11. Whelan AJ, Bartsch D, Goodfellow PJ: Brief report: a familial syndrome of pancreatic cancer and melanoma with a mutation in the CDKN2 tumor-suppressor gene. New Eng J Med 1995; 33: 975-7.
12. Parker JF, Florell SR, Alexander A et al.: Pancreatic carcinoma surveillance in patients with familial melanoma. Arch Dermatol 2003; 139: 1019-25.
13. Sandberg T, Nilsson K et al.: High frequency of multiple melanomas and breast and pancreas carcinomas in CDKN2A mutation-positive melanoma families. J Natl Cancer Inst 2000; 92: 1260-6.
14. Kaufman DK, Kimmel DW, Parisi JE et al.: A familial syndrome with cutaneous malignant melanoma and cerebral astrocytoma. Neurology 1993; 43: 1728-31.
15. Tsao H: Update on familial cancer syndromes and the skin. J Am Acad Dermatol 2000; 42: 939-71.
16. Hussussian CJ, Struewing JP, Goldstein AM et al.: Germline p16 mutations in familial melanoma. Nat Genet 1994; 8: 15-21.
17. Kamb A, Shattuck-Eidens D, Eeles R et al.: Analysis of the p16 gene ( CDKN2) as a candidate for the chromosome 9p melanoma susceptibility locus. Nat Genet 1994; 8: 22-6.
18. Bishop DT, Demenais F, Goldstein AM et al.: Melanoma Genetics Consortium. Geographical variation in the penetrance of CDKN2A mutations for melanoma. J Natl Cancer Inst 2002; 94: 894-903.
19. Soufir N, Avril MF, Chompret A et al.: Prevalence of p16 and CDK4 germline mutations in 48 melanoma-prone families in France. The French Familial Melanoma Study Group. Hum Mol Genet 1998; 7: 941.
20. FitzGerald MG, Harkin DP, Silva-Arrieta S et al.: Prevalence of germ-line mutations in p16, p19ARF, and CDK4 in familial melanoma: analysis of a clinic-based population. Proc Natl Acad Sci USA 1996; 93: 8541-5.
21. Platz A, Hansson J, Ringborg U: Screening of germline mutations in the CDK4, CDKN2C and TP53 genes in familial melanoma: a clinic-based population study. Int J Cancer 1998; 25: 13-5.
22. Platz A, Hansson J, Mĺnsson-Brahme E et al.: Screening of germline mutations in the CDKN2A and CDKN2B genes in Swedish families with hereditary cutaneous melanoma. J Natl Cancer Inst 1997; 89: 697-702.
23. Dębniak T, Górski B, Scott RJ et al.: Germline mutation and large deletion analysis of the CDKN2A and ARF genes in families with multiple melanoma or an aggregation of malignant melanoma and breast cancer. Int J Cancer 2004; 110: 558-62.
24. Avril MF, Chompret A et al.: Genetic and environmental factors in cutaneous malignant melanoma. Biochimie 2002; 84: 67-74.
25. Leachman SA, Carucci J, Kohlmann W et al.: Selection criteria for genetic assessment of patients with familial melanoma. J Am Acad Dermatol 2009 Oct; 61 (4): 677. e1-14.
26. Bishop DT et al.: Genome-wide association study identifies three loci associated with melanoma risk. Nat Genet 2009; 41 (8): 920-5.
27. Dębniak T, Scott RJ, Huzarski T et al.: The CDKN2A common variants and their association with melanoma risk: a population-based study. Cancer Res 2005; 65: 835-9.
28. Tomescu D, Kavanagh G, Ha T et al.: Nucleotide excision repair gene XPD polymorphisms and genetic predisposition to melanoma. Carcinogenesis 2001; 22: 403-8.
29. Dębniak T, Scott R, Masojc B et al.: MC1R common variants, CDKN2A and their association with melanoma and breast cancer risk. Int J Cancer 2006; 119: 2597-602.
30. Scott RJ, Vajdic CM, Armstrong BK et al.: BRCA2 mutations in a population-based series of patients with ocular melanoma. Int J Cancer 2002; 102: 188-91.

