© Borgis - Nowa Pediatria 4/2010, s. 140-144
*Katarzyna Pawelec1, Małgorzata Salamonowicz1, Piotr Plichta2, Michał Matysiak1
Powikłania leczenia immunoablacyjnego u pacjentki z anemią aplastyczną
SIDE EFFECTS OF IMMUNOABLATIVE TREATMENT IN GIRL WITH APLASTIC ANAEMIA
1Katedra i Klinika Pediatrii Hematologii i Onkologii Warszawskiego Uniwesytetu Medycznego
Kierownik Katedry i Kliniki: prof. dr hab. med. Michał Matysiak
2Studenckie Koło Naukowe przy Katedrze i Klinice Pediatrii Hematologii i Onkologii Warszawskiego Uniwesytetu Medycznego
Summary
We report a 17-year old girl, with aplastic anemia, treated with immunoablative therapy, because of lack of familiar bone marrow donor. Patient achieved partially remission. In one year time after IST, there was palpable mass found in her left breast which was excised. Histopatological examination confirmed fibroadenoma. Presently on physical examination there are palpable nodular lesions in the left breast. Eight months after finishing IST girl developed avascular necrosis of the right femoral. Conservative treatment was administrated. Two years after first clinical symptoms the patient is able to walk without pain although the range of motion of the right hip is partially diminished.The girl remains under systematic control.

WSTĘP
Przeszczep szpiku kostnego od dawcy spokrewnionego uznawany jest obecnie za podstawową metodę leczenia pacjentów z ciężką i bardzo ciężką postacią anemii plastycznej. W przypadku braku zgodnego dawcy rodzinnego stosuje się leczenie immunosupresyjne z zastosowaniem globuliny końskiej bądź króliczej w osłonie sterydów razem z cyklosporyną i czynnikami wzrostu granulocytów. Leczenie to nie jest jednak pozbawione objawów ubocznych.
Do najczęstszych powikłań związanych z podawaniem globuliny antylimfocytarnej należą: gorączka, wysypka, duszność, spadek ciśnienia.
W trakcie leczenia immunoablacyjnego obserwuje się również typowe posterydowe działania uboczne takie jak otyłość, nadciśnienie, trądzik. Najczęstszymi powikłaniami stosowania czynników wzrostowych są reakcje uczuleniowe czy zespół przesiąkania włośniczkowego. W takcie leczenia anemii aplastycznej bardzo często obserwowane są powikłania związane ze stosowaniem cyklosporyny, wśród których najczęstszymi są przerost dziąseł, nadmierne owłosienie oraz hepato- i nefrotoksyczność.
Poza wymienionymi powyżej, obserwuje się również inne powikłania, które choć spotykane są stosunkowo rzadko, to jednak w znacznym stopniu mogą wpłynąć na jakość życia pacjenta, po zakończeniu właściwej terapii. Do tej grupy powikłań zaliczyć można wystąpienie włókniaka młodzieńczego oraz jałową martwicę głowy kości udowej.
Włókniak młodzieńczy (fibroadenoma juvenile-FJ) wykrywany jest głównie u młodych kobiet, poniżej 35. r.ż. Najczęściej ma on postać pojedynczej, niebolesnej zmiany o dużej ruchomości względem otaczających tkanek. Wykrywany jest palpacyjnie, często przez same pacjentki. U ok. 10% chorych zmiany mogą być mnogie. Istotnym badaniem pomagającym w diagnostyce włókniaka młodzieńczego jest USG piersi, a potwierdzeniem rozpoznania, badanie histopatologiczne usuniętej zmiany. Leczeniem z wyboru włókniaka młodzieńczego jest, bowiem chirurgiczne usunięcie zmiany, co jednak w przypadku zmian mnogich nie zawsze jest możliwe w radykalny sposób.
Wśród czynników sprzyjających rozwojowi FJ wymienia się między innymi długotrwałe stosowanie cyklosporyny A (CSA) oraz pochodnych estradiolu.
Jałowa martwica głowy kości udowej (acascular necrosis, AVN) jest schorzeniem, w którym w wyniku zaburzeń naczyniowych o różnorodnej etiologii, dochodzi do obumarcia tkanki kostnej. Zmiany martwicze powstają na skutek upośledzenia krążenia krwi i mogą być spowodowane zatorami, mikrourazami czy też zaburzeniami hormonalnymi. AVN towarzyszą znaczne dolegliwości bólowe, ograniczony zakres ruchu i utrata funkcji stawu.
W pracy naszej przedstawiamy przypadek 17-letniej obecnie dziewczynki z ciężką postacią anemii aplastycznej (SAA), u której po leczeniu immunoablacyjnym (IST) stwierdzono liczne powikłania, wśród których najcięższymi było wystąpienie włókniaka młodzieńczego oraz jałowej martwicy kości udowej.
OPIS PRZYPADKU
15,5-letnia wówczas dziewczynka, przyjęta została do naszej kliniki w celu diagnostyki i leczenia pancytopenii krwi obwodowej, stwierdzonej w szpitalu rejonowym. W wywiadzie podawała ona utrzymujące się od około miesiąca osłabienie, okresowo występujące bóle głowy i nasilające się krwotoczne zmiany w skórze i na śluzówkach. Pacjentka nie przebyła infekcji w ostatnich tygodniach, ani też nie była narażona na kontakt ze związkami chemicznymi.
Przy przyjęciu do kliniki stan ogólny dziewczynki był średni. W badaniu przedmiotowym zwracała uwagę znaczna bladość skóry, liczne wybroczyny i wylewy podskórne, tachykardia do 120 uderzeń na minutę i podkrwawianie z dziąseł. Nie obserwowano u niej powiększonych węzłów chłonnych ani hepatosplenomegalii. W badaniach laboratoryjnych stwierdzono głęboką pancytopenię krwi obwodowej niedokrwistość (Hb-4,5 g/dl), małopłytkowość (PLT-8 x 109/l) oraz leukopenię (L-2 x 109/l) z granulocytopenią (GR-0,6 x 106/l) Poziom wit B₁₂ oraz kwasu foliowego mieścił się w granicach normy. Serologiczne markery w kierunku zakażeń HBV, HCV, CMV, EBV, Parwowirusem B19 były negatywne. Poziom limfocytów CD 34 + we krwi obwodowej był obniżony, co było pomocne w różnicowaniu z fazą hipoplastyczną zespołu mielodysplastycznego. Badanie erytrocytów nie wykazało defektu krwinek charakterystycznego dla nocnej napadowej hemoglobinurii – badanie inhibitorów komplementu na erytrocytach CD59 – ekspresja prawidłowa, CD55 – brak ekspresji na ok. 6% komórek.
W badaniu cytogenetycznym komórek szpiku wykonanym techniką prążkową GTG CBG, stwierdzono prawidłowy kariotyp żeński (46XX).
W celu wykluczenia anemii typu Fanconiego wykonano badanie w kierunku łamliwości chromosomów z krwi obwodowej, którego wynik był negatywny. Biopsja aspiracyjna szpiku kostnego, wykazała szpik hipoplastyczny z pobudzonym układem czerwonokrwinkowym, nieco skąpym układem granulocytarnym, bogatym układem chłonnym (28% utkania) oraz brakiem megakariocytów. W badaniu histopatologicznym trepanobioptatu szpiku stwierdzono 10% komórkowość.
Na podstawie danych z wywiadu, badania przedmiotowego oraz wyników badań dodatkowych, w tym badania szpiku i krwi obwodowej rozpoznano u dziewczynki anemię aplastyczną, która spełniała kryteria postaci ciężkiej (severe AA-SAA): GR < 0,5x109/l, PLT < 20 x 109/l, retykulocyty < 20 x 109/l, komórkowość szpiku < 25%.
Badania układu HLA dziewczynki, rodziców oraz rodzeństwa, nie pozwoliły na znalezienie zgodnego rodzinnego dawcy szpiku, a tym samym na przeprowadzenie leczenia z wyboru, którym jest przeszczep szpiku kostnego. Wobec takiej sytuacji zakwalifikowano dziewczynkę do skojarzonego leczenia immunoablacyjnego – IST. Do czasu rozpoczęcia IST, przez okres 2 miesięcy niedokrwistość i małopłytkowość korygowano uzupełniającymi przetoczeniami preparatów krwiopochodnych.
W lutym 2006 rozpoczęto leczenie IST: globuliną antylimfocytarną króliczą (ATG) 3,75 mg/kg m.c iv przez 5 dni z cyklosporyną (CSA) 5 mg/kg m.c. w dwóch dawkach podzielonych p.os oraz metylprednisolonem (Solumedrol) w dawkach zmniejszających się 2-1-0,5 mg/kg m.c iv przez 3 tygodnie. Stosowano także granulocytarne czynniki wzrostu dożylnie lub podskórnie w okresie głębokiej granulocytopenii. Wlew ATG przebiegł bez powikłań z wyjątkiem gorączki, która wystąpiła, w pierwszych dwóch dniach leczenia.
W trakcie dalszej hospitalizacji obserwowano u dziewczynki nasilone krwawienia miesięczne związane ze skazą małopłytkową. Z tego powodu włączono leczenie hormonalne (pochodne etynyloestradiolu z lewonorgestrelem). Obserwowano również liczne powikłania związane ze stosowaniem CSA takie jak trądzik, przerost dziąseł i nadmierne owłosienie.
W kolejnych badaniach kontrolnych zarówno morfologii krwi obwodowej jak i szpiku, wykonanych w dniach 84, 112 i 180 od początku leczenia, nie stwierdzono u pacjentki remisji choroby.
Ze względu na brak odpowiedzi na leczenie IST rozpoczęto procedurę poszukiwania niespokrewnionego dawcy szpiku, a ponieważ nie udało się go znaleźć, w listopadzie 2006 tj. 8 miesięcy po rozpoczęciu leczenia powtórzono kurację IST stosując tym razem ATG końską w dawce 15 mg/kg m.c. iv łącznie z CSA 5 mg/kg m.c, w dwóch dawkach podzielonych p. os, w osłonie metylprednisolonu (Solumedrol), oraz granulocytarny czynnik wzrostu. Częściową remisję choroby (PR) uzyskano dopiero w 180 dniu leczenia (Hb-8,7 g/dl L-1,3 gran- 500 PLT-40 000).
W styczniu 2007 (11 miesięcy po rozpoczęciu leczenia CSA) w badaniu przedmiotowym stwierdzono palpacyjnie u pacjentki, guzek piersi lewej o wymiarze 10 x 6 x 5 cm. Jego obecność potwierdzono w badaniu USG (ryc. 1), sugerując, iż może on odpowiadać guzowi liściastemu i zalecono dalszą obserwację.
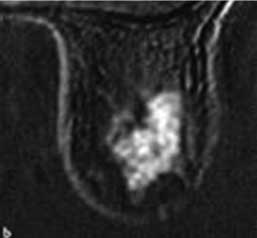
Ryc. 1. Włókniak młodzieńczy – USG.
W kontrolnym badaniu USG, wykonanym po miesiącu, stwierdzono kolejną zmianę guzkową (wymiar 5 x 4 cm) w piersi prawej i kolejne 3 zmiany w piersi lewej (największa o wymiarach 6 x 5 x 8 cm). Z powodu utrzymującej się małopłytkowości (PLT-20 000) odstąpiono od diagnostycznej biopsji zmian decydując się na zabieg operacyjny i śródoperacyjne badanie histopatologiczne. Zabieg przeprowadzono dwuetapowo w odstępie 1 miesiąca z powodu obustronnych i mnogich zmian.
W pierwszym etapie operacji wycięto największe zmiany z piersi lewej (wymiary 10 x 6 x 5 cm), a następnie w kolejnym etapie usunięto w całości dwie zmiany z piersi prawej (wymiary 6 x 5 x 8 cm i 5 x 4 cm).
W badaniu histopatologicznym wszystkich usuniętych zmian rozpoznano włókniaka młodzieńczego (fibroadenoma juvenile) (ryc. 2).
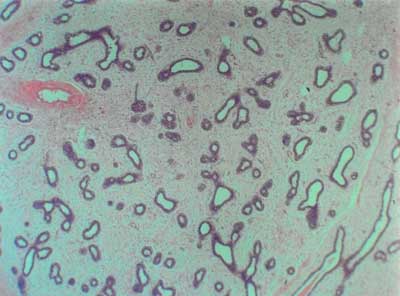
Ryc. 2. Obraz histopatologiczny włókniaka młodzieńczego.
Obecnie (osiem miesięcy po operacji) w badaniu fizykalnym stwierdzono ponownie zmiany guzkowe wyczuwalne w lewej piersi, a obraz w badaniu USG sugeruje ponownie włókniaka. Zmiany wymagają dalszej obserwacji (USG). Obecnie, (4 lata od rozpoczęcia leczenia) dziewczynka jest w pełnej remisji SAA. Zakończono leczenie cyklosporyną, którą otrzymywała łącznie przez 27 miesięcy.
W czerwcu 2007 r. u pacjentki pojawiła się gorączka oraz ból pulsacyjny w okolicy pachwinowej prawej, odczuwalny podczas chodzenia. W badaniu przedmiotowym stwierdzono ograniczoną ruchomość stawu biodrowego prawego, zwłaszcza w zakresie odwodzenia i rotacji wewnętrznej oraz tkliwość w okolicy stawu, a także dodatni objaw Trendelenburga. W badaniu rtg stawu biodrowego prawego stwierdzono jego nierówny zarys, ubytki podchrzęstne głowy prawej kości udowej oraz niewielkie nawarstwienie okostnej przy szyjce kości udowej przy braku zmian w panewce (ryc. 3).
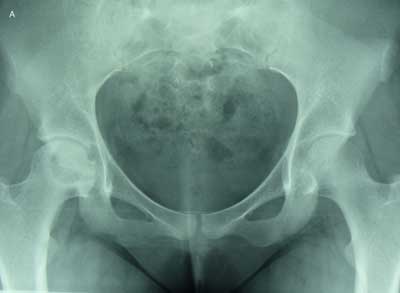

Ryc. 3. Na zdjęciu rtg w projekcji AP (a) i w pozycji żaby (b) stawów biodrowych widoczny nierówny zarys, ubytki podchrzęstne głowy kości udowej oraz niewielkie nawarstwienie okostnej przy szyjce kości udowej po stronie prawej.
W celu oceny ukrwienia wykonano badania MR stawów biodrowych z podaniem kontrastu, które uwidoczniło dobrze odgraniczoną zmianę o wymiarach 35 x 22 x 30 mm w głowie kości udowej prawej, otoczoną niskosygnałowym rąbkiem. Zmiana ta we wszystkich sekwencjach badania miała sygnał zbliżony do sygnału prawidłowego szpiku kostnego i ulegała niewielkiemu wzmocnieniu kontrastowemu, głównie w obwodowych częściach (ryc. 4). Obraz MR wskazywał na gojące się ognisko martwicy jałowej.
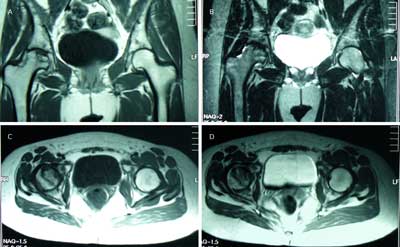
Ryc. 4. Zdjęcia rezonansu magnetycznego przedstawiają jałową matrwicę głowy kości udowej prawej odpowiednio: przekrój czołowy obraz w sekwencji T1-zależnej z kontrastem (a), przekrój czołowy w sekwencji T2-zależnej (b), przekrój osiowy sekwencja T1-zależna (c) oraz przekrój osiowy sekwencja T2-zależna z kontrastem (d). Widoczna dobrze odgraniczona zmiana w głowie kości udowej prawej otoczona niskosygnałowym rąbkiem. Zmiana we wszystkich sekwencjach badania miała sygnał zbliżony do sygnału prawidłowego szpiku kostnego i ulegała niewielkiemu wzmocnieniu kontrastowemu, głównie w obwodowych częściach.
Lewy staw biodrowy był prawidłowy.
W oparciu o dane z wywiadu, badania przedmiotowego oraz wyniki badań dodatkowych rozpoznano jałową martwicę kości udowej prawej.
Po konsultacji w Klinice Ortopedii zalecono oszczędzający tryb życia, w tym poruszanie się o kulach. Dodatkowo wyznaczono termin zabiegu nawiercenia głowy kości udowej. Mający na celu zmniejszenie ciśnienia w jamie szpikowej, poprawę drenażu żylnego i rewaskularyzacji. Ostatecznie jednak odstąpiono od wykonania planowanej operacji, z powodu małopłytkowości. Zalecono więc dalszą rehabilitację w poradni rejonowej oraz okresową kontrolę w Klinice Ortopedii.
Obecnie, po 4,5 latach od rozpoznania u dziewczynki AVN, choć ustąpiły ostre objawy choroby, to jednak nadal utrzymuje się ograniczenie ruchu w stawie biodrowym w zakresie odwodzenia i rotacji wewnętrznej oraz niewielkiego stopnia utykanie.
OMÓWIENIE
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Locasciulli A et al.: Outcome of patients with acquired aplastic anemia given first line bone marrow transplantation or immunosuppressive treatment in the last decade: a report from the European Group for Blood and Marrow Transplation. Haematologica 2007; 92:11-18. 2. Maury S et al.: Unrelated stem cell transplantation for severe acquired aplastic anemia: improved outcome in the era of high-resolution HLA matching between donor and recipient. The Hematology Journal 2007; 92(05): 589-296. 3. Kojima S et al.: Immunosuppressive therapy using antithymocyte globulin, cyclosporine,and danazol with or without human granulocyte colony-stimulating factor in children with acquired aplastic anemia. Blood 2000; 96: 2049-2054. 4. Neal S et al.: Current concepts in the pathophysiology and treatment of aplastic anemia. Blood 2006; 108: 2509-2519. 5. Frickhofen N et al.: Antithymocyte globulin with or without cyclosporin A: 11-year follow-up of a randomized trial comparing treatments of aplastic anemia. Blood 2003; 101: 1236-1241. 6. Susan P et al.: Cyclosporin A induced fibroadenomas of the Breast: Raport of five Cases. Radiology 2001; 220: 465-468. 7. Son E et al.: Characteristic imaging features of Brest fibroadenomas in women given cyclosporin A after renal transplantation. J Clin Ultrasound 2004 Feb; 32: 69-77. 8. Muttarak M et al.: Multiple bilateral giant fibroadenoma associated with cyclosporine A therapy in renal transplant recipent. Australas Radiol. 2001; 45: 517-519. 9. Cyrlak D et al.: Breast imaging case of the day: multiple giant fibroadeniomas associated with cyclosporin A therapy. RadioGraphics 1999; 19: 549-551. 10. Binkovay F et al.: Risk of developing fibroadenima with the use of cyclosporine A in renal transplant recipients. Ren Fail 2005; 27: 721-725. 11. Baidam A et al.: Cyclosporin A and multiple fibroadenoams of the breast. Br J Surg 1996; 83: 1755-1757. 12. Mankin HJ: Non traumatic osteonecrosis of bone (osteonecrosis). N Eng J Med 1992; 326: 1473-1478. 13. Cui Q, Wang GJ, Balian G: Steroid-induced adipogenesis in a pluripotential cell line from bone marrow. J Bone Joint Surg 79A: 1054-1063, 1997. 14. Shibatani M et al.: Degree of corticosteroid treatment within the first 2 months of renal transplantation has a strong influence on the incidence of osteonecrosis of the femoral head. Acta Orthop. 2008 Oct; 79 (5): 631-6. 15. Torii Y et al.: Osteonecrosis of the femoral head after allogeneic bone marrow transplantation. Clin Orthop Relat Res 2001 Jan; (382): 124-32. 16. Laroche M, Arlet J, Mazieres B: Osteonecrosis of the femoral and humeral heads after intraarticular corticosteroid injections. J Rheumatol 1990 Apr; 17 (4): 549-51. 17. Marsh JC et al.: Avascular necrosis after treatment of aplastic anaemia with antilymphocyte globulin and high-dose methylprednisolone. Br J Haematol. 1993 Aug; 84 (4): 731-5.18. Mattano Jr LA et al.: Osteonecrosis as a complication of treating acute lymphoblastic leukemia in children: a report from the Children?s Cancer Group. J Clin Oncol 2000; 18: 3262-3272.19. Tuncay IC et al.: Femoral head necrosis after kidney transplantation. Transplant Proc 1998; 30: 800-801.





