© Borgis - Postępy Nauk Medycznych 4/2011, s. 267-273
*Jan Kuś
Nieswoiste śródmiąższowe zapalenie płuc, organizujące zapalenie płuc i inne rzadsze postacie zapaleń śródmiąższowych
Nonspecific interstitial pneumonia, organizing pneumonia and other rare interstitial pneumonias
I Klinika Chorób Płuc Instytutu Gruźlicy i Chorób Płuc w Warszawie
Kierownik Kliniki: prof. dr hab. med. Jan Kuś
Streszczenie
Nieswoiste śródmiąższowe zapalenie płuc (NSIP) jest drugim, a organizujące zapalenie płuc (OP) trzecim co do częstości występowania śródmiąższowym zapaleniem po samoistnym włóknieniu płuc omówionym w oddzielnym artykule. Obydwie postacie zapaleń mogą mieć nieznaną etiologię i są wtedy rozpoznawane jako idiopatyczne lub mogą występować wtórnie do innych chorób, najczęściej układowych chorób tkanki łącznej. Ostre śródmiąższowe zapalenie płuc (AIP) i limfocytarne śródmiąższowe zapalenie płuc (LIP) są rzadkie, mogą występować jako samoistne lub jako wtórne, najczęściej w przebiegu chorób tkanki łącznej – LIP i AIP oraz zaburzeń odporności – LIP.
Zapalenie oskrzelików z cechami choroby śródmiąższowej płuc (RB-ILD) oraz złuszczające zapalenie śródmiąższowe płuc (DIP) są obecnie uważane za jedną chorobę lub różne stadia tej samej choroby, a ich przyczyną jest palenie papierosów. Wszystkie z wymienionych zapaleń śródmiąższowych wymagają dla rozpoznania wykonania biopsji płuca. Poza AIP wszystkie rokują lepiej niż UIP.
Summary
Nospecific interstitial pneumonia (NSIP) is the second and organizing pneumonia (OP) is the third, after the idiopathic interstitial fibrosis, most common form of the idiopathic interstitial pneumonias. Except of idiopathic forms, both NSIP and OP could occur secondary to other diseases, particulary connective tissue disease. Acute interstitial pneumonia and lymphoid interstitial pneumonia are rare. Both can be idiopathic as well as secondary to other diseases. AIP and LIP could be the manifestation of connective tissue disease and LIP can occur in patients with common variable immunodeficiency and HIV infection. Respiratory bronchiolitis interstitial lung disease (RB-ILD) and desquamative interstitial pneumonia (DIP) are tabacco smoking related and are considered as one disease or separate stages of the same disease. All listed here interstitial pneumonias can be diagnosed only by lung biopsy. The prognosis in all of them is much better than in UIP, except of AIP which is often fatal.

Nieswoiste śródmiąższowe zapalenie płuc
Nieswoiste śródmiąższowe zapalenie – NSIP (non-specific interstitial pneumonia) jest jedną z postaci idiopatycznych zapaleń śródmiąższowych, drugą co do częstości występowania po zwykłym śródmiąższowym zapaleniu (UIP), od którego różni się obrazem radiologicznym, histologicznym i co najważniejsze, znacznie lepszym rokowaniem (1). NSIP może nie mieć uchwytnej przyczyny i jest nazywane idiopatycznym lub może występować w przebiegu chorób tkanki łącznej, alergicznego zapalenia pęcherzyków płucnych, reakcji na leki, jako zejście ostrego uszkodzenia płuc, np. ARDS. NSIP jest najczęstszym typem zmian śródmiąższowych w płucach w chorobach tkanki łącznej, jak twardzina układowa, reumatoidalne zapalenie stawów, zespół Sjögrena i zapalenie skórnomięśniowe. Pojawienie się NSIP może wyprzedzać inne objawy choroby tkanki łącznej, co może prowadzić do błędnego rozpoznania zmian płucnych jako idiopatyczne, gdy nie są jeszcze spełnione kryteria potrzebne do rozpoznania choroby układowej (2). NSIP występuje u osób w wieku 40-50 lat i raczej nie ma związku z paleniem tytoniu. Częstość występowania (prevalance) jest oceniana na 3-20/100 000 osób z czego 2/3 stanowią przypadki wtórne do chorób wymienionych wyżej, a 1/3 stanowią przypadki idopatyczne (3).
Objawy, podobnie jak w innych postaciach idiopatycznych zapaleń śródmiąższowych są niespecyficzne. Występuje kaszel, duszność początkowo wysiłkowa, potem spoczynkowa i trzeszczenia nad dolnymi polami płuc. Badania czynnościowe płuc wykazują zaburzenia wentylacji typu restrykcyjnego i obniżenie wskaźnika dyfuzji tlenku węgla (DLCO).
W przeglądowym badaniu radiologicznym klatki piersiowej stwierdza się zmiany rozsiane o charakterze siateczki zlokalizowane głównie w dolnych i obwodowych częściach płuc. W badaniu metodą tomografii komputerowej wysokiej rozdzielczości (TKWR) zmiany są bardziej zróżnicowane niż w innych zapaleniach śródmiąższowych i różnią się od obrazu zmian charakterystycznych dla samoistnego włóknienia płuc (4). W przeciwieństwie do samoistnego włóknienia płuc, gdzie dominuje obraz plastra miodu, w nieswoistym zapaleniu śródmiąższowym występują w różnej proporcji zacienienia typu siateczki, matowej szyby i konsolidacje. Zmiany typu plastra miodu występują rzadko i ich obszary są niewielkie. Wszystkie typy zmian występują zazwyczaj obustronnie, symetrycznie i są najbardziej nasilone w płatach dolnych, rzadko są znacznie większe w jednym płucu niż w drugim.
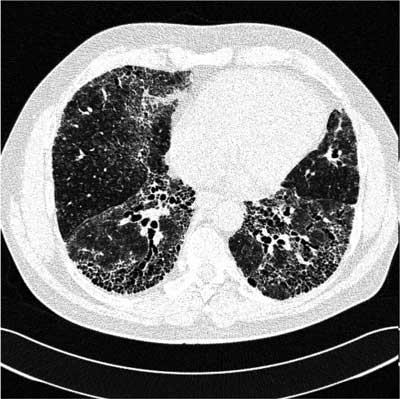
Ryc. 1. Tomografia komputerowa płuc wysokiej rozdzielczości chorej z podejrzeniem nieswoistego zapalenia płuc. Widoczne obszary zacienień typu matowej szyby w obu płucach oraz zacienienia typu plastra miodu położone podopłucnowo, większe po stronie lewej.
Często, pomimo obwodowej dystrybucji zmian, obszary podopłucnowe bywają zaoszczędzone (1, 5). Obserwacja zmienności obrazu TKWR w czasie, średnio 6 lat, wykazała, że stwierdzane na wczesnym etapie rozwoju choroby zacienienia typu matowej szyby i konsolidacje z czasem zmniejszają się, natomiast cechy włóknienia nasilają, co powoduje, że obraz radiologiczny może się z czasem upodabniać do spotykanego w samoistnym włóknieniu płuc (4).
Zmiany w badaniach radiologicznych w przebiegu NSIP nie są na tyle charakterystyczne, aby można było na ich podstawie postawić rozpoznanie. Dla rozpoznania NSIP konieczna jest biopsja płuca. NSIP jest rozpoznawane wtedy, gdy nie występują cechy lepiej scharakteryzowanych histologicznie idiopatycznych zapaleń śródmiąższowych płuc, jak ostre śródmiąższowe zapalenie, organizujące zapalenie puc, limfocytarne śródmiąższowe zapalenie płuc, złuszczające śródmiąższowe zapalenie płuc, zapalenie oskrzelików oddechowych z cechami choroby śródmiąższowej oraz zwykłe śródmiąższowe zapalenie płuc. Na podstawie badań histologicznych wycinków z płuc wyróżnia się dwie postacie niespecyficznego śródmiąższowego zapalenia płuc: komórkową (cellular) i włokniejącą (fibrotic).
Postać komórkowa jest rzadsza niż włókniejąca. Postać komórkowa ma cechy zbliżone do organizującego zapalenia płuc i rokuje lepiej, natomiast postać włókniejąca przypomina samoistne włóknienie płuc i rokuje gorzej (1). Należy jednak zaznaczyć, że w badaniach klinicznych, w których pobierano kilka wycinków płuc z różnych płatów od tego samego chorego, stwierdzano w jednym wycinku cechy NSIP, w innych natomiast UIP. Komponent zmian o typie UIP u chorych z przewagą zmian NSIP powodował, że ich rokowanie było tak samo złe jak u chorych z rozpoznaniem samoistnego włóknienia płuc, czyli UIP (6). U części chorych nie można wykonać biopsji płuca z powodu różnorakich przeciwwskazań. Najczęściej są to ograniczenia rezerw wentylacyjnych i hipoksemia. Mniej inwazyjnym badaniem jest płukanie oskrzelowo-pęcherzykowe (BAL), które może mieć pewne znaczenie w różnicowaniu UIP i NSIP. Ryu i wsp. (7) wykazali na dużym materiale chorych, że w BAL u chorych na NSIP występuje zwiększony w stosunku do normy odsetek limfocytów, natomiast neutrofilia w BAL i obniżony odsetek limfocytów przemawia za UIP. Podwyższony odsetek limfocytów w przypadkach UIP (rozpoznanego mikroskopowo) jest korzystnym wskaźnikiem prognostycznym co do przeżycia (7).
Brak jest wytycznych odnośnie leczenia NIP. W przypadkach kwalifikowanych na podstawie wyniku biopsji płuca jako bogatokomórkowe (cellular) należy podjąć próbę leczenia glikosteroidami tak jak w organizującym się zapaleniu płuc. Przypadki, w których w obrazie mikroskopowym dominują cechy włóknienia, mają gorsze rokowanie. Można podjąć próbę leczenia skojarzonego, takiego jakie jest zalecane w samoistnym włóknieniu płuc, czyli glikosteroidem z azatiopryną lub cyklofosfamidem (8, 9).
Przeciętnie rokowanie w NSIP jest znacznie lepsze niż w UIP, a 10-letnie przeżycie osiągało ponad 70% chorych (1). W wyselekcjonowanych grupach chorych na NSIP z klinicznymi cechami samoistnego włóknienia płuc rokowanie było znacznie gorsze, a 5-letnie przeżycie osiągało tylko 45% chorych (10).
Organizujące zapalenie płuc
Organizujące się zapalenie płuc – OP (organizing pneumonia) jest nieswoistą reakcją naprawczą na różnego pochodzenia uszkodzenie pęcherzyków płucnych (11). Wśród czynników przyczynowych uszkodzenia bierze się pod uwagę zakażenie bakteryjne, wirusowe, pasożytnicze, grzybicze, leki. Organizujące się zapalenie płuc ma w dwu trzecich przypadków etiologię nieznaną, w pozostałych występuje jako zejście infekcyjnego zapalenia płuc, w przebiegu chorób tkanki łącznej, nowotworów płuc lub innych narządów, jako reakcja na leki, po przeszczepieniach narządów (12, 13). OP charakteryzuje się naciekami z komórek jednojądrowych i piankowatych makrofagów w śródmiąższu płuc oraz tworzeniem polipowatej ziarniny w oskrzelikach, przewodach pęcherzykowych i niektórych pęcherzykach płuc. Widoczna w badaniu mikroskopowym ziarnina zawiera fibroblasty i miofibroblasty, nie ma natomiast ziarniniaków, błon szklistych i cech zapalenia naczyń (14). Chociaż dominują zmiany histologiczne w świetle oskrzelików i pęcherzyków, to nacieki zapalne w przestrzeniach międzypęcherzykowych też są widoczne, co powoduje, że jest to choroba zaliczana do zapaleń śródmiąższowych płuc. Zmiany są jednoczasowe. Ze względu na występowanie zmian w oskrzelikach, w przeszłości organizujące się zapalenie płuc znane było pod skrótową nazwą BOOP od ang. bronchiolitis obliterans organizing pneumonia, czyli zwężające zapalenie oskrzelików z organizującym zapaleniem płuc (15). Istnieje jednak odrębna jednostka chorobowa o nazwie zwężające zapalenie oskrzelików – bronchiolitis obliterans (BO), w której nie ma cech organizującego się zapalenia płuc. Aby nie mylić tych dwu jednostek chorobowych, obecnie zrezygnowano z nazwy zwężające zapalenie oskrzelików z organizującym się zapleniem płuc, przyjmując nazwę w piśmiennictwie angielskim COP (cryptogenic organizing pneumonia), a w piśmiennictwie amerykańskim OP (organizing pneumonia), czyli organizujące się zapalenie płuc (OP). Typ utkania mikroskopowego charakterystyczny dla PO może występować w innych chorobach płuc jako zmiana towarzysząca np. w alergicznym zapaleniu pęcherzyków płucnych, sarkoidozie, zespole ostrej niewydolności oddychania – ARDS, obok utkania typowego dla tych chorób (16).
Objawy OP w postaci gorączki, kaszlu i duszności mogą być miernie nasilone lub mogą być ciężkie z cechami niewydolności oddychania (12). Osłuchowo, podobnie jak w bakteryjnym zapaleniu płuc, stwierdza się trzeszczenia, które są słyszalne obustronnie lub tylko ogniskowo, nad określonym obszarem płuc. Przeglądowe zdjęcie radiologiczne klatki piersiowej wykazuje różne obrazy. Najczęściej jest widoczne jedno lub kilka ognisk zacienień podobnych do spotykanych w bakteryjnym zapaleniu płuc, zlokalizowanych zwykle obwodowo, przy opłucnej, które mogą zmieniać swoją lokalizację i kształt.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Travis WD, Hunninghake G, King TE Jr et al.: Idiopathic nonspecific interstitial pneumonia. Report of an American Thoracic Society Project. Am J Respir Crit Care Med 2008; 177: 1338-1347.
2. Kim DS, Nagai S: Idiopathic nonspecific interstitial pneumonia. An unrecognized autoimmune disese? Am J Respir Crit Care Med 2007; 176: 632-633.
3. Flacherty KR, Martinez FJ: Nonspecific interstitial pneumonia. Semin Respir Crit Care Med 2006; 27: 652-658.
4. Akira M, Inoue Y, Arai T et al.: Long-term follow-up high-resolution CT finding in non-specific interstitial pneumonia. Thorax 2011; 66: 61-65.
5. Kligerman SJ, Groshong S, Brown KK et al.: Nonspecific interstitial pneumonia: radiologic, clinical and pathologic considerations. Radio Graphics 2009; 29: 73-87.
6. Flacherty K, Travis W, Colby TV et al.: Histologic variability in usual and nonspecific interstitial pneumonias. Am J Respir Crit Care Med 2001; 164: 1722-1727.
7. Ryu YJ, Chung MP, Han J et al.: Bronchoalveolar lavage in fibrotic idiopathic interstitial pneumonias. Respir Med 2007; 101: 655-660.
8. BTS: Interstitial lung disease guideline. Thorax 2008; 63: v1-v58.
9. Nagai S, Honda T, Tabuena T et al.: Nonspecific interstitial pneumonia: a real clinical entity? Clin Chest Med 2004; 25: 705-715.
10. Nicholson AG, Colby TV, du Bois RM et al.: The prognostic significance of the histologic pattern of interstitial pneumonia in patients presenting with the clinical entity of cryotogenic fibrosing alveolitis. Am J Respir crit Care Med 2000; 162: 2213-2217.
11. King TE Jr: Organizing pneumonia. [In:] Schwarz M, King TE (ed.): Interstitial lung disese. Fifth edition. Shelton, Connecticut, USA. People’s Medical Publishing House, USA 2011; 981-994.
12. Al-Ghanem S, Al-Jahdali H Bamefleh H et al.: Bronchiolitis obliterans organizing pneumonia: pathogenesis, clinical features, imaging an therapy review. Ann Thoracic Med 2008; 3: 67-75.
13. Cordier JF: Cryptogenic organizing pneumonia. Clin Chest Med 2004; 25: 727-738.
14. Kitach: differential diagnosis of bronchiolitis obliterans organizing pneumonia. Chest 1992; 102: 44s-49s.
15. Epler GR: Bronchiolitis obliterans organizing pneumonia. Arch Intern Med 2001; 161: 158-164.
16. Cordier J-F: Cryptogenic organizing pneumonia. Eur Respir J 2006; 28: 422-446.
17. Meleniewska-Maciszewska A: Zarostowe zapalenie oskrzelików z organizującym się zapaleniewm płuc. [W:] Kuś J. (ed.): Choroby śródmiąższowe płuc. Borgis, Warszawa 1997; 69-73.
18. Jara-Palomares L, Gomez-Izquierdo L, Gonzalez-Vergara D et al.: Utility of high-resolution computed tomography and BAL in cryptogenic organizing pneumonia. Respir Med 2010; 104: 1706-1711.
19. Lazor R, Vandevenne A, Pelletier A et al.: Cryptogenic organizing pneumonia: characteristics of relapses in a series of 48 patients. Am J Respir Crit Care Med 2000; 162: 571-577.
20. Liebow A, Carrington C: Diffuse pulmonary lymphoreticular infiltrations associated with dysproteinemia. Med Clin North Am 1973; 57: 809-843.
21. Fishback N, Koss M: Update on lymphoid interstitial pneumonitis. Curr Opinion Pulm Med 1996; 2: 429-433.
22. Cha S-I, Fessler MB, Colo CD et al.: Lymphoid interstitial pneumonia: clinical features, associations and prognosis. Eur Respir J 2006; 28: 364-369.
23. Nicholson AG, Path MRC: Lymphocytic interstitial pneumonia and other lymphoproliferative disorders in the lung. Semin Respi Crit Care Med 2001; 22: 409-421.
24. Swigris JJ, Berry GJ, Raffin TA et al.: Lymphoid interstitial pneumonia. A narrative review. Chest 2002; 122: 2150-2164.
25. Schwarz M: Lymphoplasmocytic infiltrations of the lung. [In:] Schwarz M, King TE Jr (ed.): Interstitial lung disease. BC Decker, Hamilton Ontario 1998; 685-697.
26. Avnon LS, Pikovski O, Sion-Vardy N et al.: Acute interstitial pneumonia – Hamman-Rich syndrome: clinical characteristics and diagnostic and therapeutic considerationa. Anesth Analg 2009; 108: 232-237.
27. Vourlekis JS, Brown KK, Cool CD et al.: Acute interstitial pneumonitis: case series and review of the literature. Medicine 2000; 79: 369-378.
28. Swigris JJ, Bron KK: Acute interstitial pneumonia and acute exacerbation of idiopathic pulmonary fibrosis. Semin Respir Crit Care Med 2006; 27: 659-667.
29. Bonaccorsi A, Cancellieri A, Chilosi M et al.: Acute interstitial pneumonia: report of a series. Eur Respir J 2003; 21: 187-191.
30. American Thoracic Society/European Respiratory Society: international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2002; 165: 277-304.
31. Craig PJ, Wells AU, Doffman S et al.: Desquamaitive interstitial pneumonia, respiratory bronchiolitis and their relationship to smoking. Histopathology 2004; 45: 275-282.
32. Davies G, Wells AU, du Bois RM: Respiratory bronchiolitis associated with interstitial lung disease and desquamative interstitial pneumonia. Clin Chest Med 2004; 25: 717-726.
33. Gąsior G, Barczyk A, Drozdowska B et al.: Przypadek złuszczającego śródmiąższowego zapalenia płuc jako rzadkiej postaci samoistnego śródmiąższowego zapalenia płuc. Pneumonol Alergol pol 2008; 76: 186-191.
34. Knyazhitskiy A, Masson R, Corkey R et al.: Beneficial response to macrolide antibiotic in a patient with desquamative interstitial pneumonia refractory to corticosteroid therapy. Chest 2008; 134: 185-187.

