© Borgis - Postępy Nauk Medycznych 4/2011, s. 317-323
*Małgorzata Bartosiewicz
Zmiany śródmiąższowe w płucach w najczęściej występujących układowych chorobach tkanki łącznej – reumatoidalnym zapaleniu stawów i toczniu rumieniowatym układowym
Interstitial lung disease in the most frequently appearing connective tissue diseases – rheumatoid arthritis and systemic lupus erythematosus
I Klinika Chorób Płuc Instytutu Gruźlicy i Chorób Płuc w Warszawie
Kierownik Kliniki: prof. dr hab. med. Jan Kuś
Streszczenie
Choroby układowe tkanki łącznej to grupa chorób o podłożu autoimmunologicznym, w których przede wszystkim dochodzi do zajęcia układu stawowego. Powikłania płucne są częste i chociaż zwykle występują po pojawieniu się objawów stawowych, mogą być również pierwszą manifestacją choroby układowej. W przebiegu chorób układowych tkanki łącznej może dochodzić do zmian w zakresie wszystkich elementów układu oddechowego – drzewa oskrzelowego, naczyń, miąższu płuc, opłucnej i mięśni oddechowych. Choroba układowa tkanki łącznej leży u podłoża choroby śródmiąższowej płuc u 15% chorych. Częstość występowania choroby śródmiąższowej płuc jest różna w poszczególnych chorobach układowych tkanki łącznej i zależy od kryteriów użytych do rozpoznania choroby oraz zastosowanych metod diagnostycznych. Tomografia komputerowa wysokiej rozdzielczości odgrywa główną rolę w identyfikacji pacjentów z zajęciem układu oddechowego. Czułym narzędziem diagnostycznym służącym do wykrywania choroby śródmiąższowej płuc są badania czynnościowe układu oddechowego. W poniższym artykule dokonano przeglądu rodzaju zmian śródmiąższowych w płucach u chorych na reumatoidalne zapalenie stawów i toczeń rumieniowaty układowy – dwie najczęściej występujące choroby układowe tkanki łącznej.
Summary
Connective tissue diseases are systemic autoimmune disorders that principally affect the joints. Pulmonary complications are common and although they usually occur after the onset of joint symptoms, they can also be initially presenting complaint. The respiratory system may be involved in all its components: airways, vessels, parenchyma, pleura and respiratory muscles. It is estimated that approximately 15% of patients who present with interstitial lung disease have an underlying connective tissue disease. The prevalence of interstitial lung disease is different in each connective tissue disease and also varies according to the criteria used to establish the diagnosis and depends on the specific diagnostic method used to identify it. High – resolution computed tomography plays an important role in identifying patients with respiratory involvement. Pulmonary function tests are a sensitive tool detecting interstitial lung disease. In this article, interstitial lung disease accompanying with two of the most frequently appearing connective tissue diseases rheumatoid arthritis and systemic lupus erythematosus are reviewed.

Choroby układowe tkanki łącznej to niejednorodna grupa chorób o podłożu autoimmunologicznym, w przebiegu których, poza zmianami w układzie kostno-stawowym, dochodzi do zajęcia wielu innych układów i narządów. Powikłania płucne występują często, zwykle pojawiają się po rozpoczęciu wspólnych objawów, ale mogą być również pierwszą manifestacją choroby układowej. W przebiegu chorób układowych tkanki łącznej może dochodzić do zmian w zakresie wszystkich elementów układu oddechowego – drzewa oskrzelowego, miąższu płuc, naczyń, opłucnej, mięśni oddechowych. Częstotliwość, przebieg kliniczny, rokowanie i odpowiedź na leczenie zależą zarówno od typu zmian w układzie oddechowym, jak również od rodzaju choroby podstawowej. Chociaż choroba płuc często przyczynia się do zwiększenia śmiertelności w chorobach tkanki łącznej, to jej przebieg kliniczny może być bardzo zróżnicowany – od procesów gwałtownie postępujących, obarczonych wysoką śmiertelnością, do łagodnych, o wieloletnim przebiegu. Należy pamiętać, że do rozwoju choroby płuc może prowadzić również leczenie immunosupresyjne szeroko stosowane w układowych chorobach tkanki łącznej oraz jego powikłania.
W poniższym artykule przedstawione zostaną rodzaje zmian śródmiąższowych w płucach u chorych na reumatoidalne zapalenie stawów i toczeń rumieniowaty układowy.
Reumatoidalne zapalenie stawów (RZS)
Reumatoidalne zapalenie stawów to najczęstsza układowa choroba tkanki łącznej – dotyczy 1-2% populacji (1, 2), 2-3-krotnie częściej chorują kobiety, szczyt zachorowań przypada na 4-5 dekadę życia (3). U 50% chorych występują objawy pozastawowe, które dotyczą głównie skóry, oczu, serca i płuc. Powikłania płucne w przebiegu RZS są częste i w 10-20% przypadków przyczyniają się bezpośrednio do zgonu chorego (1, 4). Większość zmian w płucach pojawia się w ciągu pierwszych 5 lat trwania choroby, ale u 10-20% chorych zmiany w płucach wyprzedzają rozpoznanie RZS (1). Powikłania płucne częściej występują u mężczyzn, chociaż choroba podstawowa, jak wspomniano powyżej, zdecydowanie częściej dotyczy kobiet. Częstość występowania powikłań płucnych zależy od zastosowanych metod diagnostycznych, kryteriów użytych do postawienia diagnozy oraz charakteru badanej populacji.
Na podstawie objawów klinicznych i klasycznego badania radiologicznego klatki piersiowej zajęcie układu oddechowego można stwierdzić u 20% chorych na RZS, u 30-50%, jest rozpoznawane, jeśli jako metody diagnostycznej użyjemy TKWR płuc (tomografia komputerowa wysokiej rozdzielczości), a w badaniach autopsyjnych zmiany płucne stwierdza się u 70% pacjentów (4).
Zmiany opłucnowe oraz śródmiąższowe zapalenia płuc należą do najczęstszych powikłań płucnych RZS, ale w przebiegu choroby może dochodzić także do rozwoju zmian zapalnych w drzewie oskrzelowym, naczyniach płucnych oraz do powstawania swoistych dla RZS guzków reumatoidalnych.
Śródmiąższowe zapalenie płuc
Śródmiąższowe zapalenie płuc w RZS występuje częściej u mężczyzn, którzy mają jednocześnie inne objawy pozastawowe. Palenie tytoniu (>25 paczkolat), wysokie OB, niski hematokryt, kaszel oraz wieloletni przebieg choroby są istotnymi czynnikami predykcyjnymi rozwoju choroby śródmiąższowej płuc u chorych na RZS (5). Choroba zwykle rozwija się u osób z dodatnim czynnikiem reumatoidalnym (RF). W ścianach pęcherzyków oraz naczyniach płucnych znajdowane są złogi IgM-RF oraz IgG i IgA (6). Objawy kliniczne śródmiąższowego zapalenia płuc są niespecyficzne. Należą do nich suchy kaszel oraz postępująca duszność wysiłkowa, osłuchiwaniem u większości chorych stwierdza się trzeszczenia u podstawy obu płuc, palce pałeczkowate występują u 75% chorych w zaawansowanej postaci choroby (7). Na podstawie badania radiologicznego klatki piersiowej zmiany śródmiąższowe rozpoznaje się jedynie u 5% chorych. Typowo w radiogramach klatki piersiowej widoczne jest zmniejszenie objętości pól płucnych, wysokie ustawienie kopuł przepony oraz obecne są rozsiane zmiany siateczkowate i drobnoguzkowe (ryc. 1). Zdecydowanie lepszym, bardziej czułym narzędziem diagnostycznym jest tomografia komputerowa wysokiej rozdzielczości – pozwala na wczesne wykrycie zmian u 20-63% chorych, u których w klasycznym radiogramie klatki piersiowej zmiany są jeszcze niewidoczne. W obrazie TKWR spotyka się pogrubienie przegród międzyzrazikowych, obraz mlecznej szyby, w zaawansowanych postaciach obraz plastra miodu, rozstrzenie oskrzeli z pociągania oraz rozedmę (3) (ryc. 2). U 3% chorych bez objawów klinicznych choroby śródmiąższowej płuc, w badaniu TKWR płuc stwierdzane są obszary matowej szyby, u chorych z objawami klinicznymi – matowa szyba obecna jest w 26% przypadków, a w 23% obecny jest obraz plastra miodu (8).

Ryc. 1. Zdjęcie radiologiczne klatki piersiowej – RZS (RF+++). Zmniejszona objętość pól płucnych, obraz zmian rozsianych siateczkowatych i linijnych, zwłaszcza w obwodowych partiach płuc, z przewagą po stronie prawej, z tendencją do zlewania się.
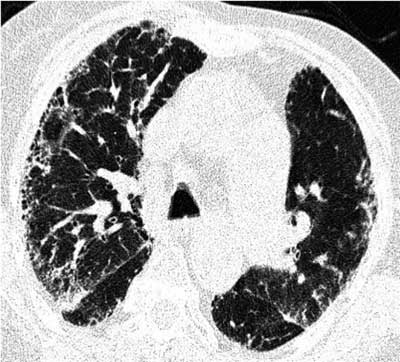
Ryc. 2. TKWR płuc – RZS (RF+++). Obraz zmian rozsianych o charakterze śródmiąższowym wskazujących na włóknienie płuc, o typowej lokalizacji i dystrybucji, z komponentem plastra miodu.
Na podstawie rodzaju zmian w obrazie TKWR płuc można z dużym prawdopodobieństwem przewidzieć typ histologiczny śródmiąższowego zapalenia płuc. W przebiegu RZS najczęściej spotyka się UIP (zwykłe śródmiąższowe zapalenie płuc – usual interstitial pneumonia) (56%), u 33% chorych występuje NSIP (niespecyficzne śródmiąższowe zapalenie płuc – nonspecific interstitial pneumonia) i u ok. 11% chorych stwierdza się cechy organizującego się zapalenia płuc (OP – organising pneumonia) i zmian zapalnych w drogach oddechowych (9). Decydująca dla rozpoznania jest jak zawsze biopsja płuca, ale jeśli obraz radiologiczny jest charakterystyczny, nie trzeba jej wykonywać. Dla UIP typowe są obustronne podopłucnowe zmiany siateczkowate z lub bez obszarów plastra miodu, rozlane obszary matowej szyby dominują w obrazie NSIP (10). Płukanie oskrzelowo-pęcherzykowe (BAL – bronchoalveolar lavage) nie jest rutynowym badaniem diagnostycznym w rozpoznawaniu choroby śródmiąższowej płuc towarzyszącej RZS, jest natomiast niezwykle przydatne do wykluczenia powikłań infekcyjnych i procesów rozrostowych. Nieprawidłowy wynik BAL-u spotyka się u 52% chorych we wczesnym okresie choroby. Wzrost odsetka neutrofilów w BAL-u stwierdza się u chorych z klinicznie jawną chorobą środmiąższową płuc, zaś limfocytozę u 33% chorych z prawidłowym klasycznym radiogramem klatki piersiowej oraz prawidłowymi wynikami badań czynnościowych płuc (11, 12). W badaniach czynnościowych płuc typowo stwierdza się zaburzenia wentylacyjne typu restrykcyjnego ze zmniejszeniem całkowitej pojemności płuc (TLC – total lung capacity), pojemności życiowej (VC – vital capacity) oraz zdolności dyfuzyjnej płuc dla tlenku węgla (DLCO – diffusing lung capacity for carbon monoxide). Cechy restrykcji i obturacji jednocześnie spotyka się u chorych z obrazem organizującego się zapalenia płuc i rozstrzeniami oskrzeli. Obniżenie zdolności dyfuzyjnej płuc < 54% wartości należnej jest istotnym czynnikiem predykcyjnym progresji włóknienia płuc u chorych na RZS (13).
Włóknienie płuc w przebiegu RZS może mieć przebieg łagodny, stabilny lub postępujący i generalnie przebiega wolniej niż samoistne, zdarzają się jednak przypadki o przebiegu gwałtownym z rozwojem zespołu ostrej niewydolności oddechowej (ARDS – acute respiratory distress syndrome). Mediana przeżycia pacjentów chorych na RZS z towarzyszącą chorobą śródmiąższową płuc wynosi 5 lat. Chorzy z obrazem histologicznym odpowiadającym UIP żyją krócej od tych z innym niż UIP obrazem choroby śródmiąższowej płuc (mediana przeżycia 3,2 vs 6,6 lat) i podobnie długo do chorych z idiopatycznym śródmiąższowym zapaleniem płuc (14). Złymi czynnikami prognostycznymi jest obecność palców pałeczkowatych oraz obniżenie zdolności dyfuzyjnej płuc. W tej grupie chorych częściej dochodzi do rozwoju procesów rozrostowych w płucach (6).
Leczenie śródmiąższowego włóknienia płuc w przebiegu RZS jest empiryczne i podobnie jak we włóknieniu samoistnym polega na stosowaniu glikokortykosteroidów (prednizonu 0,5-1 mg/kg m.c. doustnie) w monoterapii lub w połączeniu z innymi lekami immunosupresyjnymi, tj. azatiopryna, cyklosporyna, metotreksat, cyklofosfamid i mykofenolan mofetilu (1, 3, 6, 15). Ostatnio pojawiają się pojedyncze doniesienia o skuteczności infliximabu w leczeniu choroby śródmiąższowej płuc związanej z RZS (16). Pacjenci z obrazem NSIP powinni być leczeni agresywnie, chorzy z obrazem organizującego się zapalenia płuc dobrze reagują na leczenie glikokortykosteroidami, a u chorych z obrazem UIP należy wcześnie rozważyć wskazania do transplantacji płuc (10).
Choroba śródmiąższowa płuc indukowana lekami
Wiele leków stosowanych w terapii RZS może wywołać powikłania płucne. Podczas leczenia metotreksatem u 0,5-12% chorych dochodzi do rozwoju śródmiąższowego zapalenia płuc (1). Powikłanie to ma zwykle ostry początek z kaszlem, dusznością i gorączką. Może prowadzić do rozwoju niewydolności oddechowej i stanowić bezpośrednie zagrożenie życia. W badaniu radiologicznym klatki piersiowej widoczne są nacieki typu wypełnienia pęcherzyków płucnych i zmiany śródmiąższowe. W obrazie TKWR płuc stwierdza się rozległe obszary matowej szyby, zmiany drobnoguzkowe oraz umiarkowaną limfadenopatię. W diagnostyce pomocny jest BAL immunologiczny, w którym typowo stwierdza się limfocytozę, szczególnie ze wzrostem odsetka limfocytów CD4+. Zawsze należy wykluczyć zakażenie jako przyczynę choroby.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Antoniou KM, Margaritopoulos G, Economidou F et al.: Pivotal clinical dilemmas in collagen vascular diseases associated with interstitial lung involvement. Eur Respir J 2009; 33: 882-896.
2. Kim DS: Interstitial lung disease in rheumatoid arthritis: recent advances. Curr Opin Pulm Med 2006; 12: 346-353.
3. Antin-Ozerkis D, Evans J, Rubinonitz A et al.: Pulmonary manifestations of rheumatoid arthritis. Clin Chest Med 2010; 31, 3: 451-478.
4. Triggani M, Granata F, Giannattasino G et al.: Lung involvement in rheumatoid arthritis. Sarcoidosis vasc diffuse lung dis 2003; 20: 171-179.
5. Saag KG, Kolluri S, Koehnke RK et al.: Rheumatoid arthritis lung disease: determinants of radiographic and physiologic abnormalities. Arthritis Rheum 1996; 39: 1711-1719.
6. Guahar UA, Gaffo AL, Alarcon GS: Pulmonary manifestations of rheumatoid arthritis. Semin Respir Crit Care Med 2007; 28: 430-440.
7. Wiatr E: Objawy płucne chorób układowych tkanki łącznej. Pol Arch Med Wew 2004; CXII: 239-242.
8. Cortet B, Flipo RM, Remy-Jardin M et al.: Use of high resolution computer tomography of the lungs in patients with rheumatoid arthritis. Ann Rheum Dis 1995; 54: 815-819.
9. Lee HK, Kim DS, Yoo B et al.: Histopathologic pattern and clinical features of rheumatoid arthritis-associated interstitial lung disease. Chest 2005; 127: 2019-2027.
10. Kim EJ, Collard HR, King TE: Rheumatoid arthritis-associated interstitial lung disease: the relevance of histopathologic and radiographic pattern. Chest 2009; 136: 1397-1404.
11. Garcia JG, Parhami N, Kiliam D et al.: Bronchoalveolar lavage fluid evaluation in rheumatoid arthritis. Am Rev Respir Dis 1986; 133: 450-454.
12. Gilligan DM, O Connor CM, Ward K et al.: Bronchoalveolar lavage in patients with mild and severe rheumatoid lung disease. Thorax 1990; 45: 591-596.
13. Dawson JK, Fewins HE, Desmond J et al.: Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis 2002; 61: 517-521.
14. Kim EJ, Elicker BM, Maldonado F et al.: Usual interstitial pneumonia in rheumatoid arthritis – associated interstitial lung disease. Eur Respir J 2010; 35: 1322-1328.
15. Nannini C, Ryu JH, Matteson EL: Lung disease in rheumatoid arthritis. Curr Opin Rheumatol 2008; 20: 340-346.
16. Dellaripa P, Fry T, Willoughby J et al.: The treatment of interstitial lung disease associated with rheumatoid arthritis with infliximab. Chest 2003; 124: 109s.
17. Swigris JJ, Fischer A, Gillis J et al.: Pulmonary and thrombotic manifestations of systemic lupus erythematosus. Chest 2008; 133: 271-280.
18. Crestani B: The respiratory system in connective tissue disorders. Allergy 2005; 60: 715-734.
19. Quadrelli SA, Alvarez C, Arce SC et al.: Pulmonary involvement of systemic lupus erythematosus: analysis of 90 necropsies. Lupus 2009; 18: 1053-1060.
20. Keane MP, Lynch JP: Pleuropulmonary manifestations of systemic lupus erythematosus. Thorax 2000; 55: 159-166.
21. Osler W: On the visceral manifestations of the erythema group of skin diseases. Am J Med Sci 1904; 127: 103.
22. Goh NS: Connective tissue disease and the lung. Clin Pulm Med 2009; 16: 309-314.
23. Kamen DL, Strange CH: Pulmonary manifestation of systemic lupus erythematosus. Clin Chest Med 2010; 31: 479-488.
24. Memet B, Ginzler EM: Pulmonary manifestations of systemic lupus erythematosus. Semin Respir Crit Care Med 2007; 28: 441-450.
25. Orens JB, Martinez FJ, Lynch JP: Pleuropulmonary manifestations of systemic lupus erythematosus. Rheum Dis Clin North Am 1994; 20:1 59-93.
26. Winder A, Molad Y, Osfeld I et al.: Treatment of systemic lupus erythematosus by prolonged administration of high dose of intravenous immunoglobulin: report of 2 cases. J Rheumatol 1996; 20: 495-431.
27. Eiser AR, Shanies HM: Treatment of lupus interstitial lung disease with intravenous cyclophosphamide. Arthritis Rheum 1994; 37: 428-431.
28. Lim SW, Gillis D, Smith W et al.: Rituximab use in systemic lupus erythematosus pneumonitis and a review of current reports. Intern Med J 2006; 36: 260-262.
29. Boulware DW, Hedgpeth MT: Lupus pneumonitis and anti SSA (Ro) antibodies. J Rheumatol 1989; 16: 479-481.
30. Fenlon HM, Doran M, Sant SM et al.: High-resolution chest CT in systemic lupus erythematosus. AJR Am J Rentgenol 1996; 166: 301-307.
31. Sant SM, Doran M, Fenelon HM et al.: Pleuropulmonary abnormalities in patients with systemic lupus erythematosus: assessment with high resolution computed tomography, chest radiography and pulmonary function tests. Clin Exp Rheumatol 1997; 15: 507-513.
32. Bankier AA, Kiener HP, Wiesmayr MN et al.: Discrete lung involvement in systemic lupus erythematosus: CT assessment. Radiology 1995; 196: 835-840.
33. Cheema GS, Quismorio FP: Interstitial lung disease in systemic lupus erythematosus. Curr Opin Pulm Med 2000; 6: 424-429.
34. Ooi GC, Ngan H, Peh WC et al.: Systemic lupus erythematosus patients with respiratory symptoms: the value of HRCT. Clin Radiol 1997; 52: 775-781.
35. Andonopoulos AP, Constantopoulos SH, Galanopoluou V et al.: Pulmonary function of non smoking patients with systemic lupus erythematosus. Chest 1988; 94: 312-315.
36. Antczak A, Nielepkowicz A: Powikłania płucne tocznia rumieniowatego układowego. Medycyna po Dyplomie. Postępy Pulmonologii 2009; 5: 40-46.
37. Colby TV: Pulmonary pathology in patients with systemic autoimmune diseases. Clin Chest Med 1998; 19: 587-612.
38. Fink SD, Kremer JM: Successful treatment of interstitial lung disease in systemic lupus erythematosus with methotrexate. J Rheumatol 1995; 22: 967-969.
39. Santos-Ocampo AS, Mandell BF, Fessler BJ: Alveolar hemorrhage in systemic lupus erythematosus: presentation and management. Chest 2000; 118: 1083-1090.
40. Barile LA, Jara LJ, Medina-Rodriquez T et al.: Pulmonary hemorrhage in systemic lupus erythematosus. Lupus 1997; 6: 445-448.
41. Dweik RA, ArroligaAC, Cash GM: Alveolar hemorrhage in patients with rheumatic disease. Rheum Dis Clin North Am 1997; 23: 395-410.


