© Borgis - Postępy Nauk Medycznych 10/2011, s. 876-886
*Irina Netsvyetayeva, Ewa Swoboda-Kopeć
Candida parapsilosis – zmienne oblicze
Changing face of Candida parapsilosis
Katedra i Zakład Mikrobiologii Lekarskiej, Warszawski Uniwersytet Medyczny
Kierownik Katedry i Zakładu: prof. dr hab. Grażyna Młynarczyk
Streszczenie
Candida parapsilosis jest ważnym czynnikiem drożdżakowego odcewnikowego zakażenia krwi. Głównym czynnikiem zjadliwości C. parapsilosis jest zdolność kolonizowania sztucznych powierzchni. Zdolność kolonizacji jest uwarunkowana zdolnością wzrostu w postaci biofilmu. Czynnikiem warunkującym rozwój biofilmu jest yeast/hyphal transition – przemiana komórek z formy planktonicznej w formę pseudostrzępkową oraz phenotypic switching – transformacja fenotypowa kolonii w obrębie jednego szczepu.
Cel pracy. Ocena częstości występowania zmienności fenotypowej klinicznych szczepów Candida parapsilosis; charakterystyka morfotypów C. parapsilosis, porównanie ich cech fenotypowych: zdolności asymilacji cukrów oraz zdolności wytwarzania biofilmu.
Materiał i metody. Kliniczne szczepy Candida parapsilosis pochodzące z kolekcji Pracowni Mikologicznej Katedry i Zakładu Mikrobiologii Lekarskiej. Grupę badaną stanowiło 40 szczepów Candida parapsilosis wykazujących zmienność fenotypową kolonii w pierwotnych posiewach. Do grupy porównawczej włączono 20 szczepów klinicznych nie wykazujących zmienności fenotypowej kolonii.
Badanie zdolności asymilacji cukrów przeprowadzono za pomocą testu ID 32C, przy użyciu automatycznego systemu ATB Expression (bioMerieux, Poland), badanie zdolności wzrostu w postaci biofilmu przeprowadzono metodą spektrofotometryczną. Analiza statystyczna wyników została przeprowadzona przy użyciu testów U Manna Whitney’a, korelacji Spearmana oraz korelacji ANOVA testu Kruskla-Wallisa.
Wyniki. Zjawisko zmienności fenotypowej kolonii stwierdzono u około 16% szczepów. Opisano cztery stabilne, podlegające dziedziczeniu morfotypy: gładki, pomarszczony, krateropodobny, koncentryczny. Wśród wyodrębnionych morfotypów stwierdzono statystycznie istotne różnice w zdolności asymilacji D-trehalozy, D-rybozy, kwasu lewulinowego. Większą zdolność tworzenia biofilmu prezentują morfotypy pseudostrzękowe.
Wnioski. Morfotypy Candida parapsilosis chrakteryzyją się odmiennością cech biochemicznych oraz zróżnicowaną zdolnością wytwarzania środowiska biolfilmu.
Summary
Candida parapsilosis is a opportunistic fungal pathogen, which causes the nosocomial infections. Now, it is established well that Candida spp. via contaminated vascular catheters, interacts with host defences as well as passes along the intravascular compartment to invade deep tissues. This is probably due to the ability to grow as a biofilm. C. parapsilosis biofilm formation is closely correlated with a virulence. This biofilm development is particularly associated with the phenotype switching. Materials for the analysis consisted of catalogued Candida parapsilosis strains forming different morphological colony forms, cultured from clinical materials on Sabouraud Agar plates. Clinical samples (blood, vessel catheters, urine, and skin swabs) were collected through routine mycological diagnostic procedures from patients hospitalized in the Infant Jesus Clinical Hospital in 2005 and 2006. Research was performed on 40 clinical strains and control group consisted of 20 strains growing only as the smooth morphological colony form in primary cultures. Biofilm production was assessed using the spectrophotometric method. Statistical analysis was made using the Mann-Whitney U nonparametric test with Sperarman and Kruskal-Wallis ANOVA correlations. The phenotypic switching was observed in 16% of C. parapsilosis strains. Four stable phenotypes were identified: crepe, concentric, smooth and crater. Significant statistical differences were found in the assimilation of D-trehalose, D-ribose, and liwulinic acid. Biofilm forming capabilities were demonstrated in all strains from the control group and all isolates of crepe, crater, and concentric phenotypes. The lack of these capabilities were demonstrated in five isolates of the smooth phenotype from the research group.

Wstęp
Candida parapsilosis jest gatunkiem grzybów drożdżopodobnych po raz pierwszy opisanym w 1928 roku przez Ashford, który wyizolował tego drożdżaka z materiału od pacjentów z biegunką tropikalną w Puerto Rico (1). Nie uważał go jednak za czynnik etiologiczny tego schorzenia – stąd w nazwie gatunkowej użył: „para” (około) i „psilosis” (sprue tropikalna – schorzenie przewodu pokarmowego prowadzące do zaburzeń wchłaniania substancji odżywczych, zwłaszcza witaminy B12 i kwasu foliowego).
Obecnie ten gatunek uznawany jest za ważny czynnik etiologiczny zakażeń szpitalnych, na które są narażeni pacjenci poddani procedurom medycznym, związanym z obecnością cewników naczyniowych oraz wszelkiego rodzaju drenów (2).
Liczba odcewnikowych zakażeń łożyska naczyniowego spowodowanych C. parapsilosis dramatycznie wzrosła w ciągu ostatnich dwudziestu lat. W retrospektywnym badaniu przeglądowym Wingarda (3) obejmującym lata 1952-1992 gatunek ten określono jako rzadki patogen wykrywany u człowieka. Ogólną liczbę zakażeń spowodowanych tym drożdżakiem oszacowano tylko na 6% wśród wszystkich kandydoz. W badaniach przeprowadzonych w USA i Europie pod koniec lat 90. stwierdzono, że C. parapsilosis jest najczęstszą przyczyną odcewnikowych fungemii w niektórych klinikach (4). W wyniku badań retrospektywnych obejmujących pacjentów poddanych leczeniu immunosupresyjnemu hospitalizowanych w Instytucie Transplantologii oraz Klinice Chirurgii Ogólnej i Transplantacyjnej AM w Warszawie, gatunek Candida parapsilosis uznano za najczęstszy (56%) czynnik etiologiczny fungemii odcewnikowych w latach 2005-2007 (5).
Grzybice uogólnione o etiologii C. parapsilosis mają bezpośredni związek z obecnością cewników naczyniowych, którą uznano za wiodący czynnik ryzyka rozwoju tego typu zakażeń (6). Jest to związane przede wszystkim ze zwiększoną zdolnością tego gatunku do produkcji pozakomórkowego śluzu oraz bardziej skutecznymi właściwościami adherencyjnymi do sztucznych powierzchni, niż prezentują to inne gatunki (6, 7, 8). Innymi czynnikami ryzyka są: zabiegi przeszczepienia narządów unaczynionych, żywienie pozajelitowe, wcześniactwo (4, 9, 10), ciągła dializa otrzewnowa (11), zabieg wszczepienia sztucznych zastawek serca (2). Ciekawymi, a zarazem niepokojącymi wydają się wyniki badań Forrest’a GN i wsp. opublikowane w 2008 roku. Retrospektywnej analizie poddano 469 przypadków fungemii w klinice University of Maryland (Baltimore, USA) zanotowane w latach 2002-2006. W epidemiologii Candida species zaobserwowano zmianę odkąd do lecznictwa została wprowadzona kaspofungina (lek przeciwgrzybiczy z grupy echinokandyn). Stwierdzono statystycznie znamienny związek pomiędzy zwiększeniem zużycia kaspofinginy, a zwiększeniem częstotliwości występowania fungemii Candida parapsilosis, zmniejszeniem liczby przypadków Candida tropicalis oraz tendencję do obniżenia udziału Candida glabrata jako czynnika etiologicznego tego typu zakażeń u pacjentów kliniki. Wiąże się to z naturalnie obniżoną wrażliwością gatunku Candida parapsilosis na echinikandyny (12).
Cechy biochemiczne
Fermentuje glukozę, galaktozę, wyjątkowo sacharozę i maltozę. Asymiluje: glukozę, glicerol, 2-keto-D--glukonian, L-arabinozę, D-ksilozę, adonitol,galaktozę, sorbitol, L-metylo –D-glukozyd, N-acetylo-glukozaminę, maltozę, sacharozę, trehalozę i melezytozę, pojedyncze szczepy – także ksylitol; nie rozkłada arbutyny; wytwarza ureazę (8).
Czynniki zjadliwości
Wiedza na temat czynników zjadliwości Candida parapsilosis jest bardzo ograniczona w porównaniu z uważanym za dominujący i o wiele lepiej poznanym gatunkiem Candida albicans. Najistotniejszymi cechami decydującymi o zjadliwości drożdżaków są: zdolność adherencji do tkanek gospodarza oraz sztucznych powierzchni (13), zdolność wzrostu w postaci biofilmu, produkcja enzymów proteolitycznych, yeast/ /hyphal transition (przemiana formy drożdżakowej w formę pseudostrzękową) oraz phenotypic switching (transformacja fenotypowa kolonii w obrębie jednego szczepu) (14), produkcję enzymów: fosfolipzy (np. phospholipase B) oraz proteinazy (np. secreted aspartyl proteases [SAPs]). Przemiana z formy drożdżakowej w formę pseudostrzępkową (yeast/hyphal transition) nie jest cechą charakterystyczną dla każdego gatunku należącego do rodzaju Candida spp. Zjawisko to jest decydującym we wczesnych stadiach zakażenia grzybiczego, gdy kolonizacja drożdżakowa przeistacza się w zakażenie. Formy pseudostrzępkowe posiadają zdolności inwazyjne – możliwość wrastania w przestrzenie międzykomórkowe, pokonywanie bariery ochronnej skóry i śluzówek oraz rozprzestrzenianie się w głąb tkanek (15).
Phenotypic switching – zdolność szybkiej zmienności fenotypowej kolonii w obrębie jednego szczepu wiąże się również z ekspresją innych cech fenotypowych, które mają istotne znaczenie w patogenezie zakażenia grzybiczego. Jest to przejawem przemiany z formy drożdżakowej w formy psuedostrzępkowe, co powoduje zmianę morfologii kolonii oraz jest związane ze zmianami w ekspresji glikoprotein ściany komórkowej, enzymów proteolitycznych, wrażliwością na działanie lizosomalnych enzymów neutrofili oraz substancje przeciwdrobnoustrojowe. Pozwala to na szybką adaptację do zmiennych warunków środowiska, unikanie mechanizmów odpowiedzi immunologicznej gospodarza oraz działania leków przeciwgrzybicznych (16).
Grzyby drożdżopodobne posiadają zdolność wzrostu w postaci biofilmu.
Biofilm (z ang. film – warstwa) – błona biologiczna – zorganizowana populacja drobnoustrojów osadzona w wytworzonej przez nie macierzy, zbudowanej z polimerów występujących na powierzchniach żywych tkanek makroorganizmu lub na powierzchniach sztucznych (17). Jest to warstwowy złożony strukturalnie i funkcjonalnie system mikrokolonii o dużej dynamice, w którym poszczególne elementy spełniają różne funkcje, a komórki pozostają we wzajemnych relacjach i zależnościach, przekazując sobie informacje (18).
W środowisku biofilmu występują komórki grzybów zarówno w formie blastospor, jak i form pseudomicelialnych. Każda mikrokolonia wchodząca w skład biofilmu jest zbudowana z dwóch warstw – podstawowej, zawierającej głównie blastospory i warstwy zewnętrznej, zawierającej strzępki lub pseudostrzępki. Całą konstrukcję scala macierz zewnątrzkomórkowa, w której obserwuje się złożony system kanałów, przez które do komórek doprowadzane są substancje odżywcze oraz odprowadzane produkty przemiany metabolicznej. Drożdżaki wzrastające w postaci biofilmu reprezentują wysoką różnorodność fenotypową i odmienność morfologiczną – znacznie większą, niż osobniki swobodnie rozproszone tzw. komórki planktoniczne (19). Biofilm obserwowany in vitro i in vivo ma strukturę niejednorodną i składa się z kilku warstw komórek o różnej budowie. Pierwsza warstwa, która ma bezpośredni kontakt z kolonizowaną powierzchnią zawiera komórki w formie planktonicznej, druga – komórki w formie pseudostrzępkowej (19). Sugeruje to, że morfologiczna niejednorodność Candida parapsilosis, czyli zdolność wytwarzania form pseudostrzępkowych odgrywa istotną, a nawet decydującą rolę w rozwoju biofilmu (20).
Cel pracy
1. Ocena częstości występowania fenotypowej zmienności kolonii klinicznych szczepów Candida parapsilosis.
2. Charakterystyka morfologii form fenotypowych kolonii Candida parapsilosis powstałych z próbek materiałów klinicznych.
3. Wykazanie różnic fenotypowych: cech biochemicznych oraz zdolności wytwarzania biofilmu morfotypów uzyskanych z szczepów klinicznych Candida parapsilosis.
Materiał i metody
Materiał do badań stanowiły 2032 szczepów grzybów drożdżopodobnych, wśród których zidentyfikowano 254 szczepy Candida parapsilosis. Szczepy były wyizolowane z próbek klinicznych: krew, płyn mózgowo-rdzeniowy, mocz, inne płyny ustrojowe, cewniki naczyniowe, materiały śródoperacyjne, wycinki tkankowe, wydzielina z dolnych dróg oddechowych, dreny różnego rodzaju, kał, wymazy z jamy ustnej, ucha zewnętrznego, gardła, miejsca operowanego, rany, odbytu, cewki moczowej, wymazy ze zmian skórnych. Szczepy Candida parapsilosis wyhodowano z materiałów od pacjentów hospitalizowanych w Szpitalu Klinicznym Dzieciątka Jezus Akademii Medycznej w Warszawie w latach 2005-2006. Grupę porównawczą stanowiło 20 szczepów tego samego gatunku wytwarzające wyłącznie jedną morfologiczną formę kolonii – gładką w pierwotnych hodowlach z materiałów klinicznych.
Badanie materiału klinicznego oraz identyfikacja mikologiczna grzybów drożdżopodobnych i pleśniowych zostały przeprowadzone zgodnie ze standardowymi procedurami laboratoryjnymi według rekomendacji CLSI. Materiał posiewano na agar Sabourauda z antybiotykami: chloramfenikolem i gentamycyną (bioMerieux). Inkubację prowadzono w warunkach tlenowych w temperaturze 30°C przez 10 dni. Identyfikację biochemiczną grzybów drożdżopodobnych wykonano przy użyciu testu API ID 32 C (bioMerieux).
Po zidentyfikowaniu szczepu Candida parapsilosis wytwarzającego różne formy fenotypowe, wykonywano izolacje kolonii o odmiennych fenotypach na podłożach: Sabouraud Agar, płynne podłoże Sabouraud, Sabouraud Agar z chloramfenikolem oraz Sabouraud Agar z gentamycyną i chloramfenikolem. Podłóża o różnym składzie zostały użyte celem ustalenia stabilności oraz powtarzalności wyhodowanych form fenotypowych kolonii. Czas hodowli przedłużono do 10 dni w celu najlepszego wyeksponowania cech kolonii charakterystycznych dla poszczególnych odmian morfologicznych.
Wytwarzanie biofilmu szacowano przy użyciu metody spektrofotometrycznej opisanej przez Jong Hee Shin i wsp. (21). Czyste hodowle form fenotypowych inkubowano 24 godziny w temperaturze 35°C na podłożu Sabouraud Dextrose Agar. Następnie sporządzono zawiesinę w 0,9% NaCl o zmętnieniu 1,0 w skali McFarlanda, co odpowiada 3 x 107 CFU/ml. Do każdej mikroprobówki płytki titracyjnej (MedLab, Polska) dodawano 20 μl zawiesiny drożdżaków oraz 180 μl SDB (Sabouraud dextrose broth) – płynne podłoże Sabouraud (bioMerieux) przygotowane zgodnie z instrukcją producenta oraz suplementowane 60 g glukozy na 1 litr. Stężenie glukozy w otrzymanym podłożu – 80 g/l. Próbę dla każdego izolatu wykonywano w dwóch równoległych próbkach. Próbki kontrolne zawierały płynne podłoże SDB bez dodawania zawiesiny drożdżaków. Mikropłytki inkubowano 24 godziny w temperaturze 35°C. Po inkubacji studzienki mikropłytek trzykrotnie wypłukano destylowaną wodą przy użyciu pipety wielokanałowej. Odczyt spektrofotometryczny dokonano w czytniku mikropłytek PR3100 (BIORAD) przy długości fali 405 nm, po dodaniu do każdej mikroprobówki 200 μl wody destylowanej. Za parametry graniczne dla oceny wytworzonego biofilmu uznano wartość %Tbloc, procent ilości światła, absorbowanego przy przechodzeniu przez każdą próbkę badaną w porównaniu z absorbancją próbek kontrolnych (%Tblank) zawierających tylko destylowaną wodę.
%Tbloc = %Tblank – %T. Zdolność tworzenia biofilmu określono według skali:
Ujemna – %Tbloc < 5, minimalna (1+) – %Tbloc = 5 – 20, słabo dodatnia (2+) – %Tbloc = 21 – 35, dodatnia (3+) – %Tbloc = 36 – 50, maksymalna (4+) – %Tbloc > 51.
Analiza statystyczna wyników została dokonana przy użyciu testów nieparametrycznych U Manna Whitney’a, korelacji Spearmana oraz korelacji ANOVA testu Kruskala – Wallisa.
Wyniki
Wśród 2032 hodowli grzybów drożdżopodobnych uzyskanych z materiałów klinicznych, 254 szczepy zidentyfikowano jako Candida parapsilosis z prawdopodobieństwem powyżej 90% i oceną identyfikacji jako „bardzo dobra” lub „doskonała”. Gatunek Candida parapsilosis stanowił 12,5% wszystkich szczepów grzybów drożdżopodobnych. W 214 (84,3%) przypadkach hodowla pierwotna zawierała kolonie o jednolitej budowie, hodowle pierwotne 40 (15,7%) szczepów prezentowało kolonie o zróżnicowanej strukturze. Szczepy wzrastające w postaci kolonii o odmiennej budowie stanowiły około 16% w ogólnej liczbie szczepów należących do gatunku Candida parapsilosis. Wzrost fenotypowo zróżnicowanych kolonii uzyskano w hodowlach posiewów: 4 cewników naczyniowych, 13 posiewów krwi, 15 posiewów moczu, 6 wymazów ze zmian skórnych, 2 wymazów z ucha zewnętrznego.
Na rycinie 1 przedstawione są morfologicznie odmienne formy kolonii Candida parapsilosis.
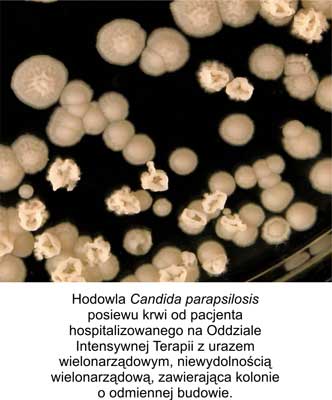
Ryc. 1. Hodowla na SDA Candida parapsilosis prezentująca kolonie o różnorodnej budowie.
Przy analizie i opracowaniu morfologii kolonii wytwarzanych przez szczepy kliniczne opisano i wyizolowano w postaci czystych hodowli cztery stabilne, podlegające dziedziczeniu morfotypy gatunku Candida parapsilosis: gładki, pomarszczony, krateropodobny, koncentryczny.
Do mofrotypu gładkiego zaliczono okrągłe, gładkie, lśniące, regularne kolonie, wyglądające w obrazie mikroskopowym jako okrągłe lub owalne blastospory pączkujące, nie wytwarzające pseudostrzępków, charakteryzujące się równomierną zawieszalnością w soli fizjologicznej. Rycina 2 przedstawia hodowle na Sabouraud Agar z gentamycyną oraz obraz mikroskopowy morfotypu gładkiego.

Ryc. 2. Morfotyp gładki.
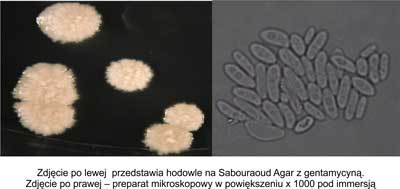
Do morfotypu pomarszczonego zaliczono kolonie nieregularne, z falistym brzegiem wznoszące się nad podłożem, mocno pomarszczone, z mierną zawieszalnością w soli fizjologicznej. W preparacie mikroskopowym – liczne pseudostrzępki. Rycina 3 przedstawia hodowle na Sabouraud Agar z gentamycyną oraz obraz mikroskopowy morfotypu pomarszczonego.

Ryc. 3. Morfotyp pomarszczony.
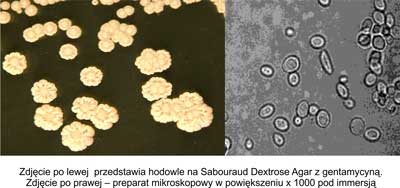
Do morfotypu koncentrycznego zaliczono kolonie okrągłe regularne w koncentryczne wzory. W preparacie mikroskopowym widoczne są wydłużone komórki zlepione w grudki różnej wielkości. Z tej formy niemożliwe jest uzyskanie jednorodnej zawiesiny w soli fizjologicznej. Rycina 4 przedstawia hodowle na Sabouraud Agar z gentamycyną oraz obraz mikroskopowy morfotypu koncentrycznego.
Ryc. 4. Morfotyp koncentryczny.
Kolonie zaliczane do fenotypu krateropodobnego wyglądem przypominają stokrotki, mają gładką lśniącą część środkową oraz mocno pofałdowaną obwódkę. Mikroskopowo jest to forma pośrednia pomiędzy fenotypem gładkim a koncentrycznym – pojedyncze pączkujące komórki oraz konglomeraty wydłużonych blastospor. Rycina 5 przedstawia hodowle na Sabouraud Agar z gentamycyną oraz obraz mikroskopowy morfotypu krateropodobnego.
Ryc. 5. Morfotyp krateropodobny.
Z 40 szczepów klinicznych Candida parapsilosis wykazujących różnorodność morfologii kolonii w hodowlach pierwotnych uzyskano 104 izolaty należące do czterech wyżej opisanych morfotypów: 33 izolaty o morfotypie gładkim, 39 izolatów o morfotypie pomarszczonym, 16 izolatów o morfotypie krateropodobnym i 16 izolatów o morfotypie koncentrycznym.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Ashford BK: Certain conditions of the gastrointestinal tract in Puerto Rico and their relation to tropical sprue. Am J Trop Med Hyg 1928; 8: 507-538.
2. Diekema DJ, Messer SA, Hollis RJ et al.: An outbreak of Candida parapsilosis prosthetic valve endocarditis. Diagn Microbiol Infect Dis 1997; 29: 147-153.
3. Wingard JR: Importance of Candida species other than C.albicans as pathogens in oncology patients. Clin Ifect Dis 1995; 20: 115-125.
4. Pic Alauas L, Donegan N: Risk factors for canidemia caused by non-albicans Candida spp. Abstract No 321, Abstracts of the IDSA 36yh Annual Meeting. Clin Infect Dis 1998; 27: 981.
5. Swoboda-Kopec E, Netsvyetayeva I, Sikora M et al.: The etiological factors of fungemia and the susceptibiliti of fungal strains isolated from patients hospitalized in The Infant Jesus Clinical Hospital In Warsaw. Abstract Book 43rd Kongres of the Society for Surgical Research British Journal of Surgery 2008; 95: 97.
6. Krcmery V, Barnes AJ: Non-albicans spp. causing fungemia: pathogenicity and antifungal resistance. J Hosp Inf 2002; 50: 243-260.
7. Viscosi C, Girmenia C, Marinus A et al.: Invasive Fungal Infection Group of the European Organization for Research and Treatment of Cancer. Candidemia in cancer patients: A prospective, multucenter surveillance study by the Invasive Fungal Infection Group (IFIG) of the European Organization for Research and Treatment of Cancer (EORTC). Clin Infect Dis 1999; 28: 1071-1079.
8. Zarys mikologii lekarskiej. Pod red. prof. Berana E, Volumed, Wrocław, 1998. 274,299,375,381,382,411,413,414,465.
9. Girmenia C, Martino P, De Bernardis F et al.: Rising incidence of Candida parapsilosis fungemia in patients with hematologic malignancies: clinical aspects, predisposing factors and differential pathogenicity of the causative strains. Clin Infect Dis 1996; 23: 506-514.
10. Levy I, Rubin LG, Vasishtha s, Tucci VS: Emergence of Candida parapsilosis as the predominant species causing candidemia in children. Clin Infect Dis 1998; 26: 1086-1988.
11. Wong PN, Mak SK, Tong GM, Wong AK: A retrospecyive study of seven cases of Candida parapsilosis peritonitis inCAPD patients: the therapeutic implications. Perit Dial Int 2000; 20: 76-79.
12. Forrest GN, Weekes E, Johnsos JK: Increasing incidence of Candida parapsilosis candidemia with caspofungin usage. J Infect 2008; 56: 126-129.
13. Kuhn DM, Mukherjee PK, Clark TA et al.: Candida parapsilosis characteriztion in an outbreak setting. Emerg Infect Dis 2004; 10: 1074-1081.
14. Murray PR, Rosental KS, Pfaller MA: Medical Microbiology, 6th Edition 2009 by Mosby, Inc., an affiliate of Elselvier Inc.: 686.
15. Dzierżanowska D: Zakażenia grzybicze – wybrane zagadnienia. Wydawnictwo α-medica press 2006; 42-44.
16. Odds EC: Switch of fenotype as an escape mechanism of the intruder. Mycoses 1997; 4: 9-12.
17. Kayser FH, Bienz KA, Eckert J, Zinkernagel RM: Mikrobiologia lekarska, PZWL 2007; s. 151.
18. O’Toole GA, Kaplan H, Kolter R: Biofilm formation as microbal development. Annu Rev Microbiol 2000; 54: 49-79.
19. Dworecka-Kaszak B: Czy grzyby plotkują? Signaling i quorum sensing – zjawiska warunkujące komunikacje drobnoustrojów. Mikologia lekarska 2008; 15: 164-171.
20. Blankenship JR, Mitchell AP: How to build a biofilm: a fungal perspective. Curr Opin Microbiol 2006; 9: 588-594
21. Shin JH, Kee SJ, Shin MG et al.: Biofilm production by isolates of Candida species from nonneutropenic patients: comparsion of bloodstream isolates with isolates from other sources. J Clin Microbiol 2002; 40: 1244-1248.
22. Slutsky B, Buffo J and Soll DR: High-frequency switching of colony morphology in Candida albicans. Science 1985; 230: 666-669.
23. Netsvyetayeva I, Swoboda-Kopeć E, Dąbkowska M et al.: Różnorodność fenotypowa klinicznych szczepów Candida parapsilosis. Mikologia Lekarska 2008; 15: 131-134.
24. Laffey SF and Butler G: Phenotype switching affects biofilm formation by Candida parapsilosis. Microbiology 2005; 151: 1073-1081.
25. Ichikawa T, Sugita T, Yokoyama K et al.: Phenotypic switching and β-N-acetylhexosaminidase activity of the pathogenic yeast Trichosporon asahii. Microbiol Immun 2004; 48: 237-242.
26. Geiger J, Wessels D, Lockhart SR, and Soll DR: Release of a potent polymorphonuclear leukocyte chemoattractant is regulated by white-opaque switching in Candida albicans. Infect Immun 2004; 72: 667-677.
27. Soll DR, Lockhart SR and Zhao R: Relationship between switching and mating in Candida albicans. Eukaryot Cell 2003; 2: 390-397.
28. Lan CY, Newport LA, Murillo T et al.: Metabolic specialization associated with phenotypic switching in Candida albicans. PNAS 2002; 99: 14907-14912
29. Andaluz E, Calderone R, Reyes G, Larriba G: Phenotypic analysis and virulence of Candida albicans LIG4 mutants. Infect immun 2001; 69: 137-147.
30. Vargas K, Messer SA, Pfaller M et al.: Elevated phenotypic switching and drug resistance of Candida albicans from Human Immunodeficiency Virus-positive individuals prior to first thrush episode. J Clin Microbiol 2000; 38: 3595-3607.
31. Brockert PJ, Lachke A, Srikantha T et al.: Phenotypic swithing and mating type swithing of Candida glabrata at sites of colonization. Infect Immun 2003; 71: 7109-7118.
32. Yoon SA, Vazques PE, Steffan PE et al.: High-frequency, in vitro reversible switching of Candida lusitaniae clinical isolates from amophotericin B susceptibility to resistance. Antimicrob Agents Chemoter 1999; 43: 836-845.
33. Jain N, Li L, McFadden DC et al.: Phenotypic switching in a Cryptococcus neoformans variety gatti strain is ass ociated with changes in virulence and promotes dissemination to central nervous system. Infect Immun 2006; 74: 896-903.
34. Guerrero A, Jain N, Goldman DL, Fries BC: Phenotypic switching in Cryptococcus neoformans. Microbiology 2006; 152: 3-9.
35. Fries BC, Cook E, Wang X, Casdevall A: Efffects of antifungal interventions on the outcome of experimental infections with phenotypic switch variants of Cryptococcus neoformans. Antimicrob Agents Chemother 2005; 49: 350-357.
36. Fries BC, Taborda CP, Serfass E, Casadevall A: Phenotypic switching of Cryptococcus neoformans occurs in vivo and influences the outcome of infection. J Clin Invest 2001; 108: 1639-1648
37. Karashima R, Yamakami Y, Yamagata E et al.: Increased release of glucuronoxylomannan antigen and induced phenotypic changes in Trichosporon asahii by repeated passage in mice. J Med Microbiol 2002; 51: 423-432.
38. Soll DR, Galask R, Isley S et al.: Switching of Candida albicans during successive episodes of recurrent vaginitis. J Clin Microbiol 1989; 27: 681-690.
39. Hellstein J, Vawter-Hugart H, Fotos P et al.: Genetic similarity and phenotypic diversity of commensal and pathogenic strains of Candida albicans isolated from oral cavity. J Clin Microbiol 1993; 31: 3190-3199.
40. Jones S, white G and Hunter PR: Increased phenotypic switching in strains of Candida albicans associated with invasive infections. J Clin Microbiol 1994; 32: 2869-2870.
41. Lott TJ, Kuykendall RJ, Welbel SF et al.: Genomic heterogeneity in the yeast Candida parapsilosis. Curr Genet 1993; 23: 463-467.
42. Enger L, Joly S, Pujol C et al.: Cloning and characterization of a complex DNA fingerprinting probe for Candida parapsilosis. J Clin Microbiol 2001; 39, 658-669.
43. Murphy J: Mechanisms of natural resistance to human pathogenic fungi. Annu Rev Microbiol 1991; 45: 509-538
44. Kobayasi D, Kondo K, Uehara N et al.: Endogenous Reactive Oxygen Species Is an Important Mediator of Miconazole Antifungal Effect. Antimicrob Agents Chemother 2002; 46: 1313-1316.
45. Lupetti A, Paulusma-Annema A, Senesi S et al.: Internal thiols and reactive oxygen species in candidacidal activity exerted by an N-terminal peptide of human lactoferrin. Antimicrob Agents Chemother 2002; 46: 1634-1639
46. Brakebusch M, Wintergerst U, Petropoulou T et al.: Bromelain is an accelerator of phagocytosis, respiratory burst and killing of Candida albicans by human granulocytes and monocytes. Eur J Med Res 2001; 6: 193-200.
47. Estruch F: Stress-controlled transcription factors, stress-induced genes and stress tolerance in budding yeast. FEMS Microbiol Rev 2000; 24: 469-486.
48. Arguelles JC: Novel bifunctional trehalose synthase. Arch Microbiol 2000; 174: 217-224.
49. Martinez-Esparza M, Aguinaga A, Gonzales-Parraga P et al.: Role of trehaloze in resistance to macrophage killing: study with a tps1/tps1 trehalose-deficient mutant of Candida albicans. Clin Microbiol Infect 2007; 13: 384-394.





