© Borgis - Postępy Fitoterapii 4/2010, s. 211-214
*Edyta Kwiatkowska
Kwas elagowy – zawartość w żywności i rola prozdrowotna
Ellagic acid – content in food and role in nutrition
Instytut Turystyki i Rekreacji Akademia Wychowania Fizycznego im. Józefa Piłsudskiego w Warszawie
Dyrektor Instytutu: dr hab. Ludwik Mazurkiewicz, prof. AWF
Summary
Ellagic acid is a phenolic acid compound found in many plants, present in fruits and nuts, including blueberries, blackberries, raspberries, strawberries and walnuts. This compound has potential antimutagenic, antiviral and antioxidative properties. Ellagic acid has a variety of biological activities including anti-oxidant, anti-inflammatory and anti-cancer properties. Previous studies indicated that ellagic acid had a scavenging action against both oxygen and hydroxyl radicals, and inhibited lipid peroxidation. Ellagic acid is a bioactive compound of potential protective effects against certain cancer types.

Wstęp
Kwas elagowy należy do kwasów fenolowych. Występuje on w postaci wolnej, ale częściej związanej estrowo z glukozą, tworząc garbniki hydrolizujące (tzw. elagotaniny). W tkankach roślinnych zidentyfikowano połączenia fenolokwasów z innymi wtórnymi metabolitami roślin, jak flawonoidami i sterolami (1). Kwas elagowy jest uwalniany podczas hydrolizy elagotanin, które są garbnikami pirogalolowymi. Elagotaniny są estrami poliolu i kwasu heksahydroksydifenowego, który w roztworze wodnym spontanicznie ulega laktonizacji do kwasu elagowego, co przedstawiono na rycinie 1.
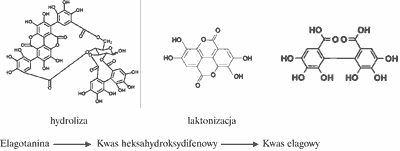
Ryc. 1. Schemat hydrolizy elagotanin (4, 5, 6).
Heksahydroksydifenyl tworzony jest z dwóch grup kwasu galowego połączonych cząsteczką kwasu garbnikowego. Podczas hydrolizy elagotanin uwalniana jest glukoza i kwas elagowy razem z kwasem galusowym. Kwas elagowy powstaje w momencie rozerwania wiązań pomiędzy grupami heksahydroksydifenylu, a cząsteczką kwasu garbnikowego i następujących po tym przegrupowań cząsteczek. Garbniki pirogalolowe łatwo ulegają hydrolizie z ciepłą wodą, enzymami, słabymi kwasami lub zasadami. Kwas elagowy dzięki swojej budowie chemicznej wykazuje właściwości antyoksydacyjne. Przeprowadzone badania przy użyciu ekstraktów z mango ujawniły wzrost aktywności antyoksydacyjnej wraz ze wzrostem stopnia hydrolizy (2). Efekt ochronny, związany z działaniem antyoksydacyjnym kwasu elagowego, był często porównywalny, a nawet wyższy niż działanie witaminy E (3).
Występowanie, źródła w diecie i biodostępność
Bogatym źródłem kwasu elagowego są owoce jagodowe, głównie truskawki, maliny, żurawina, winogrona, a także orzechy włoskie (2).
Elagotaniny są hydrolizowane w jelicie cienkim do kwasu elagowego. Badania na modelach zwierzęcych wykazały, że kwas elagowy jest metabolizowany przez mikroflorę jelitową w jelicie cienkim. Kwas elagowy i jego metabolity po zaabsorbowaniu lokalizowane są w tkankach płuc i w mniejszych ilościach w tkankach wątroby (7).
Wyniki badań przeprowadzonych na ochotnikach, którym podawano sok z owoców granatu w ilości 180 ml, zawierający 25 mg kwasu elagowego i 318 mg podlegających hydrolizie elagotanin wskazały, że kwas elagowy był wykrywalny w najwyższym stężeniu (31,9 ng/ml) godzinę po podaniu i był szybko eliminowany po 4 godzinach (8).
Metabolity kwasu elagowego są wydalane z organizmu z moczem i kałem (9).
Odnotowano różne zawartości kwasu elagowego w różnych owocach, między innymi w truskawkach (630 μg/g), malinach (1500 μg/g), jeżynach (1500 μg/g), orzechach włoskich (590 μg/g), orzeszniku jadalnym (330 μg/g), żurawinie (120 μg/g). Zauważono, że różne części owoców mogą zawierać odmienne ilości kwasu elagowego. Dla przykładu, pestki malin zawierają około 87,5% kwasu elagowego, a pulpa około 12,2%. Najwyższy poziom kwasu elagowego znajduje się w owocach liofilizowanych (10). Badania wskazują, że wraz ze stopniem dojrzałości owoców zawartość kwasu maleje (11).
Dużą zawartość kwasu elagowego mają owoce winogron odmiany Muscadine. Odnotowano, że odmiany białe zawierały od 879-1620 mg/kg kwasu elagowego, a odmiany ciemne 592-1900 mg/kg w skórce owoców. Znacznie mniejsze ilości odnotowano w miąższu. Zawartość kwasu elagowego w soku tych winogron była znacznie wyższa w odmianach białych niż ciemnych. W odmianach jasnych zawartość tego kwasu wynosiła 105-162 mg/kg, a w ciemnych 187-322 mg/kg (12). Powyższe dane dowodzą, że kwas elagowy koncentruje się głównie w pestkach i skórce owoców.
Procesy technologiczne stosowane w procesie produkcji przetworów owocowych znacznie wpływają na ubytki w zawartości kwasu elagowego w produktach końcowych. Dla przykładu, przechowywanie malin i truskawek w temperaturze chłodniczej -20°C powodowało spadek ilości kwasu elagowego o 30-40% (13).
Właściwości prozdrowotne
Badania wskazują, że kwas elagowy ma silne właściwości antyoksydacyjne, przeciwnowotworowe, antymutagenne i wykazuje aktywność przeciwzapalną (14). Na podstawie wielu badań stwierdzono, że kwas elagowy wykazuje właściwości przeciwnowotworowe. Wynikają one z następujących uwarunkowań (15-19):
– likwidują wolne rodniki i mogą inaktywować kancerogeny,
– hamują prokancerogenne drogi przekazywania sygnału,
– działają antymutagennie,
– zmniejszają częstotliwość pojawiania się mutacji,
– wpływają ochronnie na DNA i ekspresję genów,
– blokują enzymy prokancerogenne,
– działają na wszystkich etapach rozwoju nowotworu,
– wiążą prokancerogenne metale,
– redukują peroksydację lipidów.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Breinholt V. Desirable versus harmful levels of intake of flavonoids and phenolic acids. Natural antioxidants and anticarcinogenes in nutrition, health and disease. Roy Soc Chem 1999; 93-9. 2. Soong YY, Barlow PJ. Quantification of gallic acid and ellagic acid from longan seed and mango kernel and their effects on antioxidant activity. Food Chem 2006; 97:524-30. 3. Hassoun EA, Vodhanel J, Holden B i wsp. The effects of ellagic acid and vitamin E succinate on antioxidant enzymes activities and glutathione levels in different brain regions of rats after subchronic exposure to TCDD. J Toxicol Environ Health 2006; 69(5):381-93. 4. Quideau S, Feldman KS. Ellagotannin chemistry: The first synthesis of dehydrohexahydroxydiphenoate (DHHDP) esters from oxidative coupling of unetherified methyl gallate. J Org Chem 1997; 62:8809-13. 5. Scalbert A, Williamson G. Dietary intake and bioavailability of polyphenols. J Nutr 2000; 130:2073S-85S. 6. Lee JH, Johnson JV, Talcott ST. Identification of ellagic acid conjugates and other polyphenolics in muscadine grapes by HPLC-ESI-MS. J Agric Food Chem 2005; 53:6003-10. 7. Boukharta M, Jalbert G, Castonguay A. Biodistribution of ellagic acid and dose-related inhibition of lung tumorigenesis in A/J mice. Nutr Cancer 1992; 18:181-9. 8. Seeram NP, Lee R, Heber D. Bioavailability of ellagic acid in human plasma after consumption of ellagotannins from pomegranate (Punica granatum L.) juice. Clin Chim Acta 2004; 348:63-8. 9. Doyle B, Griffiths LA. The metabolism of ellagic acid in the rat. Xenobiotica 1980; 10:247-56. 10. Aaby K, Skrede G, Wrolstad RE. Phenolic composition and antioxidant activities in flesh and achenes of strawberries (Fragaria ananassa). J Agric Food Chem 2005; 53(10):4032-40. 11. Williner MR, Pirovani ME, Güemes DR. Ellagic acid content in strawberry of different cultivars and ripening stages. J Sci Food Agric 2003; 83:842-5. 12. Lee J. Hydrolytic and antioxidant properties of ellagic acid and its precursors present in muscadine grape. Doctor’s dissertation, University of Floryda 2004;19. 13. Häkkinen SH, Kärenlampi SO, Mykkänen HM i wsp. Ellagic acid content in berries: Influence of domestic processing and storage. Eur Food Res Technol 2000, 212(1):75-80. 14. Vattem D, Shetty K. Biological function of ellagic acid: a review. J Food Biochem 2005; 29:234-66. 15. Lamer-Zarawska E, Oszmiański J. Rola niektórych substancji roślinnych w profilaktyce przeciwnowotworowej. Wiad Ziel 1998; (5):1-4. 16. Talcott ST, Lee JH. Ellagic acid and flavonoid antioxidant content of muscadine wine and juice. J Agric Food Chem 2002; 50:3186-92. 17. Pastrana-Bonilla E, Akoh CC, Sellappan S i wsp. Phenolic content and antioxidant capacity of muscadine grapes. J Agric Food Chem 2003; 51:5497-503. 18. Mertens-Talcott SU, Talcott ST, Percival SS. Low concentrations of quercetin and ellagic acid synergistically influence proliferation, cytotoxicity and apoptosis in MOLT-4 human leukemia cells. J Nutr 2003; 133:2669-74. 19. Mertens-Talcott SU, Percival SS. Ellagic acid and quercetin interact synergistically with resveratrol in the induction of apoptosis and cause transient cell cycle arrest in human leukemia cells. Canc Lett 2005; 218:141-51. 20. Falsaperla M, Morgia G, Tartorone A i wsp. Support ellagic acid therapy in patients with hormone refractory prostate cancer on standard chemotherapy using vinorelbine and estramustine phosphate. Eur Urol 2005; 47:449-55. 21. Festa F, Aglitti T, Duranti G i wsp. Strong antioxidant activity of ellagic acid in mammalian cells in vitro revealed by the comet assay. Anticancer Res 2001; 21:3903-8. 22. Barch DH, Rundhaugen LM. Ellagic acid induces NAD(P)H: quinine reductase through activation of the antioxidant responsive element of the rat NAD(P)H: quinine reductase gene. Carcinog 1994; 15:2065-8. 23. Ahn D, Putt D, Kresty L i wsp. The effects of dietary ellagic acid on rat hepatic and esophageal mucosal cytochromes P450 and phase II enzymes. Carcinog 1996; 17(4):821-8. 24. Bell C, Hawthorne S. Ellagic acid, pomegranate and prostate cancer – a mini review. J Pharm Pharmacol 2008; 60(2):139-44. 25. Losso JN, Bransode RR, Trappey A i wsp. In vitro anti-proliferative activities of ellagic acid. J Nutr Biochem 2004; 15(11):672-8. 26. Narayanan BA, Re GG. IGF – II down regulation associated cell cycle arrest in colon cancer cells exposed to phenolic antioxidant ellagic acid. Anticancer Res 2001; 21:359-64. 27. Narayanan BA, Narayanan NK, Stoner GD i wsp. Interactive gene expression pattern in prostate cancer cells exposed to phenolic antioxidants. Life Sci 2002; 70:1821-39. 28. Edderkaoui M, Odinokova I, Ohno I i wsp. Ellagic acid induces apoptosis through inhibition of nuclear factor KB in pancreatic cancer cells. World J Gastroenterol 2008; 14(23):3672-80. 29. Osawa T, Ide A, De Su J i wsp. Inhibition of in vitro lipid peroxidation by ellagic acid. J Agric Food Chem 1987; 35(5):808-12. 30. Papoutsi Z, Kassi E, Chinou I i wsp. Walnut extract (Juglans regia L.) and its component ellagic acid exhibit anti-inflammatory activity in human aorta endothelial cells and osteoblastic activity in the cell line KS483. Brit J Nutr 2008; 99:715-22. 31. Ya-Mei Y, Weng-Cheng C, Chieh-His W i wsp. Reduction of oxidative stress and apoptosis in hyperlipidemic rabbits by ellagic acid. J Nutr Biochem 2005; 16(11): 675-81. 32. Basu A, Wilkinson M, Penugonda K i wsp. Freeze-dried strawberry powder improves lipid profile and lipid peroxidation in women with metabolic syndrome: baseline and post intervention effects. Nutr J 2009; 8:43.

