Ewa Orlewska
Ocena ekonomiczna lamiwudyny i infa w leczeniu przewlekłego zapalenia wątroby typu B w Polsce
The cost-effectiveness analysis of lamivudine and INFa
in the treatment of chronic hepatitis B in Poland
Centrum Farmakoekonomiki, Warszawa
Streszczenie
Celem pracy jest ocena kosztów i efektów leczenia przewlekłego wzw B w Polsce. W proponowanym modelu porównano następujące scenariusze:
A:wszyscy chorzy kwalifikujący się do leczenia lamiwudyną otrzymują ten lek, pozostali natomiast otrzymują INFa lub „nieleczenie”,
B:wszyscy chorzy kwalifikujący się do leczenia INFa otrzymują ten lek, pozostali natomiast lamiwudynę lub „nieleczenie”,
C: chorzy kwalifikujący się do leczenia lamiwudyną, którzy także kwalifikują się do leczenia INFa, otrzymują albo lamiwudynę, albo INFa, albo „nieleczenie”, chorzy kwalifikujący się do leczenia lamiwudyną, u których INFa jest przeciwwskazany, otrzymują albo lamiwudynę, albo „nieleczenie”, natomiast chorzy nie kwalifikujący się do leczenia lamiwudyną otrzymują albo INFa, albo „nieleczenie”,
D: na rynku dostępny jest tylko INFa i otrzymują go tylko chorzy kwalifikujący się do leczenia INFa, pozostali otrzymują „nieleczenie”,
E: na rynku nie ma ani INFa, ani lamiwudyny i stosuje się tylko „nieleczenie”. Względem tego scenariusza obliczono inkrementalny koszt i inkrementalny wynik leczenia lamiwudyną lub INFa.
Prawdopodobieństwa zdarzeń w proponowanym modelu pochodzą z danych literaturowych, koszty natomiast oszacowano z perspektywy płatnika za usługi zdrowotne (pacjent oraz budżet kasy chorych), w oparciu o dostępne dane polskie. Horyzont czasowy badania wynosi 1 rok. Jednostką efektywności w modelu jest: odsetek leczonych chorych, serokonwersja HBeAg, progresja do marskości wątroby. W każdym scenariuszu obliczono średni koszt/1 pacjenta, średni koszt uzyskania serokonwersji HBeAg, średni koszt uniknięcia progresji do marskości wątroby oraz inkrementalny współczynnik koszty/efektywność.
Najbardziej efektywną alternatywą postępowania jest zastosowanie lamiwudyny jako leku z wyboru (scenariusz A). Pozwala ona uzyskać najlepszy wynik, mierzony zarówno liczbą serokonwersji, jak i liczbą unikniętych progresji do marskości wątroby. Najtańszą alternatywą jest „nieleczenie” (scenariusz E). Scenariusz B (INFa lekiem z wyboru), D (dostępny tylko INFa) i C (dostępne lamiwudyna i INFa), są zdominowane przez scenariusz A (lamiwudyna lekiem z wyboru), który zapewnia lepszy efekt przy niższym koszcie. Stosowanie lamiwudyny jako leku z wyboru (scenariusz A) jest najbardziej opłacalną alternatywą dla scenariusza „nieleczenie”. Analiza wrażliwości jednokierunkowa i wartości skrajnych wykazała, ze zmiany wartości kluczowych założeń i parametrów nie wpływają na wnioski końcowe analizy.
Summary
The aim of the study was to estimate the C/E of lamivudine and INFa in the treatment of chronic hepatitis B (CHB) in Poland. Model for the Polish health-care context was developed, based on the use of clinical data from literature and local data on health-care resource utilisation and unit cost. Costs and effects of a population of CHB patients were modelled using 5 scenarios, which attempt to reflect real-life practice, in which patients may receive any of the treatment options available and a proportion of patients may still receive no treatment because therapy is not suitable. Scenario A, B and C assumed the availability of both treatment options. The first choice of treatment is in A – lamivudine and in B – INFa. In scenario D the only approved treatment is INFa, in scenario E patient receive no antiviral treatment. The measure of outcomes were: HBeAg seroconversion and nonprogression to cirrhosis. Only direct medical costs were analysed. The perspective of health-care payers and time horizon of 1 year were taken. The one-way sensitivity analysis and extreme scenario analysis were performed. The best results in terms of seroconversion and nonprogression to cirrhosis were achieved in scenario A, costs were lowest in scenario E. Mean cost/HBeAg seroconversion and mean cost/cirrhosis avoided were (in PLN, 1 USD=4 PLN): for A – 35238 and 6480, for B – 72654 and 16289, for C – 49370 and 8689, for D – 20985 and 1474. The incremental analysis vs scenario E indicated, that A is more costs-effective alternative than B, C and D. Changing in value of key drivers for sensitivity analysis did not have any significant effect on the ICER. It was concluded, that lamivudine as the first choice treatment of CHB (scenario A) allows to receive the best results in terms of seroconversion and nonprogression to cirrhosis. This is the most cost-effective alternative to „no treatment” (scenario E).

Wstęp
Zapalenie wątroby typu B (wzw B) jest chorobą zakaźną wywołaną przez wirusa zapalenia wątroby typu B (HBV). Ocenia się, że na świecie wirusem tym zostały zakażone 2 mld osób. Zakażenie HBV przybiera wiele postaci klinicznych: od subklinicznego stanu nosicielstwa do ostrego lub przewlekłego zapalenia wątroby, które może prowadzić do marskości, raka wątroby, niewydolności wątroby i zgonu (1). Z zakażeniem wiąże się również wiele pierwotnie pozawątrobowych zespołów chorobowych, takich jak guzkowe zapalenie tętnic i inne naczyniowe choroby tkanki łącznej, błoniaste kłębkowe zapalenie nerek. WHO ocenia, że z powodu wzw B na świecie umiera rocznie około 1 miliona osób (2). Liczba przewlekłych nosicieli HBV jest oceniana na 350 mln (2). Szacuje się, że 25-40% chorych na przewlekłe wzw B umiera przedwcześnie z powodu marskości wątroby lub raka watroby (3). Przewlekłe wzw B jest najczęstszą przyczyną marskości wątroby oraz odpowiada za około 60% przypadków raka wątroby (2,3). Wzw B stanowi więc poważny problem zdrowotny i ekonomiczny. Z punktu widzenia zdrowia publicznego najważniejsze jest zapobieganie wzw B. Jednak szczepionka przeciw wzw B, wynaleziona we wczesnych latach 80-tych, nie jest 100% skuteczna i nie przynosi korzyści już zakażonym HBV. Stąd znacząca rola leków stosowanych w leczeniu chorych na przewlekłe wzw B. Standardowym postępowaniem w leczeniu przewlekłych zakażeń HBV są interferony alfa. Alternatywą dla interferonów alfa jest lamiwudyna, która wchodzi do szerokiego stosowania klinicznego. Przedmiotem analizy jest ocena ekonomiczna lamiwudyny i interferonu alfa w leczeniu wzwB.
Epidemiologia
W latach 1986-1990 w Polsce rejestrowano rocznie 14-15 tys. zachorowań na wzw B. Zapadalność wynosiła wówczas 37-40/100 tys. mieszkańców. Dzięki wprowadzonym w 1994 r. obowiązkowym szczepieniom przeciw wzw B zachorowalność na wzw B wyraźnie zmalała: w 1997 r. zarejestrowano 4-5 tys. zachorowań, a w 1999 r. – 3,8 tys. Zapadalność w latach 1997-1998 wynosiła 15-18/100 tys. mieszkańców, a w 1999 r. spadła poniżej 10/100 tys. mieszkańców. Według danych PZH nosicielstwo HBV w populacji polskiej wynosi 1-1,5%. W Polsce mamy więc około 380 tys.-500 tys. zakażonych HBV.
Zapotrzebowanie na leczenie przyczynowe
wzw B w Polsce
Przy założeniu, że 13% nosicieli może samoistnie wyeliminować HBV, oraz że u 20% pozostałych zakażonych rozwinie się przewlekle zapalenie wątroby, w ciągu ostatnich 10 lat w Polsce leczenia przeciwwirusowego wymagało 80-85 tys. chorych, w tym 35-40% dzieci (28-32 tys.). Leczenie interferonem alfa (INFa) rozpoczęto w Polsce w 1993 r. W latach 1993-1999 w ramach programu finansowanego przez Ministerstwo Zdrowia przeleczono około 1500 dorosłych i 2500 dzieci, łącznie 4000 zakażonych HBV, co stanowi około 5% osób wymagających leczenia przyczynowego. Przy uwzględnieniu indywidualnych zakupów leków oraz zakupów leków ze środków pozaministerialnych (w ramach programów badawczych – 500-700 osób), liczba zakażonych HBV, leczonych przyczynowo, wynosi w Polsce 5000. Trwała odpowiedź na leczenie INFa (eliminacja HBsAg i zanik HBV DNA) w materiale ocenianym dotychczas nie przekracza 39%, czyli dotyczy około 2000 pacjentów. Wynika z tego, że w grupie chorych już leczonych INFa co najmniej 3000 wymaga powtórnej terapii. Jeśli tę liczbę doliczymy do 75-80 tys. zakażonych HBV, których dotąd nie leczono, a którzy powinni być objęci terapią, to liczba osób kwalifikujących się do leczenia przeciwwirusowego wynosi w Polsce 77-83 tys. W ciągu najbliższych 10 lat należałoby każdego roku obejmować leczeniem pierwotnym, a w razie konieczności wtórnym, co najmniej 8000 chorych.
Leczenie przewlekłego wzw B
Przewlekłe wzw B jest skutkiem niewyeliminowania HBV. Powszechnie przyjęto, że za przewlekle wzw B uznaje się takie przypadki, w których nie dochodzi do eliminacji wirusa po upływie 6 miesięcy od zakażenia.
Leczeni powinni być ci pacjenci z przewlekłym wzw B, u których występuje:
jawna choroba wątroby,
ryzyko progresji choroby wątroby (dowody replikacji wirusa),
pozawątrobowe objawy choroby (zapalenie nerek, stan zapalny naczyń),
nawroty choroby,
zaawansowana choroba (niewyrównana marskość wątroby),
rozwój zakażenia u pacjentów po transplantacji wąroby.
Celem tej terapii jest:
zahamowanie replikacji HBV, czego wskaźnikiem jest uzyskanie serokonwersji HBeAg (zanik antygenu HBe (HBeAg) i pojawienie się przeciwciał anty-HBeAg (HBeAb),
poprawa czynności wątroby (nawet jeśli zakażenie HBV jest obecne), czego wskaźnikiem jest normalizacja podwyższonego stężenia aminotransferazy alaninowej (AlAT) i zahamowanie lub zwolnienie procesu włóknienia wątroby.
Przegląd piśmiennictwa
Skuteczność INFa w leczeniu wzw B
INFa jest standardowym lekiem w terapii przewlekłego wzw B (4). Rekomendowana dawka wynosi 5-10 mln j.m. podskórnie 3 razy w tygodniu przez 3-6 miesięcy (1, 5).
W badaniach klinicznych wykazano, że INFa powoduje eliminację antygenu HBe u 20-40% osób należących do wyselekcjonowanej grupy chorych na przewlekłe wzw B (6-13). Metaanaliza wyników 15 randomizowanych badań klinicznych, przeprowadzonych u łącznie 837 chorych rasy kaukaskiej wykazała, że – gdy INFa podawano przez 3-6 miesięcy, a czas obserwacji po leczeniu wynosił 6-12 miesięcy – liczba pacjentów, u których uzyskano zanik replikacji HBV, była w grupie leczonych INFa o około 20% większa niż w grupie kontrolnej (odpowiednio 33% vs 12% dla utraty HBeAg i 37% vs 17% dla zaniku HBV-DNA, p=0,0001) (14). Niższy wskaźnik odpowiedzi (15-21%) stwierdzono u chorych pochodzenia azjatyckiego, którzy często zostają zakażeni w okresie wczesnego dzieciństwa, oraz u chorych, u których rozwija się zakażenie wywołane przez wirusa z mutacją w regionie przedrdzeniowym, nie wytwarzającym antygenu HBe (mutant pre-core) (15-19).
Tabela 1. Wskaźniki zaniku HBeAg, serokonwersji w układzie HBe oraz serokonwersji w układzie HBE i zaniku BHV-DNA u chorych HBeAg (+), leczonych lamiwudyną przez 1 rok.
| Badanie | Utrata HBeAg | Serokonwersja HBeAg
w anty-HBe | Serokonwersja HBeAg
w anty-HBe oraz utrata HBV-DNA |
| LAM | Placebo | LAM | Placebo | LAM | Placebo |
| Dienstag i wsp. (32) | 32 | 11 | 20 | 7 | 17 | 6 |
| Schalm i wsp.(31) | 22 | – | 20 | – | 18 | – |
| Lai i wsp. (21) | 17 | 7 | 17 | 6 | 16 | 4 |
| Schiff i wsp.(24) | 33 | 13 | 21 | 13 | 18 | 13 |
Użycie surogatu, jakim jest zanik HBeAg, dla oceny serokonwersji w układzie HBe prawdopodobnie prowadzi do zawyżenia wskaźnika serokonwersji zarówno w grupie leczonych, jak i nieleczonych. Krogsggard i wsp. (20), analizując dane indywidualnych pacjentów z 10 randomizowanych, kontrolowanych badań klinicznych, w których INFa podawano chorym HBsAg i HBeAg pozytywnym, stwierdził, że w grupie INFa wskaźnik pojawienia się przeciwciał anty-HBe wynosił 1,64, podczas gdy wskaźnik zaniku HBe – 1,8.
Skuteczność lamiwudyny w leczeniu wzw B
Lamiwudyna jest syntetycznym analogiem nukleozydowym, który wykazuje aktywność przeciwwirusową anty-HIV i anty-HBV. Stosowana doustnie w dawce 100 mg 1 raz dziennie hamuje replikację HBV, zmniejsza stężenie wirusa w surowicy i hamuje proces włóknienia wątroby (21-27). W przeciwieństwie do INFa lamiwudyna okazała się lekiem użytecznym u chorych zakażonych HBV, przygotowywanych do przeszczepienia wątroby (28), jest bardzo efektywna u przewlekle zakażonych HBV o profilu serologicznym HBsAg(+), anty-HBe(+), HBV-DNA(+) (29), działa korzystnie u chorych z niewyrównaną marskością wątroby (30). Ponadto u chorych z przewlekłym wzw B leczonych lamiwudyną marskość wątroby rozwija się rzadziej niż u leczonych INFa (26).
Badania kliniczne III fazy wykazały, że wskaźnik serokonwersji w układzie e po trwającym 1 rok leczeniu lamiwudyną w dawce 100 mg/d doustnie wynosi 17-21% (21, 24, 31, 32). Wskaźnik ten jest znamiennie wyższy dla lamiwudyny 100 mg/d niż dla placebo i wynosi odpowiednio 17% i 6%, p<0,019 (19) oraz 20% i 7%, p<0,04 (32). W każdym badaniu klinicznym III fazy u większości chorych, u których uzyskano serokonwersję z HBeAg w anty-HBe, zanikał również HBV-DNA (tab.1), co sugeruje, że serokonwersja spowodowana lamiwudyną związana jest z supresją replikacji HBV (21, 24, 31, 32). U pacjentów otrzymujących lamiwudynę w badaniach klinicznych III fazy wskaźnik zaniku HBeAg po 1 roku był wyższy, niż wskaźnik serokonwersji (tab.1) i wynosił 17-32%.
Wskaźnik serokonwersji w układzie HBe wzrasta wraz z wydłużaniem terapii lamiwudyną i jest wyższy u chorych z podwyższonym wyjściowym stężeniem AlAT. W trwającym 3 lata badaniu azjatyckim (33) po 52 tygodniach wynosił on 17% (n=143), po 104 tygodniach – 27% (n=93), a po 156 tygodniach – 40% (n=58). Wyjściowe stężenia AlAT i HBV DNA u 58 chorych, którzy byli leczeni lamiwudyną przez 156 tygodni, wynosiły średnio 1,7 x ULN oraz 59,2 pg/ml. W grupie chorych z wyjściowym stężeniem AlAT 2-krotnie przekraczającym normę (> 2 x ULN) wskaźnik serokonwersji wynosił po 1. roku 38%, po 2. roku wzrósł do 43%, a po 3 latach – do 65%, natomiast u chorych z wyjściowym stężeniem AlAT <2 x ULN wartości te wynosiły odpowiednio – 9%, 19% i 19% (34). Podobny wpływ wyjściowego stężenia AlAT na wskaźnik serokonwersji po leczeniu lamiwudyną zaobserwowano w większości badań klinicznych III fazy. Na przykład w badaniu Chiena i wsp.(35) serokonwersja występuje u 5% spośród 87 chorych z wyjściowym stężeniem AlAT <2 x ULN, u 34% spośród 53 chorych z wyjściowym stężeniem AlAT> 2 x ULN i u 64% spośród 11 chorych z wyjściowym stężeniem AlAT> 5 x ULN. Wskaźniki serokonwersji w grupie placebo wynoszą odpowiednio: 2%, 7% i 14%. Analiza zintegrowanych danych z 4 badań klinicznych III fazy (21, 24, 25, 32) wykazuje tę samą pozytywną korelację pomiędzy wskaźnikiem serokonwersji w układzie HBe a wyjściowym stężeniem AlAT (36). Wprawdzie korelacja ta występuje również u pacjentów przyjmujących placebo, ale silniej zaznaczona jest w grupie leczonych lamiwudyną (tab.2). Wśród chorych z wyjściowym stężeniem AlAT> 5 x ULN wskaźnik serokonwersji wynosi 47% w grupie leczonych lamiwudyną, a tylko 14% w grupie placebo.
Tabela 2. Wyjściowe stężenie AlAT a wskaźnik serokonwersji u pacjentów przyjmujących placebo lub lamiwudynę przez 1 rok. Zintegrowane dane z badań klinicznych III fazy. (36).
| Wyjściowe stężenie AlAT | Placebo
(n=196) | Lamiwudyna (n=406) |
| > 1 x ULN | 9% (16/171) | 22% (76/351) |
| > 2 x ULN | 12% (13/112) | 28% (65/231) |
| > 5 x ULN | 14% (2/28) | 47% (29/62) |
Leczenie lamiwudyną powoduje znaczącą poprawę obrazu histologicznego wątroby w porównaniu z grupą kontrolną placebo (52% vs 23%, p<0,001) (32) i znacząco zmniejsza postęp choroby w kierunku włóknienia: 5% vs 20%, p=0,01 (29), 1,8 % vs 7,1%, p=0,04 (26). Poprawa obrazu histologicznego wątroby po leczeniu lamiwudyną występuje niezależnie od tego, czy nastąpiła utrata HBeAg, czy też nie. W badaniu Lai i wsp. (21) poprawę obrazu histologicznego wątroby stwierdzono u 46% u chorych pozostających HBeAg+ po rocznym stosowaniu lamiwudyny, a u 64% chorych, u których uzyskano zanik HBeAg.
Lamiwudyna vs INFa
W badaniach klinicznych, bezpośrednio porównujących monoterapię lamiwudyną z monoterapią INFa (25, 31), wskaźniki serokonwersji po 1 roku stosowania lamiwudyny w dawce doustnej 100 mg/d i po 4-miesięcznym stosowaniu INFa w dawce 10 mln j.m. 3 razy w tygodniu podskórnie nie różniły się znamiennie statystycznie i wynosiły odpowiednio 20% i 21% (25) oraz 18% i 19% (31). Wskaźnik zaniku HBeAg w obu grupach był taki sam i wynosił 22% (25). Pośrednie porównanie monoterapii lamiwudyną z monoterapią INFa (za pomocą wspólnej referencji, jaką jest placebo) również pozwala na stwierdzenie, że nie ma znamiennych różnic w skuteczności obu leków (14, 32). W badaniu Dienstaga i wsp. (32) zanik HBeAg występował u 32% leczonych lamiwudyną i 11% przyjmujących placebo, a w metaanalizie 15 badań klinicznych, w których określano skuteczność INFa w leczeniu przewlekłego wzw B, zanik HBeAg występował u 33% chorych otrzymujących INFa i 12% nieleczonych chorych (14). Ryzyko rozwoju marskości wątroby jest u chorych leczonych lamiwudyną mniejsze niż u chorych leczonych INFa i wynosi odpowiednio 1,8% oraz 9,5% (26).
W badaniach klinicznych bezpośrednio porównujących monoterapię lamiwudyną z monoterapią INFa u chorych z wyjściowym stężeniem AlAT 2-krotnie przekraczającym normę, wskaźniki serokonwersji HBeAg wynosiły odpowiednio 26,5 i 23,8, ale różnica nie była znamienna statystycznie (25). Biorąc pod uwagę skumulowane wyniki 3 badań klinicznych (25, 21, 23), wskaźniki serokonwersji HBeAg wynoszą 30% dla lamiwudyny, 24% dla INFa i 9% dla placebo (tab.3). Według wyników tych badań u wszystkich chorych, u których uzyskano serokonwersję HBeAg, niezależnie od tego, czy otrzymywali lamiwudynę, INFa czy placebo, nie rozwinęła się marskość wątroby. Natomiast u tych chorych, u których nie uzyskano serokonwersji HBeAg, ryzyko rozwoju marskości wątroby jest najmniejsze w przypadku stosowania lamiwudyny (2% vs 14% u leczonych INFa lub placebo).
Tabela 3. Podsumowanie wyników badań klinicznych z lamiwudyną i INFa u chorych z wyjściowym stężeniem AlAT 2-krotnie przekraczającym normę.
| Badanie | Liczba pacjentów, % pacjentów (95% CI) | Różnica
(95% CI)
|
| Lam | INFa | Placebo |
Lam vs INFa (25)
Europa, Autralia,
N.Zel., Kanada | 49, 26,5
(14,2; 38,9) | 42, 23,8
(10,9; 36,7) | | 2,7
(-17,8;24,6) |
| Lam vs placebo (23) USA, | 46, 23,0
(11,6; 36,2) | | 53, 7,7
(0,4; 14,9) | 16,2
(-1,3; 35,7) |
Lam vs placebo (21)
Azja (Hong Kong, Singapur, Tajwan) | 53, 37,7
(24,7; 50,8) | | 29, 10,3
(-0,7; 21,4) | 27,4
(5,3; 49,3) |
Skumulowane wyniki
(21,23,25) |
| Serokonwersja HbeAg | 148, 29,7
(22,4; 37,1) | 42, 23,8
(10,9; 36,7) | 81, 8,6
(2,5; 14,8) | Lam vs placebo:
21,1 (9,2; 32,9)
Lam vs
INFa:
5,9 (-11,2; 23,4)
INFa vs placebo:
15,2 (-0,7, 33,9) |
| Progresja do marskości | 104, 2
(-0,72; 4,56) | 28, 14
(1,32; 27,25) | 52, 14
(4,18; 22,74) | Lam vs placebo:
-11,54 (-0,14; 26,84
Lam vs
INFa:
-12,36 (-35,20; 26,84)
INFa vs placebo:
0,82 (-18,65; 25,94) |
Trwałość odpowiedzi po leczeniu wzw B lamiwudyną oraz INFa
Analiza randomizowanych, kontrolowanych placebo badań klinicznych wskazuje, że dokonana pod wpływem lamiwudyny serokonwersja w układzie HBe jest u większości pacjentów efektem trwałym: po 6 i 15 miesiącach od zaprzestania terapii utrzymuje się odpowiednio u 91% i 83% pacjentów (24, 37). Po 21 miesiącach utrzymywanie się serokonwersji stwierdzono u 86% leczonych uprzednio lamiwudyną (38), w badaniu tym jednak do oceny serokonwersji w układzie HBe używano surogatu, jakim jest zanik HBeAg. Niektórzy autorzy przedstawiają gorsze wyniki leczenia lamiwudyną, np. Song i wsp. (39), ale wiąże się to najczęściej z krótszym niż 12 mies. okresem leczenia leczenia lamiwudyną. Trwałość serokonwersji w układzie HBe po leczeniu wzw B lamiwudyną w okresie po zakończeniu terapii przedstawia tab. 4. Dla porównania w tab. 5 przedstawione są wyniki dotyczące trwałości serokonwersji w układzie HBe po leczeniu INFa. Na podstawie tych danych można stwierdzić, że:
utrzymywanie się serokonwersji w układzie HBe po leczeniu lamiwudyną jest równie trwałe, jak po leczeniu INFa,
serokonwersja w układzie HBe albo zanik HBeAg jest właściwym momentem do zakończenia leczenia lamiwudyną, gdyż mamy gwarancję, że efekty te są trwałe.
Tabela 4. Trwałość odpowiedzi po leczeniu wzw B lamiwudyną.
Okres po zakończeniu leczenia
(średnia w mies.) | Rodzaj odpowiedzi | Odsetek pacjentów, u których odpowiedź jest trwała | Literatura |
| 6 (0-12) | HBeAg(-)/anty-HBe(+) | 31/34 (91%) | Schiff (37) |
| 15 (0-33) | HBeAg(-)/anty-HBe(+) | 35/42 (83%) | Schiff (24) |
| 21 (0-30) | HBeAg(-) | 37/43 (86%) | Schiff (38) |
| 4 | HBeAg(-)/anty-HBe(+)
HBV-DNA(-)HBeAg (-) | 8/11 (73%)
17/21 (81%) | Dienstag (32) |
| 4-12 | HBeAg(-)/anty-HBe(+)
HBV-DNA(-) lub HbeAg(-) | 7/7 (100%) | Dienstag (40) |
| 12 | HBeAg(-)/HBV-DNA(-) | 11/15 (73%) | Chang (34) |
Tabela 5. Trwałość odpowiedzi po leczeniu wzw B INFa.
Okres po zakończeniu leczenia
(średnia w latach) | Rodzaj odpowiedzi | Odsetek pacjentów, u których odpowiedź jest trwała | Literatura |
| 4,3 (3-7) | HBeAg(-)/HBV-DNA (-) normalizacja AlAT | 20/23 (97%) | Korenman (41) |
| 8,2 (1,1-11,5) | HBeAg(-)/HBV-DNA(-) | 25/28 (89%) | Lin (42) |
| 6,9 (3,5-10) | HBeAg(-) | 29/31 (94%) | Lau (43) |
| 4,7 (0,2-7,5) | HBeAg(-)/HBV-DNA (-) | 70/80 (88%) po
INFa
i spontaniczna | Krogsgaard (13) |
| 3,4 (1-9,2) | HBeAg(-)/HBV-DNA (-) | 23/32 (72%) | Teuber (44) |
| 3,4 (1,6-6,6) | HBeAg(-) | 24/29 (83%) | Lok (16) |
Skuteczność skojarzonego leczenia lamiwudyną i INFa
Skuteczność skojarzonego leczenia lamiwudyną i INFa oceniano w dwóch badaniach klinicznych (24, 31).Przesłanką racjonalną dla tych badań był różny mechanizm działania obu leków i w związku z tym możliwość synergistycznego działania. Schalm i wsp. porównywali monoterpię lamiwudyną lub INFa z terapią skojarzoną lamiwudyna/INFa u chorych nie leczonych uprzednio INFa (31). Schiff i wsp. porównywali monoterapię lamiwudyną i terapię skojarzoną lamiwudyna/INFa z placebo u chorych nie odpowiadających na leczenie INFa(24). Po 1 roku leczenia lamiwudyną wskaźnik utraty HBeAg i serokonwersji w układzie HBe był podobny do wyniku uzyskanego po standardowym leczeniu INFa (31) i wyższy niż w grupie placebo (24). U uprzednio nieleczonych chorych wskaźnik serokonwersji w przypadku terapii skojarzonej lamiwudyna/INFa był wyższy, aniżeli u leczonych lamiwudyną lub INFa: 29% vs 18% vs 19% (31). Różnice te nie były statystycznie znamienne w analizie przeprowadzonej według zasady „zamiaru leczenia”, natomiast w retrospektywnej analizie „per protocol” stwierdzono znamienne statystycznie różnice pomiędzy terapią skojarzoną (36%) a monoterapią lamiwudyną (19%) (p=0,02). W badaniu przeprowadzonym u pacjentów nie odpowiadających uprzednio na leczenie INFa, terapia skojarzona nie była skuteczniejsza niż monoterapia lamiwudyną (24).
Skuteczność lamiwudyny u chorych, u których występuje mutant YMDD
Pod wpływem leczenia lamiwudyną u niektórych chorych może występować mutant HBV, określany symbolem YMDD, który może być powodem zmniejszonej aktywności lamiwudyny. Po roku stosowania lamiwudyny mutant YMDD wykrywany był u 14-32% chorych (31, 21, 32), a po 2 i 3 latach odpowiednio u 42% i 52% azjatyckich chorych (33, 45). W ciągu 3-4 miesięcy po zakończeniu leczenia występowanie mutanta YMDD zmniejsza się: z 32% do 29% (32), z 31% do 21% (31) i z 27% do 21% (24). Wśród chorych otrzymujących lamiwudynę pojawienie się mutantów YMDD zmniejsza, ale nie uniemożliwa serokonwersji w układzie HBe (21). Po 3 latach stosowania lamiwudyny serokonwersja wystąpiła u 22% chorych z mutantem YMDD oraz u 50% chorych, u których wariant YMDD był nieobecny (33).
Tolerancja INFa i lamiwudyny
Stosowanie INFa jest znacznie ograniczone przez liczne przeciwwskazania, do których należą m.in.: marskość lub niewyrównana niewydolność wątroby, nadwrażliwość na lek, ciężka choroba serca, ciężkie zaburzenia czynności nerek, padaczka, leczenie immunosupresyjne (z wyjątkiem krótkotrwałej terapii sterydowej), wywiad w kierunku choroby autoimmunologicznej (20). Ponadto działania niepożądane INFa – depresja, psychozy, skłonności samobójcze, ciężkie objawy rzekomo-grypowe, neutropenia, przemijające zaostrzenie objawów choroby – sprawiają, że leczenie często nie jest akceptowane przez chorych lub też konieczne jest monitorowanie pacjentów (6, 46). Ocenia się, że z powodu przeciwwskazań i działań niepożądanych INFa jest stosowany u 20% chorych wymagających leczenia przeciwwirusowego (6, 12, 47, 48).
Lamiwudyna jest lepiej tolerowana przez pacjentów niż INFa, a jednocześnie ma podobny do placebo profil bezpieczeństwa (21, 23, 27). Ponadto może być stosowana u tych pacjentów, u których INFa jest przeciwwskazany, a mianowicie u chorych z zaawansowaną chorobą watroby, leczonych immunosupresyjnie (szczególnie po przeszczepach narządowych) oraz u tych z chorobami psychicznymi w wywiadach. Dzięki doustnej drodze podania lamiwudyna może być stosowana także u tych chorych, którzy nie wyrażają zgody na leczenie parenteralne. Ocenia się, że lamiwudyna może być stosowana u 90% chorych wymagających leczenia przeciwwirusowego (47).
Materiał i metody
Populacja docelowa
Chorzy z przewlekłym zapaleniem wątroby, HBeAg(+), bez cech marskości wątroby, w wieku 30 lat, 70% płci męskiej. Grupa ta reprezentuje tych pacjentów, którzy najprawdopodobniej otrzymują leczenie przeciwwirusowe w Polsce.
Perspektywa badania
Płatnik za usługi zdrowotne (pacjent i budżet kas chorych).
Horyzont czasowy:
12 miesięcy.
Technika badawcza:
Analiza typu efektywności kosztów.
Modelowanie przeprowadzono, uwzględniając 5 scenariuszy.
Scenariusz A zakłada dostępność lamiwudyny i INFa i uwzględnia przeciwwskazania i tolerancję obu leków. Lekiem z wyboru jest lamiwudyna, tzn. INFa otrzymują tylko ci chorzy, którzy nie kwalifikują się do leczenia lamiwudyną, a mogą być leczeni INFa.
Scenariusz B zakłada dostępność lamiwudyny i INFa i uwzględnia przeciwwskazania i tolerancję obu leków. Lekiem z wyboru jest INFa, tzn. lamiwudynę otrzymują tylko ci chorzy, którzy nie kwalifikują się do leczenia INFa, a mogą być leczeni lamiwudyną.
Scenariusz C zakłada dostępność lamiwudyny i INFa i uwzględnia przeciwwskazania i tolerancję obu leków. Chorzy, którzy kwalifikują się do leczenia lamiwudyną i INFa są w 50% leczeni lamiwudyną, a w 50% INFa. U chorych, którzy nie kwalifikują się do leczenia INFa, jeśli to możliwe stosowana jest lamiwudyna.
Scenariusz D zakłada, że dostępny jest tylko INFa i uwzględnia przeciwwskazania i tolerancję tego leku.
Scenariusz E zakłada, że chorzy nie otrzymują leczenia przeciwwirusowego, przedstawia więc naturalny przebieg wzw B. Względem tego scenariusza obliczono inkrementalny koszt i inkrementalny wynik leczenia według scenariuszy A, B, C i D.
Jednostką efektywności w modelu 1-rocznym jest:
uzyskanie serokonwersji w układzie HBe,
zahamowanie progresji do marskości (progresja do marskości wątroby definiowana jest jako zwiększenie punktacji w skali Knodella z 0, 1 lub 3 przed leczeniem do 4 po leczeniu).
Model ten pozwala obliczyć średni koszt uzyskania serokonwersji w każdym scenariuszu, średni koszt uniknięcia progresji do marskości oraz inkrementalne współczynniki koszty/efektywność.
W modelu 1-rocznym wykorzystano dane z opublikowanych randomizowanych, kontrolowanych badań klinicznych i obserwacyjnych oraz polskie dane o wykorzystanych zasobach i cenach jednostkowych, uzyskane od polskich ekspertów.
Model Prawdopodobieństwa
Model 1-roczny przedstawia ryc.1 i ryc. 2., a prawdopodobieństwa wystąpienia poszczególnych zdarzeń – tab. 6. Początkowo wszyscy pacjenci w tym modelu są HBeAg (+), po upływie 1 roku mogą znajdować się w jednym z trzech stanów zdrowia: serokonwersja, przewlekłe wzwB bez marskości wątroby, wyrównana marskość wątroby. Opierając się na danych pochodzących z literatury (21, 27, 23), przyjęto, że lamiwudynę może przyjmować 90% chorych wymagających leczenia przeciwwirusowego. Z powodu licznych przeciwwskazań INFa może być stosowany u 40% chorych wymagających leczenia przeciwwirusowego, ale z powodu działań niepożądanych i parenteralnej drogi podania tylko 50% tych chorych przyjmuje lek, a pozostali chorzy są leczeni objawowo (nieleczeni) (6, 12, 47, 48). Prawdopodobieństwa serokonwersji po stosowaniu lamiwudyny (19%, zakres 18-20%) i INFa (20%, zakres 19-21%) określono na podstawie wyników 2 randomizowanych, kontrolowanych badań klinicznych, porównujących bezpośrednio terapię lamiwudyną i INFa (25, 31). Na podstawie wyników badań porównujących lamiwudynę z placebo (21, 32) prawdopodobieństwo serokonwersji po stosowaniu placebo oszacowano na 6,5% (zakres 6-7%). Prawdopodobieństwo progresji choroby w kierunku marskości oszacowano, biorąc pod uwagę wyniki randomizowanych, kontrolowanych badań klinicznych, w których oceniano postęp choroby w kierunku włóknienia po stosowaniu lamiwudyny, placebo i INFa (26, 32). Założywszy, że progresja do marskości następuje tylko u chorych, u których nie uzyskano serokonwersji (25, 21, 23), jej prawdopodobieństwo u leczonych lamiwudyną wynosi 0,02 (0,018-0,05), u leczonych INFa – 0,12 (0,09-0,14), a u nieleczonych przeciwwirusowo – 0,08 (0,07-0,2).
Tabela 6. Prawdopodobieństwa zdarzeń w modelu 1-rocznym. Wartości użyte w analizie wyjściowej i w analizie wrażliwości.
| Zmienna | Prawdopodobieństwo | Zakres | Piśmiennictwo |
| Kwalifikacja do leczenia lamiwudyną | 0,9 | 0,5-0,99 | 21, 23, 27 |
| Kwalifikacja do leczenia INFa | 0,4 | 0,2 – 0,8 | 6, 12, 47, 48 |
| Nietolerancja INFa | 0,5 | 0,0 – 0,5 | 6, 46 |
| Serokonwersja HbeAg | | | |
| mmLeczeni lamiwudyną | 0,19 | 0,18 – 0,2 | 25, 31 |
| mmLeczeni INFa | 0,2 | 0,19 – 0,21 | 25, 31 |
| mmNieleczeni | 0,065 | 0,06 – 0,07 | 21, 32 |
| Progresja do marskości | | | |
| Pacjenci, u których wystąpiła serokonwersja | 0,0 | | 25, 21, 23 |
| Pacjenci, u których nie wystąpiła serokonwersja | | | |
| mmLeczeni lamiwudyną | 0,02 | 0,018 – 0,05 | 26, 32 |
| mmLeczeni INFa | 0,12 | 0,09 – 0,14 | 26, 32 |
| mmNieleczeni | 0,08 | 0,07 – 0,2 | 26, 32 |

Ryc. 1. Model drzewa decyzyjnego.
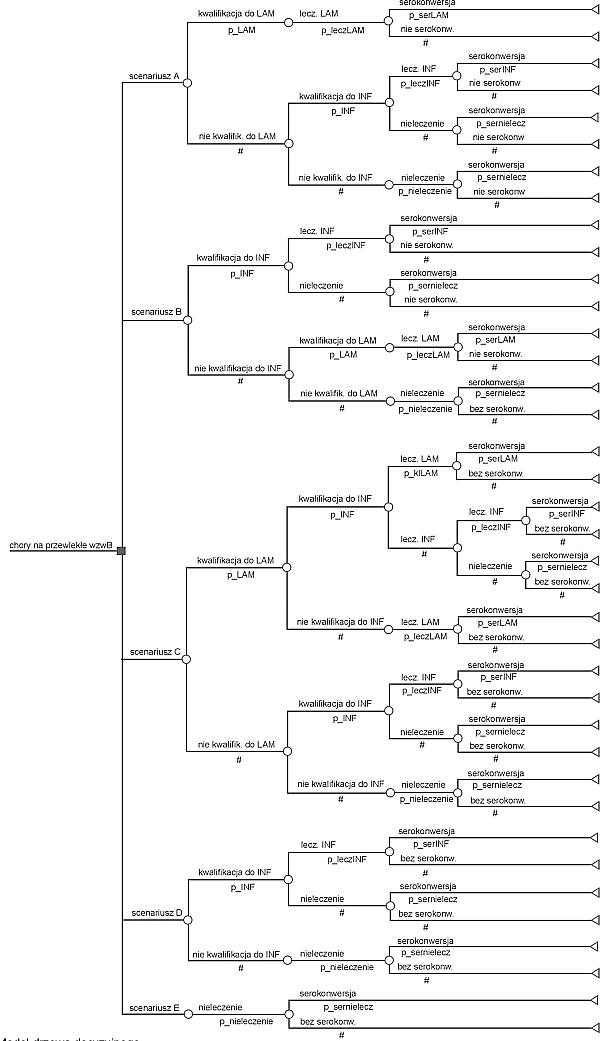
Ryc. 2. Model drzewa decyzyjnego.
Koszty
Koszty bezpośrednie medyczne obejmują: koszt leku i jego podania oraz koszty związane z kwalifikacją chorego do leczenia oraz monitorowaniem terapii. Na podstawie przeprowadzonej wśród hepatologów ankiety ustalono, że INFa najczęściej podawany jest w Polsce w dawce 5 mln j.m. 3 razy w tygodniu przez 6 miesięcy. Pacjenci leczeni lamiwudyną otrzymują lek doustnie w dawce 0,1 g codziennie przez 12 miesięcy. Założono, że chorzy nie otrzymujący leczenia przeciwwirusowego, nie będą również otrzymywać żadnych leków objawowych. Nie brano również pod uwagę kosztów leczenia działań niepożądanych leków.
Schemat postępowania z chorym na wzwB, zakwalifikowanym do leczenia lamiwudyną lub INFa ustalony został na podstawie opinii polskich ekspertów hepatologów.
Schemat postępowania z chorym na przewlekłe wzwB, zakwalifikowanym do leczenia lamiwudyną.
Kwalifikacja do leczenia
badanie lekarskie,
badania laboratoryjne: HBsAg, HBeAg, anty-HBe, polimeraza DNA, morfologia, OB, proteinogram, płytki krwi, transaminazy, bilirubina
usg jamy brzusznej,
biopsja wątroby, jeśli podwyższone stężenie AlAT w surowicy .
Leczenie
doustnie 0,1 g lamiwudyny 1 raz dziennie przez 12 miesięcy.
Monitorowanie
badania laboratoryjne: transaminazy, morfologia, HBeAg, HBsAg w co miesiąc w ciągu pierwszych 6 miesięcy, potem co 3 miesiące (7 oznaczeń)
porady lekarskie co miesiąc w ciągu pierwszych 6 miesięcy, potem co 3 miesiące (7 porad ambulatoryjnych).
Schemat postępowania z chorym na przewlekłe wzwB, zakwalifikowanym do leczenia INFa.
Kwalifikacja do leczenia
badanie lekarskie,
badania laboratoryjne: HBsAg, HBeAg, anty-HBe, polimeraza DNA, morfologia, OB, proteinogram, płytki krwi, transaminazy, bilirubina, kreatynina, mocznik, białko w moczu,
usg jamy brzusznej z oceną przepływów metodą Dopplera,
biopsja wątroby.
Leczenie
podskórnie 3 razy w tygodniu 5 mln j.m. przez 6 miesięcy (72 wizyty ambulatoryjne),
hospitalizacja 10-14 dni.
Monitorowanie
badania laboratoryjne: transaminazy, morfologia, HBeAg, HBsAg w 1.miesiącu co 7 dni, w 2.-6. miesiącu co 4 tygodnie, następnie co 3 miesiące (11 oznaczeń), TSH co 6 miesięcy (2 oznaczenia),
porady lekarskie w 1.miesiącu co 7 dni, w 2.-6. miesiącu co 4 tygodnie, następnie co 3 miesiące (11 porad ambulatoryjnych).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Gładysz A., Juszczyk J. Leczenie chorób wąroby. Volumed, Wrocław, 1996.
2. World Health Organization. Hepatitis B fact sheet WHO/204 [internet web page].
3. Lee W.M. Hepatitis B virus infection. N.Engl. J. Med., 1997, 337, 1733-44.
4. Juszczyk J. Wirusowe zapalenie wątroby, PZWL, Warszawa, 1999.
5. The CASL Hepatitis Consensus Group. Treatment of chronic viral hepatitis with alpha-interferon: A consensus conference report. Can. J. Infect. Dis., 1994, 5, 107-12.
6. Nicoll A. Locarnini S. Present and future directions in the treatment of chronic hepatitis B infection. J. Gastroenterol. Hepatol., 1997, 12, 843-53.
7. Niederau C., Heintges T., Lange S., et al. Long trem follow-uo of HbeAg-postive patients treated with interferon alfa for chronic hepatitis B. N. Engl. J. Med., 1996, 334, 1422-7.
8. Lau D.T., Everhardt J., Kleiner D.L., et al. Long term follow-up of patients with chronic hepatitis B treated with interferon alpha. Gastroenterology, 1997, 113, 1660-7.
9. Hope R.L., Welman M., Dingley J., et al. Interferon alpha for chronic active hepatitis B, long term follow-up of 62 patients: outcomes and predictors of response. meMedJ. Aust., 1995, 162, 8-11.
10. Tine F., Liberati A., Craxi A. Et al. Interferon treatment in patients with chronic hepatitis B: a meta-analysis of the published literature. J. Hepatol., 1993, 18, 154-62.
11. Burt M.J., Ross A.G., Schoeder B.A., et al. Evaluation of alpha interferon for the treatment of chronic hepatitis B infection in Christchurcg. N.Z. Med. J., 1996, 109, 162-4
12. Hoffnagle J.H. Therapy of viral hepatitis. Digestion, 1998, 59, 563-78.
13. Krogsgaard D. The long-term Follow-up Investigator Group, The European Study Group on Viral Hepatitis (EUROHEP) Executive Team on Antiviral treatment. The long term effect of treatment with interferon alpha 2a in chronic hepatitis B. J. Viral Hepat., 1998, 5, 389-97.
14. Wong D.K.H., Cheung A.M., O´Rourke K, et al. Effect of alpha-interferon treatment in patients with hepatitis B e antigen-positive chronic hepatitis B - a meta-analysis. Annals of Internal Medicine, 1993, 199 (4), 312-23
15. Lampertico P., Del Ninno E., Maniz A., et al. A randomised, controlled trial of 24-month course of interferon alfa 2b in patients with chronic hepatitis B who had hepatitis B virus DNA without hepatitis B e antigen in serum. Hepatology, 1997, 26, 1621-5.
16. Lok A.S., Chung H.T., Liu V.W., et al. Long-term follow-up of chronic hepatitis B Patients treated with interferon alfa. Gastroenterology, 1993, 105, 1833-8.
17. Lok A.S., Lai C.L., Wu P.C., et al. Long-term follow-up in a randomised controlled trial of recombinant alpha2-interferon in Chinese patients with chronic hepatitis B infection. Lancet, 1988, II, 298-302.
18. Guptan R.K., Thakur V., Malhortra V., et al. Low-dose recombinant interferon therapy in anti Hbe-positive chronic hepatitis B in Asian Indians. J. Gastroenterol. Hepatol., 1998, 13, 675-9.
19. Zhang X., Zoulim F., Haberseber I., et al. Analysis of hepatitis B virus genotypes and pre-core region variability during interferon treatment of Hbe antigen negative chronic hepatitis B. J.Med. Virol., 1996, 48, 8-16.
20. Krogsgaard K., Bindsley N., Christenses E., et al. The treatment effect of alpha interferon in chronic hepatitis B is independent of pre-treatment. Results based on individual patient data from 10 clinical controlled trial. Journal of Hepatology, 1994, 21, 646-55.
21. Lai C.L., Chien R.N., Leung N.W.Y., et al. A one-year trial of lamivudine for chronic hepatitis B. N. Engl. J. Med., 1998, 339, 61-8.
22. Dienstag J., Perillo R.P., Schiff E.R., et al. A preliminary trial of lamivudine for chronic hepatitis B infection. N. Engl. J. Med., 1995, 333, 1657-61.
23. Dienstag J., Schiff E., Wright T., et al. Lamivudine treatment one year in previously untreated US hepatitis B patients: histological improvement and hepatitis e-antigen (HbeAg) seroconversion (abstract). Gastroenterology 1998, 114, A 1235.
24. Schiff E., Karayalcin S., Grimm I., et al. A placebo controlled study of lamivudine and interferon a-2b in patients with chronic hepatitis B, who previously failed interferon therapy. Hepatology, 1998, 28(4), Part 2 388 A (Abstract 901).
25. Heatcote J., Schalm S.W., Cianciara J., et al. Lamivudine and Intron A combination treatment in patients with chronic hepatitis B infection (abstract). J. Hepatol., 1998, 28 Suppl. 1, 43.
26. Goodman Z., Dhillon A.P., Wu P.C., et al. Lamivudine treatment reduces progression to cirrhosis in patients with chronic hepatitis B (abstract) J. Hepatol., 1999, 30 Suppl. 1, 59.
27. Nevens F., Main J., Honkoop P., et al. Lamivudine therapy for chronic hepatitis B: a six month randomised dose-ranging study. Gastroenterology, 1997, 113, 1258-63.
28. Grellier L., Mutimer D., Ahmed M et al. Lamivudine prophylaxis against reinfection in liver transplantation for hepatitis B cirrhosis. Lancet, 1996, 348, 1212.
29. Tassopoulos N.C., Volpes R., Patore G. et al. Lamivuddine therapy in patients with anti-HBe positive chronic hepatitis B; end of treatment analysis. J. Hepatol., 1998, 28 (Suppl.1), 43
30. Villeneuve J.P., Bilodeau M., Fenyves D. Suppression of hepatitis B virus replication by Lamivudine results in improvement of liver function in patients with severe cirhosis. Hepatology 1997, 26 (Suppl.), 430A.
31. Schalm S.W., Heathcote J, Cianciara J., et al. Lamivudine and alpha interferon combination treatment of patients with chronic hepatitis B infection: a randomized trial. Gut, 1999.
32. Dienstag J., Schiff E., Wright T., et al. Lamivudine as initial treatment for chronic hepatitis B in the United States. N. Engl. J. Med., 1999, 341, 1256-1263.
33. Leung N.W.Y,, Lai C.L., Chang T.T. Three year lamivudine therapy in chronic HBV . J. Hepatology, 1999, 30(Suppl.), 59.
34. Chang T.T., Lai C.L., Liaw Y.F., et al. Enhanced HBeAg seroconversion rates in Chinese patients on lamivudine. Hepatology, 1999, 28(4 Pt 2), 420A.
35. Chien R.N., Liaw Y.N., Atkins M. Pretherapy alanine transaminase level as a determinant for hepatitis B e antigen seroconversion during lamivudine therapy in patients with chronic hepatitis B. Hepatology, 1999, 30, 770-774.
36. Perillo R.P., Schalm S.W., Schiff E.R., et al. Predictors of HBeAg seroconversion in chronic hepatitis B patients treated with lamivudine. Hepatology 1999, 28(4 Pt), 317A.
37. Schiff E., Cianciara J., Kowdley K. et al. Durability of HBeAg seroconversion after lamivudine monotherapy in controlled phase II and III trials. Hepatology 1998, 28 (No 4 Pt 2), 163A (Abstract 1).
38. Schiff E., Cianciara J., Karayalcin S., et al. Durable HBeAg and HBsAg seroconversions after lamivudine for chronic hepatitis B (CHB). Abstract submitted to EASL 2000 Rotterdam.
39. Song B.C., Suh D.J., Lee H.C., Chung Y.H., Lee Y.S. Seroconversion after lamivudine treatment is not durable in chronic hepatitis. Hepatology, 1999, 30 (No 4, Pt. 2), 348A (Abstract 749).
40. Dienstag J.L., Schiff E.R., Mitchell M., et al. Extended lamivudine retreatment for chronic hepatitis B: maintenance of viral suppression after discontinuation of therapy. Hepatology, 1999, 30, 1082-7.
41. Korenman J., Baker B., Waggoner J., Everhart J.E., et al. Long-term remission of chronic hepatitis B after interferon a therapy. Annals of Internal Medicine, 1991, 114, 629-634.
42. Lin S.M., Sheen I.S., Chien R.N., Chu C.M., Liaw Y.F. Long-term beneficial effect of interferon therapy in patients with chronic hepatitis B virus infection. Hepatology, 1999, 29, 971-975.
43. Lau D.T., Everhart J., Kleiner D.E., et al. Long-term follow-up of patients with chronic hepatitis B treated with interferon a. Gastroenterology, 1997, 113, 1660-1667.
44. Teuber G., Dienas H.P.,et al. Long-term follow-up of patients with chronic hepatitis B after interferon treatment. Zeitschrift fur Gastroenterologie, 1996, 34, 230-236.
45. Liaw Y.H., Lai C.L., Leung N.W.Y., et al. Two years lamivudine therapy in chronic hepatitis B infection: results of a plcebo-controlled multicentre study in Asia. Gastroenterology, 1998, 114 (4 Pt. 2): A 1289.
46. Dejongh F.E., Janssen H.L., De Man R.A., et al. Survival and prognostic indicators in hepatitis B surface antigen-positive cirrhosis of the liver. Gastroenterology, 1992, 103, 1630-5.
47. Crowley S.J., Tognarini D., Desmond P., Lees M. Cost-effectiveness analysis of lamivudine for the treatment of chronc hepatitis B. Pharmacoeconomics, 2000, 17(5), 409-427.
48. Farell G.C. Chronic viral hepatitis. Med. J. Aust., 1998, 168, 619-26.
49. Wong J.B., Koff R.S., Tine F. Et al. Cost-effectiveness of interferon-alpha 2b treatment for hepatitis B e antigen-positive chronic hepatitis B. Ann. Intern. Med., 1995, 122, 664-75.
50. Wong J.B. Interferon treatment for chronic hepatitis B or C infection: costs and effectiveness. Acta gastroenterol. Belg., 1998, 61, 238-42.
51. Dushieko G.M., Roberts J.A. treatment of chronic type B and C hepatitis with interferon alpha: an economic appraisal. Hepatology, 1995, 22, 1863-73.
52. Sarin S.K. Hepatitis B mutants: prevalence, significance and therapy (editorial). Hepatit World, 1998, 3, 1.
53. Tassopoulos N.C., Volpes R., Pastore G, et al. Efficacy of lamivudine in patients with hepatitis B e antigen-negative/hepatitis B virus DNA-positive (precore mutant) chronic hepatitis B. Hepatology, 1999, 29, 889-96.
54. Chayama K., Suzuki Y., Kobayashi M., et al. Emergence and takeover of YMDD motif mutant hepatitis B virus during long-term lamiwudine therapy and re-takeover by wild type after cessation of therapy. Hepatology, 1998, 27, 1711-6.
55. Honkoop P., de Man R.A., Niesters H., et al. Clinical impact of lamivudine resistance in chronic hepatitis B. J. Hepatol., 1998, 29, 510-4.


