© Borgis - Postępy Fitoterapii 2/2012, s. 101-107
Anna Hering, *J. Renata Ochocka
Mangiferyna – naturalnie występujący polifenol o właściwościach antyoksydacyjnych
Mangiferin a natural polyphenol with antioxidant properties
Katedra i Zakład Biologii i Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Gdański Uniwersytet Medyczny
Kierownik Katedry: prof. dr hab. J. Renata Ochocka
Summary
Mangiferin is a natural C-glucosylxanthone widely distributed in unrelated angiosperm families and ferns. The main source of mangiferin is mango tree (Mangifera indica, L. Anacardiaceae), were occurs in different organs with the highest concentration in stem bark and leaves. Plants with significant mangiferin content are traditionally used for medicinal purposes in tropical and subtropical regions. Mangiferin as a strong antioxidant, is probably responsible for many pharmacological activities which may support its numerous regional uses in folk medicine. According to researches from last years, mangiferin is highly reactive metabolite with mechanism of action similar to most flavonoids, which is based on defense of cells and its macromolecules against oxidative stress. Reported health-promoting properties of mangiferin include: antioxidant, radioprotective, antitumor, immunomodulatory, anti-allergic, anti-inflammatory, antidiabetic, lipolytic, antibone resorption, monoamine oxidase inhibiting, antiviral, antifungal, antibacterial and antiparasitic action. Nowadays, natural products play a dominant role in the modern lifestyle based on fitomedicine. It is proved that systematical use of antioxidants both as dietary supplement and as ingredient to sunscreen lotion, may prevent from cellular high free radicals concentration and slow down progression of diseases related with oxidative stress.

W ostatnich latach znacząco wzrosło zainteresowanie naturalnymi związkami o działaniu antyoksydacyjnym. Uwagę naukowców skupiają związki polifenolowe, zdolne do neutralizacji reaktywnych form tlenu. Jednym z takich metabolitów wtórnych jest mangiferyna (ryc. 1), związek polifenolowy, zaliczany do grupy ksantonów. Podczas gdy występowanie ksantonów ogranicza się do kilku rodzin, występowanie mangiferyny jest znacznie szersze i obejmuje kilkanaście rodzin. Mangiferyna często występuje w towarzystwie homo- i izo-mangiferyny, metabolitów również działających antyoksydacyjne.

Ryc. 1. Struktura mangiferyny: (C-2 β-D-glukopyranozyl-1, 3, 6, 7-tetrahydroksyksanton).
Najwyższe stężenia mangiferyny odkryto w korze i liściach gatunków Mangifera indica L, Mangifera zeylanica, rodzina Anacardiaceae (1, 2), znaczne ilości mangiferyny występują również w gatunkach z rodzaju Cyclopia, rodzina Fabaceae (3). Często spotykana jest w rodzinie Gentianaceae, w rodzaju Swertia, Gentiana oraz w gatunkach Tripterospermum taiwanense, Canscora decussata, Fagraea blumei, Gentianopsis i Hoppea dichotoma (4-10).
Uznana również została za główny aktywny składnik kłącza Anemarrhena asphodeloides, rodzina Liliaceae (11). Mangiferyna często spotykana jest w rodzaju Hypericum L., rodz. Hypericaceae, gdzie została zidentyfikowana w 26 z 36 badanych gatunków (12). Kolejnym przedstawicielem rodz. Hypericaceae zawierającym mangiferynę jest Cratoxylum cochinchinense (13).
W rodzinie Melianthaceae, w rodzaju Bersama, obejmującym cztery gatunki, mangiferyna obecna jest w trzech: B. abissinica, B. engleriana i B. yangambiensis (14-16). Interesujęcym faktem jest obecność mangiferyny w dzikim gatunku kawy Coffea pseudozanguebarie, który jest jedynym gatunkiem z rodziny Rubiaceae zawierającym w swoim składzie ten związek (17).
Stwierdzono występowanie mangiferyny w gatunkach endemicznych, występujących w różnych rejonach świata; w Iris Nigricans (Iridaceae), występującym w Palestynie (18); w Hibiscus liliastrum (Malvaceae), endemicie występującym na Madagaskarze (19); w endemicznych gatunkach z rodzaju Polygala, np. Polygala hongkongensis Hemsl (Polygalaceae), występujących w Chinach (20).
Obecność mangiferyny odnotowano również w rodzinach: Thymelaeaceae w Gnidia involucrata (21), w Aphloiaceae, w Aphloia theiformis (22), w Bombacaceae, w Bombax ceiba L. (23), w Hippocrateaceae, w Salacia reticulata (24) i w Bignoniaceae, w rodzaju Arrabidaea (25).
Występowanie mangiferyny w gatunkach znacznie odległych od siebie taksonomicznie, wskazuje na fakt, że ten wtórny metabolit najprawdopodobniej pełni u roślin funkcję adaptacyjną do warunków środowiskowych (26-28). Doniesienia wskazują, że mangiferyna odpowiedzialna jest za ochronę gatunków przed różnymi formami statycznego i dynamicznego stresu, m.in. uodparnia roślinę na patogeny oraz chroni przed promieniowaniem UV (29, 30).
Właściwości chemiczne mangiferyny
Mangiferyna (ryc. 1), C19H18O11, C-2 β-D-glukopyranozyl-1,3,6,7-tetrahydroksyksan-ton, występuje w postaci C-glikozydu z glukozą w pozycji 2. Masa molowa tego związku wynosi 422,33 g/mol. W stanie stałym jest bezbarwnym amorficznym proszkiem.
Mangiferynę charakteryzują dwie funkcje jonizujące (pKa, 7,5 oraz 12,2), spektrum UV jest zależne od pH i przy pH 4 występują maksima: λmax 317 i 364 nm, a przy pH 9 – λmax 309 nm (31).
Toksyczność magniferyny wynosi: LD50 – 365 mg/kg (dootrzewnowo, na szczurach) (32).
Mangiferyna, uznawana za bardzo aktywny metabolit, wykazuje podobny do większości flawonoidów mechanizm działania oparty na zdolności ochrony komórki i jej makrocząsteczek przed stresem oksydacyjnym (9). Mangiferyna wykazuje również właściwości przeciwwirusowe, przeciwgrzybicze, przeciwbakteryjne oraz przeciwpasożytnicze. To wielorakie działanie może uzasadniać fakt, że surowce roślinne zawierające mangiferynę są stosowane od wieków w tradycyjnej medycynie ludowej w regionach tropikalnych (9, 33).
Mechanizm bioaktywności mangiferyny
Bioaktywność mangiferyny jest w znacznej mierze uzależniona od jej zdolności do zapewnienia ochrony komórek przed stresem oksydacyjnym. Zasugerowany przez Ghosal i Rao (34) mechanizm działania mangiferyny, opiera się na prawdopodobnej zdolności akceptorowej dla wolnych rodników (ang. radical captodative agent). Biologicznie aktywny antyoksydant obecny nawet w niskim stężeniu, znacząco opóźnia lub całkowicie zapobiega oksydacji istotnych biologicznie makrocząsteczek, takich jak DNA, czy lipidy błon komórkowych. Mangiferyna (1) (ryc. 2) wykazuje działanie antyoksydacyjne na wielu poziomach cyklu oksydacyjnego. W przypadku peroksydacji lipidów błon komórkowych:
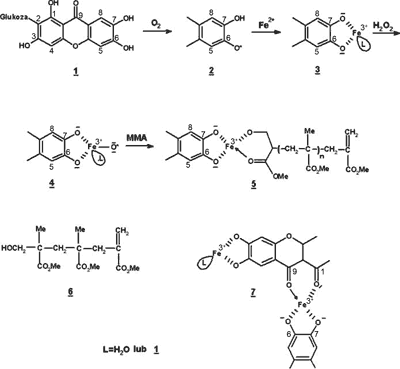
Ryc. 2. Mechanizm działania mangiferyny (34).
a) obniża stężenie nagromadzonego O2, generując rodniki fenoksylowe w obrębie pierścienia katecholowego (2) (ryc. 2);
b) wiąże jony metali (Fe2+/3+) formując z nimi kompleksy mangiferyna-żelazo, zwanymi także kompleksami metal-ligand (3) (ryc. 2), są one na tyle stabilne, że zapobiegają generacji wysoko szkodliwego dla tkanek rodnika ·OH oraz/lub grup oksy-żelazowych;
c) wpływa na rozpoczęcie łańcuchowej polimeryzacji poprzez interakcję z reaktywnymi formami tlenu (RTF), co prowadzi do utworzenia słabo-reaktywnego rodnika oksy-żelazowego „zamykającego” rodnik tlenowy (4) (ryc. 2). Rodnik oksy-żelazowy działa jako słaby induktor polimeryzacji monomeru winylowego metylometakrylanu (MMA). Tak wygenerowany kompleks rodnikowy zawiera polarną grupę kończącą (mangiferyna -Fe3+-O-) działającą jako terminator łańcuchowy przez oksydację drugiej grupy końcowej polimeru z rodnikiem węglowym, generując polimer o niskim ciężarze cząsteczkowym mangiferyna-Fe-PMMA (mangiferyna-Fe-polimetylometakrylan) (5) (ryc. 2);
d) zmiata lipidowe rodniki (peroksy/alkoksy), dzięki czemu zabezpiecza przed ciągłym uwalnianiem wodoru z lipidów komórkowych;
e) podtrzymuje komórkową równowagę oksydant – antyoksydant (via 1?2) (ryc. 2) (34).
W prawidłowo funkcjonującym organizmie występuje równowaga pomiędzy reakcjami redoks. Mangiferyna i jej stabilizowany rezonansem rodnik fenoksylowy (2) (ryc. 2), może wspomagać utrzymanie in vivo pożądanej równowagi oksydant ? antyoksydant poprzez reakcje zachodzące pomiędzy związkami 3 i 4 (ryc. 2). Warunkuje to formowanie się kompleksu mangiferyna-Fe-PMMA – polimer (5) (ryc. 2) (34). Ponadto, efektem aktywności mangiferyny są jej niskocząsteczkowe kompleksy, przedstawiane jako związki 6 i 7 (ryc. 2) (34).
Dodatkowo reakcje mangiferyny zbadano za pomocą pulsacyjnej radiolizy z różnymi rodnikami, zarówno utleniającymi, jak i redukującymi: •OH, N3• i CCl3O2•. Pod wpływem badanych rodników (ryc. 3), mangiferyna ulega przemianie do dwóch rodników fenoksylowych (odpowiednio λmax=390 oraz λmax=470 nm), podlegającym wzajemnym przemianom rodnik-rodnik. Drugi rodnik reaguje z askorbinatem, dzięki czemu dochodzi do regeneracji mangiferyny (31).
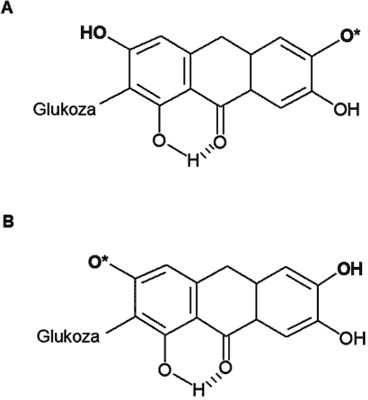
Ryc. 3. Rodniki fenoksylowe obserwowane po reakcji pomiędzy mangiferyną a N3•. Rodniki fenoksylowe: A – λmax=390 nm, B – λmax 470 nm (31).
Działanie antyoksydacyjne mangiferyny
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Yoshimi N, Matsunaga K, Katayama M i wsp. The inhibitory effects of mangiferin, a naturally occuring glucosylxanthone, in bowel carcinogenesis of male F344 rats. Cancer Lett 2001; 163:163-170. 2. Masibo M, He Q. Major mango polyphenols and their potential significance to human health. Compr Rev Food Sci Food Safety 2008; 7:309-19. 3. De Nysschen AM, Van Wyk BE, Van Heerden F i wsp. The major phenolic compounds in the leaves of Cyclopia species (Honeybush tea). Biochem Syst Ecol 1996; 24:243-6. 4. Struwe L, Albert V A. Gentianaceae: systematics and natural history. Cambridge University Press 2002; 652. 5. Šavikin-Fodulovic K, Bulatovic V. Xanthones from Swertia punctata. Phytochem 2002; 61(4):415-20. 6. Lin C, Chang C, Arisawa M i wsp. A xanthone glycoside from Tripterospermum taiwanense and rutin from Gentiana flavo-maculata. Phytochem 1982; 21(4):948-9. 7. Ghosal S, Chaudhuri RK. Chemical constituents of Gentianaceae XVI: Antitubercular activity of xanthones of Canscora decussata Schult. J Pharm Sci 1975; 64(5):888-9. 8. Cuendet M, Hostettmann K, Potterat O i wsp. Iridoid glucosides with free radical scavenging properties from Fagraea blumei. Helv Chim Acta 1997; 80(4):1144-52. 9. Massias M, Carbonnier J, Molho D. Chemotaxonomy of Gentianopsis: xanthones, C-glycosylflavonoids and carbohydrates. Biochem System Ecol 1982; 10(4):319-27. 10. Ghosal S, Jaiswal D K, Biswas K. New glycoxanthones and flavanone glycosides of Hoppea dichotoma. Phytochem 1978; 17(12):2119-23. 11. Wang J, Lou Z, Zhu Z i wsp. A rapid high-performance liquid chromatographic method for quantitative analysis of antidiabetic-active components in Anemarrhena asphodeloides rhizomes. Chromatogr 2005; 61(11-12):633-6. 12. Kitanov G M, Nedialkov PT. Mangiferin and isomangiferin in some Hypericum species. Biochem System Ecol 1998; 26:647-53. 13. Bennett GJ, Lee H-H. Xanthones from Guttiferae. Phytochem 1989; 28(4):967-98. 14. Vanhaelen M, Indeherberg J, Bauduin J. Further chemical and pharmacological characterisation of Bersama yangambiensis Toussaint (Melianthaceae). J Pharm Sci 1971; 61:1165-7. 15. Ian HB, Betty PJ, Hemaia MIM. An investigation of the stem bark of Bersama abyssinica. Planta Med 1985; 51:483-7. 16. Djemgou PC, Hussien TA, Hegazy M-E F i wsp. C-Glucoside xanthone from the stem bark extract of Bersama engleriana. Pharmacogn Res 2010; 2(4):229-32. 17. Talamond P, Mondolot L, Gargadennec A i wsp. First report on mangiferin (C-glucosyl-xanthone) isolated from leaves of a wild coffee plant, Coffea pseudozanguebariae (Rubiaceae). Acta Bot Gallica 2008; 155(4):513-9. 18. Al-Khalil S, Tosa H, Iinuma M. A xanthone C-glycoside from Iris nigricans. Phytochem 1995; 38(3):729-31. 19. Cafferty S, Greenham J, Williams CA. Isolation of mangiferin and iso-mangiferin from leaf material of Hibiscus liliastrum (Malvaceae). Biochem System Ecol 1996; 24(2):173-4. 20. Wu JF, Chen SB, Gao JC i wsp. Xanthone glycosides from herbs of Polygala hongkongensis Hemsl and their antioxidant activities. J Asian Natur Prod Res 2008; 10(7):665-70. 21. Ferrari J, Terreaux C, Sahpaz S i wsp. Benzophenone glycosides from Gnidia involucrata. Phytochem 2000; 54:883-9. 22. Danthu P, Lubrano C, Flavet L i wsp. Biological factors influencing production of xanthones in Aphloia theiformis. Chem Biodivers 2010; 7:140-50. 23. Dar A, Faizi S, Naqvi S i wsp. Analgesic and antioxidant activity of mangiferin and its derivatives: The structure activity relationship. Biol Pharm Bull 2005; 28(4):596-600. 24. Karunanayake EH, Sirimanne SR. Mangiferin from the root bark of Salacia reticulata. J Ethnopharmacol 1985; 13(2):227-8. 25. Mendonça Pauletti P, Castro-Gamboa I, Siqueira Silva DH i wsp. New antioxidant C-glucosylxanthones from the stems of Arrabidaea samydoides. J Nat Prod 2003; 66(10):1384-7. 26. Hostettmann K, Wagner H. Xanthone glycosides. Phytochem 1977; 16:821-9. 27. Richardson PM. The taxonomic significance of C-glycosylxanthones in flowering plants. Biochem System Ecol 1983; 11:371-5. 28. Richardson PM. The taxonomic significance of xanthones in ferns. Biochem System Ecol 1984; 12:1-6. 29. Danthu P, Lubrano C, Flavet L i wsp. Biological factors influencing production of xanthones in Aphloia theiformis. Chem Biodivers 2010; 7:140-50. 30. Ghosal S, Chakrabarti DK, Kumar Y. Toxic substances produced by Fusarium concerning malformation disease of mango. Experientia 1979; 35:1633-4. 31. Mishra B, Indira Priyadarsini K, Sudheerkumar M i wsp. Pulse radiolysis studies of mangiferin: A C-glycosyl xanthone isolated from Mangifera indica. Radiat Phys Chem 2006; 75:70-77. 32. Bhattacharya SK, Ghosal S, Chaudhuri RK i wsp. Canscora decussata (Gentianaceae) xanthones III: Pharmacological studies. J Pharm Sci 1972; 61:1838-40. 33. Wauthoz N, Balde A, Balde ES i wsp. Ethnopharmacology of Mangifera indica L. bark and pharmacological studies of its main C-glucosylxanthone, mangiferin. Int J Biomed Pharm Sci 2007; 1: 112-9. 34. Ghosal S, Rao G. A plausible chemical mechanism of the bioactivities of mangiferin. Indian J Chem 1996; 35B:561-6. 35. Sanchez GM, Re L, Giuliani A i wsp. Protective effects of Mangifera indica L. extract, mangiferin and selected antioxidants against TPA-induced biomolecules oxidation and peritoneal macrophage activation in mice. Pharmacol Res 2000; 42:565-73. 36. Muruganandan S, Gupta S, Kataria M i wsp. Mangiferin protects the streptozotocin-induced oxidative damage to cardiac and renal tissues in rats. Toxicol 2002; 176(3):165-74. 37. Darley-Usmar V, Wiseman H, Halliwell B. Nitric oxide and oxygen radicals: a question of balance. FEBS Lett 1995; 369:131-5. 38. García D, Delgado R, Ubeira FM i wsp. Modulation of rat macrophage function by the Mangifera indica L. extracts Vimang and mangiferin. Int Immunopharmacol 2002; 2:797-806. 39. Leiro JM, Alvarez E, Arranz JA i wsp. In vitro effects of mangiferin on superoxide concentrations and expression of the inducible nitric oxide synthase, tumor necrosis factor-α and transforming growth factor-β genes. Biochem Pharmacol 2003; 65:1361-71. 40. Forman HJ, Torres M. Redox signaling in macrophages. Mol Aspects Med 2001; 22:189-216. 41. Halliwell B, Gutteridge JM. Oxygen free radicals and iron in relation to biology and medicine: some problems and concepts. Arch Biochem Biophys 1986; 246(2):501-14. 42. Gottlieb M, Leal-Campanario R, Campos-Esparza MR. Neuroprotection by two polyphenols following excitotoxicity and experimental ischemia. Neurobiol Dis 2006; 23(2):374-86. 43. Atlante A, Calissano P, Bobba A i wsp. Glutamate neurotoxicity, oxidative stress and mitochondria. FEBS Lett 2001; 497:1-5. 44. Rajendran P, Ekambaram G, Sakthisekaran D. Cytoprotective effect of mangiferin on benzo(a)pyrene-induced lung carcinogenesis in swiss albino mice. Basic Clin Pharmacol Toxicol 2008; 103(2):137-42. 45. Nathan C, Xie QW. Nitric oxide synthase: roles, tolls and control. Cell 1994; 78:915-8. 46. Vodovotz Y, Bogdan C, Paik J i wsp. Mechanisms of suppression of macrophage nitric oxide release by transforming growth factor beta. J Exp Med 1993; 178:605-13. 47. Markowitz SD, Roberts AB. Tumor suppressor activity of the TGF-beta pathway in human cancers. Cytokine Growth Factor Rev. 1996; 7:93-102. 48. McCaffrey TA, Du B, Consigli S i wsp. Genomic instability in the type II TGF-beta1 receptor gene in atherosclerotic and restenotic vascular cells. J Clin Invest 1997; 100:2182-8. 49. Mandriota SJ, Menoud PA, Peppers MS. Transforming growth factor β1 down-regulates vascular endothelial growth factor receptor 2/flk-1 expression in vascular endothelial cells. J Biol Chem 1996; 271:11500-5. 50. Andreu G, Delgado R, Velho J i wsp. Iron complexing activity of mangiferin, a naturally occurring glucosylxanthone, inhibits mitochondrial lipid peroxidation induced by Fe2+-citrate. Eur J Pharmacol 2005a; 513:47-55. 51. Andreu G, Delgado R, Velho J, i wsp. Mangiferin, a natural occurring glucosyl xanthone, increases susceptibility of rat liver mitochondria to calcium-induced permeability transition. Arch Biochem Biophys 2005; 439:184-93. 52. Nunez Selles AJ, Vilez Castro HT, Agóero-Agóero J i wsp. Isolation and quantitative analysis of phenolic antioxidants, free sugars, and polyols from Mango (Mangifera indica L.) stem bark aqueous decoction used in Cuba as a nutritional supplement. J Agric Food Chem 2002; 50:762-6. 53. Jagetia GC, Baliga MS. Radioprotection by mangiferin in DBAxC57BL mice: a preliminary study. Phytomed 2005; 12:209-15. 54. Menkovic N, Juranic Z, Stanojkovic T i wsp. Radioprotective activity of Gentiana lutea extract and mangiferin. Phytother Res 2010; 24(11):1693-6. 55. Lipinski CA, Lombardo F, Dominy BW i wsp. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development setting (review). Adv Drug Deliv Rev 1997; 23:3-25. 56. Rivera DG, Balmaseda IH, Leon AA. Anti-allergic properties of Mangifera indica L. extract (Vimang) and contribution of its glucosylxanthone mangiferin. J Pharm Pharmacol 2006; 58:385-92. 57. Li H, Wu YH, Zhou PL i wsp. A review on pharmacological effects of mangiferin. J Northwest Forestry Univ 2004; 19(4):146-9. 58. Beltran AE, Alvarez Y, Xavier FE i wsp. Vascular effects of the Mangifera indica L. extract (Vimang®). Europ J Pharmacol 2004; 499:297-305. 59. Saxena A, Vikram NK. Role of selected Indian plants in management of type 2 diabetes: a review. J Altern Complement Med 2004; 10:369-78. 60. Yoshikawa M, Nishida N, Shimoda H i wsp. Polyphenol constituents from Salacia species: quantitative analysis of mangiferin with glucosidase and aldose reductase inhibitory activities. Yakugaku Zasshi 2001; 121:371-8. 61. Muruganandan S, Srinivasan K, Gupta S i wsp. Effect of mangiferin on hyperglycemia and atherogenicity in streptozotocin diabetic rats. J Ethnopharmacol 2005; 97(3):497-500. 62. Li H, Miyahara T, Tezuka Y i wsp. The effect of kampo formulae on bone resorption in vitro and in vivo. Active constituents of Tsu-Kan-gan. Biol Pharm Bull 1998; 21:1322-6. 63. Qin L, Han T, Zhang Q i wsp. Antiosteoporotic chemical constituents from Er-Xian decoction, a traditional Chinese herbal formula. J Ethnopharmacol 2008; 118:271-9. 64. Bhattacharya SK, Sanyal AK, Ghosal S. Monoamine oxidase-inhibiting activity of mangiferin isolated from canscora decussate. Naturissensch 1972; 59:651-2. 65. Martinez G, Candelario E, Giuliani A i wsp. Mangifera indica L. extract (Qf808) reduces ischaemia-induced neuronal loss and oxidative damage in the gerbil brain. Free Radic Res 2001; 35:465-73.



