© Borgis - Postępy Nauk Medycznych 10/2012, s. 777-786
*Beata Bergler-Czop, Ligia Brzezińska-Wcisło
Skórno-śluzówkowe objawy uboczne retinoidów doustnych w terapii trądziku pospolitego
Skin-mucous side effects of the retinoids in the therapy of acne vulgaris
Katedra i Klinika Dermatologii Śląskiego Uniwersytetu Medycznego w Katowicach
Kierownik Katedry i Kliniki: prof. dr hab. med. Ligia Brzezińska-Wcisło
Streszczenie
Wstęp. Trądzik pospolity jest najczęściej diagnozowaną dermatozą u chorych pomiędzy 11. a 30. rokiem życia. Uważa się, że dotyczy on około 80% osób w tej grupie wiekowej lub nawet, uwzględniając ogniska mało nasilone, 100% młodych ludzi.
Cel, materiał, metody. Celem pracy była ocena zmian parametrów skóry: wilgotności, przeznaskórkowego parowania wody (TEWL) oraz innych skórno-śluzówkowych objawów ubocznych podczas terapii doustną izotretinoiną. Badania przeprowadzono wśród 155 chorych leczonych z powodu różnych postaci klinicznych trądziku preparatem izotretinoiny doustnej w Klinice Dermatologii Śląskiego Uniwersytetu Medycznego w Katowicach w latach 2009-2011 – I grupa oraz wśród pacjentów, którzy w okresie pomiędzy 2-5 lat wcześniej leczeni byli izotretinoiną doustną – II grupa, a także u 40-osobowej zdrowej grupy kontrolnej.
Wyniki, wnioski. Na podstawie przeprowadzonych analiz wywnioskowano, że nowy schemat terapii, który jest najkorzystniejszą formą dawkowania izotretinoiny, polega na stosowaniu stałej dawki leku 0,4-1,0 mg/kg mc./dobę bez modyfikacji w trakcie leczenia. Efekty takiego modelu leczenia są najlepsze, terapia najkrótsza, a objawy skórno-śluzówkowe podobne, a nawet mniej nasilone niż przy innych ocenianych schematach podawania retinoidu.
Summary
Introduction. Acne vulgaris is one of the most commonly diagnosed dermatosis in patients aged 11-30 years. It is believed to be found in about 80% of patients in this age group but if considering forms of mild intensity, even 100% of adolescents may be affected.
Aim, materials, methods. The aim of this work was to access the skin parameters such as: moisturisation, transepidermal water loss (TEWL) and others skin-mucous side effects during oral treatment with isotretinoin. The tests were performed in 155 patients treated for different clinical forms of acne with an oral isotretinoin preparation in the Dermatology Clinic of the Medical University of Silesia in Katowice in 2009-2011 – I group and the patients treated with oral isotretinoin 2 and 5 years ago – II group. The control group consisted of 40 healthy individuals.
Results, conclusions. On the basis of performed analyses it was concluded that the new therapy schema is the most advantageous form of isotretinoin dosing and it involves the use of a constant drug dose – 0.4-1.0 mg/kg b.m./day without modification during treatment. The effects of such a model of treatment are most efficient, the treatment shortest and the mucosa-skin symptoms are similar, even less pronounced than for other schema of retinoid dosing.

Wstęp
Trądzik pospolity jest najczęściej diagnozowaną dermatozą u chorych pomiędzy 11. a 30. rokiem życia. Uważa się, że dotyczy on około 80% osób w tej grupie wiekowej lub nawet, uwzględniając ogniska mało nasilone, 100% młodych ludzi. Zmiany, które zazwyczaj pojawiają się w drugiej dekadzie życia, z czasem są coraz mniej nasilone i ustępują pod koniec tej dekady lub na początku trzeciej. Zmiany w 95% są umiejscowione na twarzy i w górnych okolicach tułowia, sporadycznie w innych partiach ciała. Ze względu na tą lokalizację oraz przewlekły charakter schorzenia niejednokrotnie stanowi ono poważny problem psychologiczny dla pacjenta (1, 2).
Grupa retinoidów obejmuje witaminę A i wszystkie jej pochodne (3). Działanie pochodnych witaminy A na proliferację keratynocyów po raz pierwszy zauważono w roku 1949. W terapii miejscowej roztwór tretinoiny po raz pierwszy zastosowano w 1971 roku. Od tego czasu wprowadzono wiele modyfikacji, które poprawiły tolerancję tej terapii (4).
Konsensus z 2009 roku, dotyczący leczenia trądziku zmienił znacznie podejście do terapii pochodnymi witaminy A: we wszystkich postaciach trądziku (z wyjątkiem kobiet w ciąży) terapia skojarzona, oparta o retinoidy miejscowe lub ogólne (trądzik skupiony) jest leczeniem pierwszego rzutu (5) (ryc. 1).

Ryc. 1. Budowa chemiczna izotretinoiny (źródło: http://pubchem.ncbi.nlm.nih.gov).
Pochodne witaminy A w trądziku stosujemy zależnie od wskazań w terapii miejscowej i ogólnej.
Wskazaniem do ogólnego podawania retinoidów są ciężkie postacie trądziku, takie jak: skupiony, odwrócony, piorunujący, nasilony grudkowo-krostkowy (6). Obecnie wskazania rozszerza się jednak do wszystkich postaci trądziku, które nie reagują na inne formy terapii, a stanowią problem psychologiczny dla pacjenta (5-7).
Zalecanym lekiem jest izotretinoina, która chemicznie stanowi syntetyczny stereoizomer kwasu all-trans retinowego (kwas 13-cis retinowy) (6). Jej poprzednikiem była tretinoina, charakteryzująca się mniejszą skutecznością i częściej występującymi objawami niepożądanymi. Obecnie uważamy, że izotretinoina jest prolekiem, a aktywnym metabolitem wewnątrzkomórkowym jest tretinoina (8). Objawy uboczne izotretinoiny podzielono na kilka grup:
1. Bardzo częste objawy uboczne (> 1/10): skóra i tkanka podskórna: zapalenie czerwieni wargowej, suchość skóry, złuszczanie, świąd, rumień, urażalność, cechy przypominające wyprysk dłoni, wątroba i drogi żółciowe: wzrost poziomu transaminaz, mięśnie i stawy: bóle mięśni, stawów, zmniejszona tolerancja wysiłku, gospodarka tłuszczowa: wzrost poziomu trójglicerydów, zmniejszenie stężenia lipoprotein o dużej gęstości, narząd wzroku: zapalenie powiek, spojówek, suchość oka, podrażnienie, układ krwiotwórczy i układ chłonny: niedokrwistość, przyspieszone OB, małopłytkowość, nadpłytkowość.
2. Częste objawy uboczne (> 1/100): układ krwiotwórczy i układ chłonny: neutropenia, układ nerwowy: bóle głowy, układ oddechowy: krwawienia z nosa, suchość śluzówek nosa, gospodarka lipidowa: wzrost stężenia cholestrolu, glukozy we krwi, krwiomocz, białkomocz.
3. Rzadkie objawy uboczne > 1/10 000: układ immunologiczny: alergiczne zmiany skórne, reakcje anafilaktyczne, zaburzenia psychiczne: depresja, lęk, skłonność do agresji, zmiany nastroju, skóra i tkanka podskórna: łysienie.
4. Bardzo rzadkie objawy uboczne < 1/10 000: zakażenia: zakażenia skóry i błon śluzowych bakteriami Gramm +, krew i układ chłonny: limfoadenopatia, metabolizm: cukrzyca, hyperurykemia, zaburzenia psychiczne: zaburzenia zachowania, myśli samobójcze, układ nerwowy: łagodne nadciśnienie śródczaszkowe (pseudotumor cerebri), senność, drgawki, narząd wzroku: nieostre widzenie, zaćma, zaburzenie widzenia barw, zła tolerancja szkieł kontaktowych, pogorszenia widzenia w ciemności, zapalenie rogówki, światłowstręt, słuch i błędnik: upośledzenie słuchu, naczynia krwionośne: alergiczne zapalenie naczyń, Ziarniniak Wegenera, układ oddechowy: skurcz oskrzeli, chrypka, układ pokarmowy: zapalenie jelit, krwawienia z przewodu pokarmowego, biegunka, nudności, zapalenie trzustki, wątroba: zapalenie wątroby, skóra i tkanka podskórna: trądzik piorunujący, zaostrzenie objawów trądziku, hirsutyzm, dystrofia paznokci, zanokcica, przebarwienia, nadpotliwość, nadwrażliwość na światło, mięśnie i stawy: zapalenie mięśni, stawów, przedwczesne kostnienie przynasad kości, zapalenie ścięgien, wzrost stężenia fosfokinazy kreatynowej we krwi (9-14).
Cel pracy, materiał, metody
Celem pracy była ocena zmian parametrów skóry: wilgotności, przeznaskórkowego parowania wody (TEWL), a także częstości występowania subiektywnych objawów skórno-śluzówkowych odczuwanych przez chorych podczas terapii doustną izotretinoiną.
Badania przeprowadzono wśród 155 chorych leczonych z powodu różnych postaci klinicznych trądziku preparatem izotretinoiny doustnej w Klinice Dermatologii Śląskiego Uniwersytetu Medycznego w Katowicach w latach 2009-2011 – I grupa oraz wśród pacjentów, którzy w okresie pomiędzy 2 i 5 lat wcześniej leczeni byli izotretinoiną doustną – II grupa, a także u 40-osobowej zdrowej grupy kontrolnej (ryc. 2).
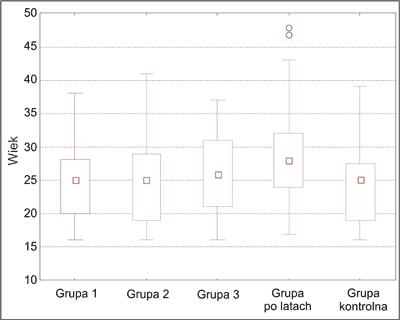
Ryc. 2. Rozkład wieku w grupach badanych i w grupie kontrolnej.
Wszystkich pacjentów grupy I podzielono na 3 podgrupy:
1. grupa, w której stosowano stałą dawkę izotretinoiny pomiędzy 0,2-0,4 mg/kg m.c./dobę
2. grupa, w której stosowano stałą dawkę izotretinoiny > 0,4-1,0 mg/kg m.c.
3. grupa, w której stosowano wyjściowo dawki wyższe > 0,4-1,0 mg/kg m.c./dobę, a następnie stopniowo dawkę redukowano do 0,2-0,4 mg/kg m.c./dobę.
Grupę kontrolną stanowiło 40 zdrowych osób (20 kobiet i 20 mężczyzn) – bez schorzeń towarzyszących, nie pobierających żadnych leków ogólnych (w tym środków antykoncepcyjnych) i nie stosujących leków miejscowych przez okres 3 miesięcy przed badaniem.
W czasie wizyty kwalifikacyjnej (-1) zbierano wywiad dotyczący przebiegu choroby i dotychczasowego leczenia oraz wykonywano badanie fizykalne. Nasilenie trądziku oceniane było skalą „FDA global grade” ilościową. Ocena wykonywana była cały czas przez tego samego lekarza. Ocenie punktowej poddawano zmiany na twarzy.
W trakcie wizyty „0” u pacjentów zakwalifikowanych do leczenia, wykonywano badanie kliniczne, ustalano dawkę początkową leku (w mg/kg m.c./dobę). U kobiet wykonywano test ciążowy. Lek włączono po miesiącu stosowania antykoncepcji. Pacjenci pouczani byli o zasadach standardowej pielęgnacji emolientami.
Przy pomocy aparatu diagnostycznego MPA 5 z sensorem warunków zewnętrznych (urządzenie medyczne – deklaracja zgodności EC 93/42/EEC) zawierającego: Tewameter TM300 i Corneometer CM825 przeprowadzano ocenę parametrów skóry: wilgotności i przeznaskórkowego parowania wody.
W trakcie wizyty „1” po 3 miesiącach leczenia oraz w trakcie wizyty „2” po 6 miesiącach terapii, u pacjentów leczonych, wykonywano badanie kliniczne, obliczano dawkę sumaryczną przyjętego leku (w mg/kg m.c.), zbierano wywiad w kierunku objawów ubocznych (w skali 4-punktowej dla każdego objawu 0 – brak, 1 – łagodny, 2 – średni, 3 – nasilony) (suchość i pieczenie czerwieni wargowej, suchość skóry, suchość oka, suchość błon śluzowych, świąd, zaczerwienie skóry, złuszczanie skóry). Przy pomocy aparatu diagnostycznego MPA 5 przeprowadzano ocenę jw.
W grupie II (2-5 lat po leczeniu izotretinoiną) oraz w grupie kontrolnej wykonano badania parametrów skóry (wilgotność, TEWL).
Na przeprowadzenie badań uzyskano zgodę Komisji Bioetycznej Śląskiego Uniwersytetu Medycznego – uchwała nr KNW/0022/KB1/179/I/10.
Wyniki
Objawy uboczne – skórno-śluzówkowe
Zapalenie czerwieni wargowej
Zapalenie czerwieni wargowej obserwowano z różnym nasileniem u 98,53% pacjentów po 3 i po 6 miesiącach terapii izotretinoiną (ryc. 3, 4).
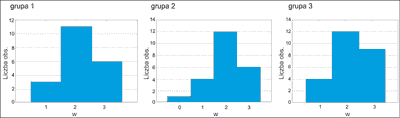
Ryc. 3. Średnie nasilenie cheilitis w grupach badanych po 3 miesiącach.
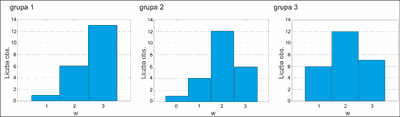
Ryc. 4. Średnie nasilenie cheilitis w grupach badanych po 6 miesiącach.
Porównując wykresy ze sobą widać, że na wizycie po 3 miesiącach nasilenie zapalenia czerwieni wargowej w grupach jest porównywalne, natomiast po 6 miesiącach grupa 1 różni się od pozostałych – nasilenie objawu jest tu znamiennie większe.
Suchość skóry
Uczucie suchości skóry stwierdzono u 100,0% pacjentów w trakcie leczenia.
Z wykresów wynika, że grupa 2 i grupa 3 są do siebie podobne. Różnice wydają się wystarczające, aby pomimo pozytywnego wyniku testu stwierdzić, że istnieje wyraźna różnica w rozkładzie pomiędzy grupą 1, a pozostałymi. Test wydaje się potwierdzać jedynie twierdzenie, że średnie nasilenie suchości skóry w okresie „1” w każdej z grup jest zbliżone. W okresie „2” w grupie 1 widać znaczną różnicę w ilości osób o nasileniu objawów „3” w stosunku do pozostałych grup. Wnioskujemy, że grupa 1 różni się od pozostałych (ryc. 5, 6).
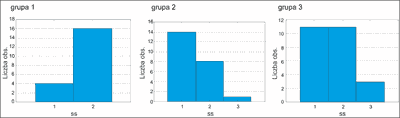
Ryc. 5. Średnie nasilenie suchości skóry w grupach badanych po 3 miesiącach.
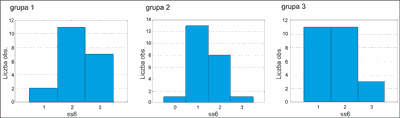
Ryc. 6. Średnie nasilenie suchości skóry w grupach badanych po 6 miesiącach.
Objawy suchości spojówek
Suchość spojówek oczu obserwowano u około 50% chorych, zarówno w 3 jak i w 6 miesiącu terapii. W obu okresach nasilenie objawu nie zależało od modelu terapii (ryc. 7).
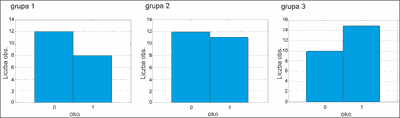
Ryc. 7. Średnie nasilenie suchości spojówek w grupach badanych po 3 miesiącach.
Objawy suchości błon śluzowych
Ww. objawy w trakcie terapii obserwowano u 70,59% badanych pacjentów.
Nasilenie suchości błon śluzowych zostało ponownie zbadane po 6 miesiącach od rozpoczęcia terapii („2”). Nie stwierdzono żadnej różnicy w stosunku do poprzedniego okresu badań. Stwierdzamy, że we wszystkich grupach nasilenie objawów jest takie samo (ryc. 8).
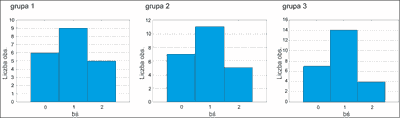
Ryc. 8. Średnie nasilenie suchości błon śluzowych w grupach badanych po 3 miesiącach.
Świąd skóry
Na świąd w czasie leczenia retinoidem doustnym skarżyło się 67,65% pacjentów.
Rozkład w grupach 2 i 3 różni się istotnie od rozkładu w grupie 1. Analiza w czasie wykazała, że objawy nie nasiliły się w „2” okresie w żadnej z grup (ryc. 9).
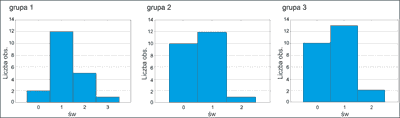
Ryc. 9. Średnie nasilenie świądu w grupach badanych po 3 miesiącach.
Nadmierne złuszczanie
Objawy nadmiernego złuszczania skóry obserwowano u około 50% pacjentów leczonych izotretinoiną. Między grupami w obu okresach badań nie było statystycznie istotnej różnicy (ryc. 10).
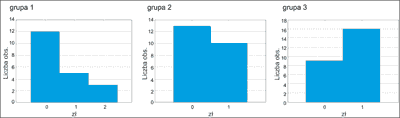
Ryc. 10. Średnie nasilenie złuszczania w grupach badanych po 3 miesiącach.
Wilgotność skóry
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Koo JY, Smith LL: Psychologic aspects of acne. Pedatr Dermatol 1991; 8: 185-188.
2. Braun-Falco O, Plewig G, Wolff HH et al.: Acne. [In:] Braun-Falco O, Plewig G, Wolff HH et al., editors. Dermatology. Berlin-Heidelberg-New York: Springer-Verlag 2000; 1051-1080.
3. Terhorst D, Kalali BN, Ollert M et al.: The role of toll-like receptors in host defenses and their relevance to dermatologic diseases. Am J Clin Dermatol 2010; 11: 1-10.
4. Geria AN, Lawson CN, Halder RM: Topical retinoids for pigmented skin. J Drugs Dermatol 2011; 10: 483-489.
5. Thiboutot D, Gollnick H: Nowe spojrzenie na postępowanie w trądziku: aktualizacja zaleceń Światowej Grupy Ekspertów na Rzecz Poprawy Wyników Leczenia Trądziku. Dermatol Kosmetol 2009; 9: 4-52.
6. Bergler-Czop B, Brzezińska-Wcisło L: Metody leczenia różnych postaci trądziku w Klinice Dermatologii ŚlAM w latach 1991-2000. Wiad Lek 2005; 3-4: 156-160.
7. Rigopoulos D, Larios G, Katsambas AD: The role of isotretinoin in acne therapy: why not as first-line therapy? Facts and controversies. Clin Dermatol 2010; 28: 24-30.
8. Beach RA, McQueen M, Wismer J: Novel management of isotretinoin-induced hypertriglyceridemia in an adolescent with severe acne. Clin Pediatr (Phila) 2009; 48: 551-554.
9. Thakrar BT, Robinson NJ: Isotretinoin use and the risk of inflammatory bowel disease. Am J Gastroenterol 2011; 106: 1000-1003.
10. Addor FA, Schalka S: Acne in adult women: epidemiological, diagnostic and therapeutic aspects. An Bras Dermatol 2010; 85: 789-795.
11. Grow D: Isotretinoin and intestinal damage. Prescrire Int 2008; 17: 154-156.
12. Shale M, Kaplan GG, Panaccione R et al.: Isotretinoin and intestinal inflammation: what gastroenterologists need to know. Gut 2009; 58: 737-741.
13. Poradnik przepisywania i wydawania leku Aknenormin. Broszura informacyjna dla lekarzy. Boots Healthcare Sp. z o.o. 2007.
14. Żaba R: Etiopatogeneza i leczenie trądzika pospolitego. Post Dermatol i Alergol 2001; 2: 130-140.
15. Preston IR, Tang G, Tilan JU et al.: Retinoids and pulmonary hypertension. Circulation 2005; 111: 782-90.
16. Kubba R, Bajaj AK, Thappa DM et al.: Indian Acne Alliance (IAA). Acne in India: guidelines for management – IAA consensus document. Indian J Dermatol Venereol Leprol 2009; 75: 1-62.
17. Sardana K, Gang VK, Sehgal VN et al.: Efficacy of fixed low-dose isotretinoin (20 mg, alternate days) with topical clindamycin gel in moderately severe acne vulgaris. J Eur Acad Dermatol Venereol 2009; 23: 556-560.
18. Gollnick H, Cunliffe W, Berson D: Management of acne: report from global alliance to improve outcomes in acne. J Am Acad Dermatol 2003; 49: 371-373.
19. Akman A, Durusoy C, Senturk M et al.: Treatment of acne with intermittent and conventional isotretinoin: a randomized, controlled multicenter study. Arch Dermatol Res 2007; 21: 789-794.
20. Brito Mde F, Sant’anna IP, Galindo JC et al.: Evaluation of clinical adverse effects and laboratory alterations in patients with acne vulgaris treated with oral isotretinoin. An Bras Dermatol 2010; 85: 331-337.
21. Cumurcu T, Sezer E, Kilic R et al: Comparison of dose-related ocular side effects during systemic isotretinoin administration. Eur J Ophtalmol 2009; 19: 196-200.
22. Karazeli A, Borazan M, Altinors DD et al.: Conjunctival impression cytology, ocular surface, and tear – film changes in patients treated with systemic isotretinoin. Cornea 2009; 28: 45-60.
23. Rosen E, Raz J, Segev F: Giant cobblestone-like papillae during isotretinoin therapy. Ocul Immunol Inflamm 2009; 17: 312-313.
24. Mollan SP, Woodcock M, Siddiqi R et al.: Does use of isotretinoin rule out a career in flying? Br J Ophthalmol 2006; 90: 957-959.
25. Burkhart CG: Another threat to the availability of isotretinoin: ocular side effects have aviation authorities considering restricting use from (even potential) pilots. Dermatol Online J 2008; 15: 14.
26. Herane MI, Fuenzalida H, Zegpi E et al.: Specific gel-cream as adjuvant to oral isotretinoin improved hydration and prevented TEWL increase-a double-blind, randomized, placebo-controlled study. J Cosmet Dermatol 2009; 8: 181-185.
27. Sefton J, Kligman AM, Kopper SC: Photodamage pilot study: a double-blind, vehicle-controlled study to assess the efficacy and safety of tazarotene 0.1% gel. J Am Acad Dermatol 2000; 43: 656-663.
28. Lupi-Pégurier L, Muller-Bolla M, Fontas E et al.: Reduced salivary flow induced by systemic isotretinoin may lead to dental decay. A prospective clinical study. Dermatology 2007; 214: 221-226.
29. Gorpelioglu C, Ozol D, Sarifakioglu E: Influence of isotretinoin on nasal mucociliary clearance and lung function in patients with acne vulgaris. Int J Dermatol 2010; 49: 87-90.
30. Kus S, Gün D, Demirçay Z, Sur H: Vitamin E does not reduce the side-effects of isotretinoin in the treatment of acne vulgaris. Int J Dermatol 2005; 44: 248-251.










