© Borgis - Postępy Nauk Medycznych 11/2012, s. 866-871
*Izabella Czajka-Oraniec, Wojciech Zgliczyński
Akromegalia a układ sercowo-naczyniowy
Acromegaly and cardiovascular diseases
Klinika Endokrynologii Centrum Medycznego Kształcenia Podyplomowego, Warszawa
Kierownik Kliniki: prof. dr hab. med. Wojciech Zgliczyński
Streszczenie
Akromegalia jest poważną, przewlekłą chorobą endokrynologiczną, wywołaną nadprodukcją hormonu wzrostu (GH), która istotnie zmienia wygląd chorych, ale przede wszystkim prowadzi do licznych powikłań narządowych. Postępy w leczeniu chirurgicznym i farmakologicznym akromegalii doprowadziły do tego, że udaje się wyleczyć lub skutecznie kontrolować chorobę u większości pacjentów. Pomimo tego śmiertelność, w szczególności z powodu chorób sercowo-naczyniowych jest wciąż istotnie zwiększona w porównaniu do ogólnej populacji. Wynika to w dużej mierze z opóźnień w rozpoznawaniu choroby, przez co chorzy są przez wiele lat narażeni na oddziaływanie wysokich stężeń GH i IGF-1. Najczęstszym powikłaniem ze strony układu krążenia jest rozwój specyficznej kardiomiopatii akromegalicznej z przerostem mięśnia obu komór serca i upośledzeniem funkcji rozkurczowej, a następnie skurczowej w trakcie wysiłku, a w końcowej fazie prowadzącej do zastoinowej niewydolności serca. Z czasem dołączają się też dodatkowe powikłania, takie jak zaburzenia rytmu serca, wady zastawkowe i choroba naczyń wieńcowych. Poza tym akromegalia zwiększa częstość występowania ważnych czynników ryzyka chorób sercowo-naczyniowych: nadciśnienia tętniczego, zaburzeń gospodarki węglowodanowej, dyslipidemii. Obserwuje się również dysfunkcję śródbłonka i wcześniejszy rozwój zmian miażdżycowych. Ponieważ skuteczne leczenie może zahamować lub nawet cofnąć rozwój wielu z wymienionych powikłań, należy dążyć do jak najwcześniejszego rozpoznawania choroby i wdrażania odpowiedniego leczenia. Każdy pacjent z rozpoznaną akromegalią powinien być objęty skryningiem w kierunku obecności powikłań ze strony układu krążenia, a w przypadku ich obecności odpowiednim leczeniem.
Summary
Acromegaly is a severe chronic endocrine disease, caused by growth hormone (GH) overproduction. It leads to disfiguring changes in patient’s appearance and, what is even more important, to numerous systemic complications. Nowadays, acromegaly could be completely cured or successfully controlled in most patients thanks to important advances in surgical and pharmacological treatment of the disease. Despite that mortality rate, especially due to cardiovascular diseases is still significantly higher than in general population. Late diagnosis is the main reason of the increased mortality as it represents a prolonged exposition to high concentrations of GH and insulin-like growth factor 1 (IGF-1). Acromegalic cardiomyopathy is the most frequent cardiovascular complication. That is a specific biventricular hypertrophy with diastolic dysfunction, impaired systolic performance during exercise and finally leading to congestive heart failure. Concurrently other complications arise, such as arrhytmias, valvular and coronal disease. Additionally acromegalics have an increased prevalence of some important cardiovascular risk factors such as hypertension, impaired glucose metabolism and dyslipidemia. Endothelial dysfunction and premature atherosclerosis were also reported. Effective treatment could stop or even reverse many of cardiovascular complications, so it is recommended to treat patients possibly early and to control the disease well. Each patient with acromegaly should undergo cardiovascular screening and proper treatment if required.

WSTĘP
Akromegalia jest przewlekłą chorobą wywołaną nadmierną produkcją hormonu wzrostu (GH), najczęściej przez gruczolaka przysadki (> 98% przypadków), która prowadzi wtórnie do nadprodukcji czynników wzrostowych, takich jak insulinopodobny czynnik wzrostowy 1 (IGF-1). Częstość występowania akromegalii szacuje się na 40-70/milion, a według najnowszych danych nawet powyżej 100 przypadków na milion (1). Poza widocznymi zniekształcającymi zmianami zewnętrznymi, dotyczącymi głównie twarzoczaszki, rąk i stóp (ryc. 1), akromegalia wpływa również niekorzystnie na narządy wewnętrzne i istotnie skraca długość życia pacjentów. Szacuje się, że średnia długość życia może być krótsza nawet o 10 lat w porównaniu do populacji ogólnej (2). Wynika to w większości przypadków ze znacznego, zwykle wieloletniego opóźnienia w rozpoznawaniu choroby w stosunku do wystąpienia nadmiernej produkcji GH. Jest to skutkiem powolnego i podstępnego rozwoju objawów, które początkowo są nieznaczne i dość niespecyficzne, natomiast objawy związane z masą guza i zaburzenia widzenia pojawiają się stosunkowo późno (3).
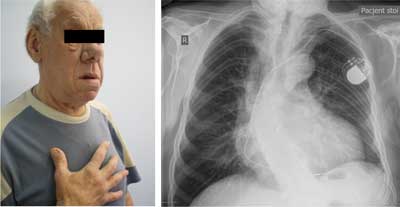
Ryc. 1. 80-letni pacjent z wieloletnią nierozpoznaną akromegalią. Liczne powikłania ze strony układu krążenia: od ok. 30 lat leczony z powodu nadciśnienia tętniczego i cukrzycy; w 55. roku życia przebyty zawał dolnej ściany serca; niewydolność serca NYHA III; utrwalone migotanie przedsionków; stan po wszczepieniu kardiostymulatora z powodu zespołu MAS.
Wieloletnia nieleczona lub nieskutecznie leczona akromegalia prowadzi do licznych powikłań układowych, które mogą istotnie zwiększać chorobowość, obniżać jakość życia, a także około 2-krotnie zwiększać śmiertelność w porównaniu do populacji ogólnej (4). Wśród głównych przyczyn zwiększonej śmiertelności znajdują się choroby sercowo-naczyniowe, które odpowiadają za około 60% zgonów pacjentów z akromegalią (5). Głównymi czynnikami predykcyjnymi zgonu z przyczyn sercowo-naczyniowych u pacjentów z akromegalią są: czas trwania choroby, wiek pacjenta, utrzymujące się podwyższone stężenia GH i IGF-1 oraz współwystępowanie nadciśnienia tętniczego, zaburzeń gospodarki węglowodanowej i lipidowej (4, 6-9).
CHOROBY UKŁADU SERCOWO-NACZYNIOWEGO W AKROMEGALII
Najczęstszym powikłaniem akromegalii ze strony układu krążenia jest kardiomiopatia akromegaliczna (10). Istotnie częściej niż w ogólnej populacji występują również: nadciśnienie tętnicze (9, 11, 12), zaburzenia rytmu serca (13) i zmiany zastawkowe (14). Obserwuje się przyspieszony rozwój miażdżycy tętnic (15), a w długotrwałej aktywnej chorobie dochodzi ostatecznie do rozwoju zastoinowej niewydolności serca (16) (ryc. 1).
Kardiomiopatia akromegaliczna
Kardiomiopatia akromegaliczna jest specyficzną kardiomiopatią powstającą na skutek długotrwałej ekspozycji na podwyższone stężenia GH i IGF-1, niezależnie od obecności nadciśnienia tętniczego i zaburzeń metabolicznych (17). Cechuje się koncentrycznym obukomorowym przerostem mięśnia sercowego, pojawiającym się wcześnie i postępującym wraz z czasem trwania nieleczonej akromegalii. Wobec tego typowo kardiomiopatia występuje u pacjentów starszych i z długo trwającą chorobą (około 90% takich pacjentów), jednak zmiany mogą być obecne nawet u 20% młodych pacjentów (< 30. roku życia) bez nadciśnienia tętniczego, z krótkim czasem ekspozycji na wysokie stężenia GH (3, 18). Obecność dodatkowych niekorzystnych czynników, takich jak nadciśnienie tętnicze, zaburzenia gospodarki węglowodanowej czy nadczynność tarczycy istotnie przyspiesza progresję kardiomiopatii oraz zwiększa jej częstość występowania nawet u młodych pacjentów. Najlepszym narzędziem do oceny obecności i zaawansowania kardiomiopatii jest badanie echokardiograficzne.
GH i IGF-1 oddziałują na serce w mechanizmach endo-, auto- i parakrynnych poprzez receptory zlokalizowane w kardiomiocytach (5). Odgrywają istotną rolę regulującą w rozwoju i utrzymaniu prawidłowej budowy serca, regulują apoptozę kardiomiocytów oraz wpływają na kurczliwość mięśnia sercowego, przez zwiększenie wrażliwości komórek na wapń (19). Wobec tego GH zarówno bezpośrednio, jak i za pośrednictwem IGF-1 ma troficzny i inotropowo dodatni wpływ na mięsień sercowy (17).
W badaniu histologicznym stwierdza się przerost kardiomiocytów oraz włóknienie śródmiąższowe, które stopniowo zaburzają architekturę mięśnia sercowego. Obserwuje się zwiększone pozakomórkowe odkładanie kolagenu, obszary martwicy i nacieki z komórek jednojądrowych, co odpowiada obrazowi wieloogniskowego zapalenia mięśnia sercowego. Zmiany te powstają wskutek znacznie zwiększonej apoptozy komórek mięśnia sercowego pod wpływem nadmiaru GH, potwierdzanej w badaniach biopsyjnych (20, 21).
W praktyce klinicznej można wyróżnić 3 fazy rozwoju kardiomiopatii akromegalicznej (ryc. 2) (16, 22). W pierwszej, wczesnej fazie rozpoczyna się koncentryczny przerost mięśnia obu komór serca, z jego zwiększoną kurczliwością, dochodzi do przyspieszenia czynności serca i zwiększenia rzutu serca, co prowadzi do krążenia hiperkinetycznego.
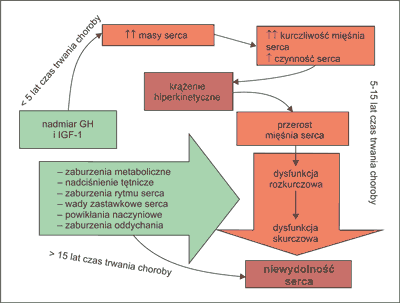
Ryc. 2. Hipotetyczny przebieg rozwoju kardiomiopatii i niewydolności serca u pacjentów z akromegalią (wg Colao A (16)).
W kolejnej fazie nasila się przerost mięśnia sercowego i pojawiają się objawy dysfunkcji rozkurczowej. Wcześnie pojawia się zaburzenie napełniania komór wskutek ich nieprawidłowej relaksacji i zmniejszonej elastyczności ścian. Następnie dołącza się dysfunkcja skurczowa podczas wysiłku fizycznego. W trzeciej, końcowej fazie, w przypadku nieleczonej choroby, głównie u starszych chorych, stwierdza się rozstrzeń komór serca prowadzącą do dysfunkcji skurczowej i rozkurczowej ze zmniejszonym rzutem serca także w spoczynku. Na tym etapie dołączają się zwykle inne powikłania i choroby towarzyszące, wady zastawkowe, choroba wieńcowa i ostatecznie rozwija się przewlekła niewydolność serca (ryc. 2). Wobec tego trudne jest wyodrębnienie wpływu samej nadprodukcji GH na serce w końcowej fazie rozwoju kardiomiopatii akromegalicznej.
W momencie rozpoznania akromegalii większość pacjentów nie ma ewidentnych objawów choroby serca, a jawną niewydolność serca stwierdza się u mniej niż 10% chorych (23). Pomimo dość częstych na tym etapie zmian w budowie serca widocznych w badaniu echokardiograficznym, większość pacjentów ma prawidłową frakcję wyrzutową w spoczynku, która jedynie zmniejsza się podczas wysiłku fizycznego i skutkuje pogorszeniem wydolności fizycznej (2).
Wady zastawkowe
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Zgliczyński W, Witek P, Zdunowski P: Guzy przysadki. [W:] Endokrynologia. Cz. I. Wielka Interna. Wyd I. Medical Tribune Polska 2011; 65-91.
2. Clayton RN: Cardiovascular function in acromegaly. Endocr Rev 2003; 24(3): 272-277.
3. Melmed S: Acromegaly pathogenesis and treatment. J Clin Invest 2009; 119(11): 3189-3202.
4. Holdaway IM, Bolland MJ, Gamble GD: A meta-analysis of the effect of lowering serum levels of GH and IGF-I on mortality in acromegaly. Eur J Endocrinol 2008; 159(2): 89-95.
5. Colao A, Ferone D, Marzullo P, Lombardi G: Systemic complications of acromegaly: epidemiology, pathogenesis, and management. Endocr Rev 2004; 25(1): 102-152.
6. Holdaway IM: Excess mortality in acromegaly. Horm Res 2007; 68 (Suppl. 5): 166-172.
7. Sherlock M, Ayuk J, Tomlinson JW et al.: Mortality in patients with pituitary disease. Endocr Rev 2010; 31(3): 301-342.
8. Colao A, Baldelli R, Marzullo P et al.: Systemic hypertension and impaired glucose tolerance are independently correlated to the severity of the acromegalic cardiomyopathy. J Clin Endocrinol Metab 2000; 85: 193-199.
9. Arosio M, Reimoudo G, Malchidi E et al.: Italian Study Group of Acromegaly. Predictors of morbidity and mortality in acromegaly: an Italian survey. Eur J Endocrinol 2012; 167(2): 189-198.
10. Colao A, Marzullo P, Di Somma C, Lombardi G: Growth hormone and the heart. Clin Endocrinol (Oxf) 2001; 54(2): 137-154.
11. Berg C, Petersenn S, Lahner H et al.: Investigative Group of the Heinz Nixdorf Recall Study and the German Pegvisomant Observational Study Board and Investigators. Cardiovascular risk factors in patients with uncontrolled and long-term acromegaly: comparison with matched data from the general population and the effect of disease control. J Clin Endocrinol Metab 2010; 95(8): 3648-3656.
12. Bondanelli M, Ambrosio MR, degli Uberti EC: Pathogenesis and prevalence of hypertension in acromegaly. Pituitary 2001; 4(4): 239-249.
13. Kahaly G, Olshausen KV, Mohr-Kahaly S et al.: Arrhythmia profile in acromegaly. Eur Heart J 1992; 13: 51-56.
14. Colao A, Spinelli L, Marzullo P et al.: High prevalence of cardiac valve disease in acromegaly: an observational, analytical, case-control study. J Clin Endocrinol Metab 2003; 88(7): 3196-3201.
15. Kartal I, Oflaz H, Pamukçu B et al.: Investigation of early atherosclerotic changes in acromegalic patients. Int J Clin Pract 2010; 64(1): 39-44.
16. Colao A: Long-term acromegaly and associated cardiovascular complications: a case-based review. Best Pract Res Clin Endocrinol Metab 2009 Dec; 23 (Suppl. 1): S31-8.
17. Matta MP, Caron P: Acromegalic cardiomyopathy: a review of the literature. Pituitary 2003; 6(4): 203-207.
18. Colao A, Pivonello R, Grasso LF et al.: Determinants of cardiac disease in newly diagnosed patients with acromegaly: results of a 10 year survey study. Eur J Endocrinol 2011; 165(5): 713-721.
19. Strömer H, Cittadini A, Douglas PS, Morgan JP: Exogenously administered growth hormone and insulin-like growth factor-1 alter intracellular Ca2+ handling and enhance cardiac performance. In vitro evaluation in the isolated isovolumic buffer-perfused rat heart. Circ Res 1996; 79: 227-235.
20. Lie JT: Pathology of the heart in acromegaly: anatomic findings in 27 autopsiedpatients. Am Heart J 1980; 100(1): 41-52.
21. Frustaci A, Chimenti C, Setoguchi M et al.: Circulation. Cell death in acromegalic cardiomyopathy 1999; 99(11): 1426-1434.
22. Colao A, Vitale G, Pivonello R et al.: The heart: an end-organ of GH action. Eur J Endocrinol 2004; 151 (Suppl. 1): S93-101.
23. Damjanovic SS, Neskovic AN, Petakov MS et al.: High output heart failure in patients with newly diagnosed acromegaly. Am J Med 2002; 112(8): 610-616.
24. Pereira AM, van Thiel SW, Lindner JR et al.: Increased prevalence of regurgitant valvular heart disease in acromegaly. J Clin Endocrinol Metab 2004; 89(1): 71-75.
25. Ohtsuka G, Aomi S, Koyanagi H et al.: Heart valve operation in acromegaly. Ann Thor Surg 1997; 64(2): 390-393.
26. Ritchie CM, Sheridan B, Fraser R et al.: Studies on the pathogenesis of hypertension in Cushing’s disease and acromegaly. Q J Med 1990; 76(280): 855-867.
27. Kamenicky P, Viengchareun S, Blanchard A et al.: Epithelial sodium channel is a key mediator of growth hormone-induced sodium retention inacromegaly. Endocrinology 2008; 149(7): 3294-3305.
28. Slowinska-Srzednicka J, Zgliczynski S, Soszynski P et al.: High blood pressure and hyperinsulinaemia in acromegaly and in obesity. Clin Exp Hypertens 1989; A11(3): 407-425
29. Maison P, Démolis P, Young J et al.: Vascular reactivity in acromegalic patients: preliminary evidence for regional endothelial dysfunction and increased sympathetic vasoconstriction. Clin Endocrinol (Oxf) 2000; 53(4): 445-451.
30. López-Velasco R, Escobar-Morreale HF, Vega B et al.: Cardiac involvement in acromegaly: specific myocardiopathy or consequence of systemichypertension? J Clin Endocrinol Metab 1997; 82(4): 1047-1053.
31. Herrmann BL, Bruch C, Saller B et al.: Occurrence of ventricular late potentials in patients with active acromegaly. Clin Endocrinol (Oxf) 2001; 55(2): 201-207.
32. Cannavo S, Almoto B, Cavalli G et al.: Acromegaly and coronary disease: an integrated evaluation of conventional coronary risk factors and coronary calcifications detected by computed tomography. J Clin Endocrinol Metab 2006; 91(10): 3766-3772.
33. Vilar L, Naves LA, Costa SS et al.: Increase of classic and nonclassic cardiovascular risk factors in patients with acromegaly. Endocr Pract 2007; 13(4): 363-372.
34. Erem C, Nuhoglu I, Kocak M et al.: Blood coagulation and fibrinolysis in patients with acromegaly: increased plasminogen activator inhibitor-1 (PAI-1), decreased tissue factor pathway inhibitor (TFPI), and an inverse correlation between growth hormone and TFPI. Endocrine 2008; 33(3): 270-276.
35. Colao A, Spiezia S, Cerbone G et al.: Increased arterial intima-media thickness by B-M mode echodoppler ultrasonography inacromegaly. Clin Endocrinol (Oxf) 2001; 54(4): 515-524.
36. Kartal I, Oflaz H, Pamukçu B et al.: Investigation of early atherosclerotic changes in acromegalic patients. Int J Clin Pract 2010; 64(1): 39-44.
37. Baykan M, Erem C, Gedikli O et al.: Impairment in flow-mediated vasodilatation of the brachial artery in acromegaly. Med Princ Pract 2009; 18(3): 228-232.
38. Giustina A, Barkan A, Casanueva FF et al.: Criteria for cure of acromegaly: a consensus statement. J Clin Endocrinol Metab 2000; 85(2): 526-529.
39. Colao A: Improvement of cardiac parameters in patients with acromegaly treated with medical therapies. Pituitary 2012; 15(1): 50-58.
40. Colao A, Cuocolo A, Marzullo P et al.: Is the acromegalic cardiomyopathy reversible? Effect of 5 year normalization of growth hormone and insulin-like growth factor-I levels on cardiac performance. J Clin Endocrinol Metab 2001; 86(4): 1551-1557
41. Colao A, Spinelli L, Cuocolo A et al.: Cardiovascular consequences of early-onset growth hormone excess. J Clin Endocrinol Metab 2002; 87(7): 3097-3104.
42. Lombardi G, Colao A, Marzullo P et al.: Multicenter Italian Study Group on Lanreotide. Improvement of left ventricular hypertrophy and arrhythmias after lanreotide-induced GH and IGF-I decrease in acromegaly. A prospective multi-center study. J Endocrinol Invest 2002; 25(11): 971-976.
43. Luboshitzky R, Barzilai D: Bromocriptine for an acromegalic patient. Improvement in cardiac function and carpal tunnel syndrome JAMA 1980; 244: 1825-1827.
44. Bogazzi F, Manetti L, Raffaelli V et al.: Cabergoline therapy and the risk of cardiac valve regurgitation in patients with hyperprolactinemia: a meta-analysis from clinical studies. J Endocrinol Invest 2008; 31(12): 1119-1123.
45. Pivonello R, Galderisi M, Auriemma RS et al.: Treatment with growth hormone receptor antagonist in acromegaly: effect on cardiac structure and performance. J Clin Endocrinol Metab 2007; 92(2): 476-482.
46. Colao A, Pivonello R, Auriemma RS et al.: Efficacy of 12-month treatment with the GH receptor antagonist pegvisomant in patients withacromegaly resistant to long-term, high-dose somatostatin analog treatment: effect on IGF-I levels, tumor mass, hypertension and glucose tolerance. Eur J Endocrinol 2006; 154(3): 467-477.


