© Borgis - Postępy Nauk Medycznych s1/2013, s. 1-68
Andrzej Mróz
Analiza morfologiczna i czynniki predykcyjne występowania polipów ząbkowanych jelita grubego u uczestników Programu Badań Przesiewowych w kierunku wczesnego wykrywania raka jelita grubego w latach 2000-2004
Rozprawa na stopień doktora habilitowanego nauk medycznych
Morphological analysis and predilection factors of colonic serrated polyps in participants of colon cancer screening programme in years 2000-2004
Summary
Last decade has brought substantial development of knowledge concerning colonic serrated polyps. From the previously recognized hyperplastic polyps several subgroups have been extracted and described naming classical hyperplastic polyps, sessile serrated polyps and traditional serrated adenomas. In addition classical hyperplastic polyps have been subdivided in three types – microvesicular hyperplastic polyps, goblet cell hyperplastic polyps and mucin poor hyperplastic polyps. All of them are characterized by increased infoldings of the epithelium forming serration sometimes also depicted as saw-tooth pattern. Histopathological examination represents the base of serrated polyps diagnosis. Serrated polyps are believed to give rise to 15-20% of colon cancers developing via serrated neoplasia pathway. Sessile serrated polyps and traditional serrated adenomas are at the greatest risk of progressing to cancer. The diagnosis and differentiation from classical hyperplastic polyps are of great clinical importance since the follow up for SSP and TSA should be the same as for classical adenomas. History of the serrated polyps recognition and detailed histopathological diagnostic criteria of serrated polyps are presented in Introduction.
Aim
The aim of the study is to assess morphology of serrated polyps in subjects of the colon cancer screening programme from Warsaw region who underwent colonoscopy in Oncology Center-Institute in years 2000-2004. All subtypes of serrated polyps were analysed with regard to sex and age of patient, localization and the size of the polyp. Concurrence of serrated polyps with regard to mentioned factors was also studied as well as coincidence of serrated polyps and conventional adenomas. Predilection factors for serrated polyps ocurrence in the colon were also searched for. The risk of colon cancer development among patients with serrated polyps was assessed based on the interval cancer occurrence within analyzed group.
Materials and Methods
Database of colon cancer screening programme from the years 2000-2004 was used. 1597 subjects with 2970 serrated polyps were identified. All specimen were histologically reevaluated and ascribed with size and localization including rectum, sigmoideum, descending colon, transverse colon, ascending colon and cecum. Information about age and sex of patients was collected. Statistical analyses using all these factors were performed.
Results
Most of the polyps (> 95%) were of classical, small hyperplastic polyp type located in the left part of the colon. Most prevalent subtype in all locations was MVHP and the MVHP:GCHP:MPHP ratio amounted to 7:4:1.
The prevalence of SSP and TSA was 2% and 1% respectively. Half of them were smaller than 5 mm. SSP were located mainly in ascending and transverse colon and in sigmoideum. TSA were most prevalent in sigmoideum and rectum.
Multifactorial analyses displayed predilection of MVHP occurrence to women and distal part of the colon and GCHP occurrence to men. SSP were most likely to be found with proximal direction regardless the sex of the patient. Similarly, no significant impact of colonic adenomas on serrated polyps was shown with the exception of increased MPHP presence in subjects with adenomas.
Increased risk of colon cancer was not displayed in patients with serrated polyps as judged on interval cancer occurrence in comparison with the whole screening population in the analyzed period.
Conclusions
1. Morphology of serrated polyps of the colon in colon cancer screening program participants:
– The most prevalent type of serrated polyps are classical hyperplastic polyps.
– Classical hyperplastic polyps are mostly found in the left part of the colon (the sigmoid and rectum) and are smaller than 5 mm in diameter.
– The most common subtype of classical hyperplastic polyp is MVHP. It is also the most common type in each segment of the colon.
– Prevalence of SSP and TSA in screenees population amounts to 2% and 1%, respectively.
– Size of SSP is similar in the right and left parts of the colon.
– Different types of serrated polyps may coexist but are most commonly isolated lesions.
2. Predictive factors of serrated polyps ocurrence:
– Sessile serrated polyp is commonly bigger than hyperplastic polyp and is predilected to the right side of the colon (cecum, ascending and transverse colon). Half of SSP are however smaller than 5 mm. Size criterium cannot be decisive in SSP diagnosis.
– SSP ocurrence is not associated with sex and age of the patient.
– TSA are usually bigger than 5 mm in diameter.
3. Presence of serrated polyps including SSP and TSA is not connected with the higher risk of interval colon cancer development.

WSTĘP
Rak jelita grubego, epidemiologia, zmiany przedrakowe, szlaki karcynogenezy
Rak jelita grubego stanowi poważne zagadnienie społeczne i medyczne. Jest najczęstszym nowotworem złośliwym w Europie i drugą co do częstości przyczyną zgonu chorych na nowotwory złośliwe w Europie i Stanach Zjednoczonych (1, 2, 3). Również w Polsce na przestrzeni ostatnich lat obserwuje się wzrost częstości zachorowań na raka jelita grubego. W najnowszym opracowaniu Zakładu Epidemiologii Centrum Onkologii w Warszawie standaryzowane współczynniki zachorowalności/śmiertelności u mężczyzn i kobiet wynosiły w 2010 roku odpowiednio 29,8/19,8/100 tys. i 17,2/10,3/100 tys. (4). W proces rozwoju raka jelita grubego zaangażowanych jest wiele czynników i procesów genetycznych, na które nakładają się czynniki epigenetyczne, w większości związane z nawykami żywieniowymi i stylem życia (5). Kumulacja zmian na poziomie molekularnym ma swoje wykładniki morfologiczne w postaci zmian prekursorowych rozwijających się w jelicie grubym (6, 7, 8). Należą do nich polipy nabłonkowe – gruczolaki i zmiany ząbkowane, które zostaną szczegółowo omówione w dalszej części opracowania. Zmiany takie mogą być wykrywane i usuwane w trakcie badań endoskopowych, co stanowi skuteczną metodę prewencji i prowadzi do zmniejszenia liczby zachorowań i zgonów na raka jelita grubego w populacjach badanych (9, 10, 11, 12, 13, 14, 15). Określenie polip dotyczy jedynie makroskopowego wyglądu zmiany, jako uwypuklonej do światła przewodu pokarmowego struktury. Podziały endoskopowe określają kształt, wygląd i wielkość polipa. Odnoszą się także do całej grupy zmian płaskich, w zależności od stopnia ich wyniosłości lub zapadnięcia w stosunku do sąsiadującej błony śluzowej jelita, wyglądu powierzchni i brzegów (16, 17). Jednak to badanie histopatologiczne ostatecznie przesądza o rozpoznaniu typu polipa i decyduje o podjęciu działań terapeutycznych (2).
Szlak supresorowy rozwoju raka jelita grubego, gruczolaki jelita grubego
W karcynogenezie raka jelita grubego wyróżnia się obecnie dwa podstawowe szlaki – supresorowy i szlak neoplazji ząbkowanej. Większość sporadycznych raków jelita grubego, jak i część raków dziedzicznych, rozwija się na drodze akumulacji mutacji genów supresorowych, a wyrazem morfologicznym tych przemian jest powstawanie gruczolaków jelita grubego. Morfologiczna sekwencja zmian gruczolak-rak opisywana była już od lat 70. XX wieku (18, 19, 20). Podstawy molekularne tego szlaku obejmują mutacje w genach APC i wewnątrzkomórkowy metabolizm β-kateniny (21, 22, 23, 24). Inaktywacja APC następuje na początku rozwoju gruczolaka. Do zmian tych dołączają się następnie aktywujące mutacje KRAS, DCC, SMAD4, SMAD2 i wyciszanie aktywności P53. Rezultatem wyżej opisanej kaskady zdarzeń jest rozwój niestabilnych chromosmalnie raków jelita grubego.
Wczesnymi odpowiednikami morfologicznymi opisanych zmian są ogniskowy rozrost nieprawidłowych krypt ACF (ang. abberant crypt focus) (25, 26) oraz gruczolaki jelita grubego. Gruczolak jelita grubego jest łagodnym nowotworem wywodzącym się z nabłonka gruczołowego, którego immanentną cechą jest obecność śródnabłonkowej neoplazji, powszechnie określanej mianem dysplazji nabłonka (27, 28, 29). W obrazie morfologicznym ocenia się dwa podstawowe kryteria, które składają się na rozpoznanie gruczolaka – zmiany architektoniczne i cytologiczne. Do zmian architektonicznych zalicza się rozrost i stłoczenie krypt jelitowych, a także powstawanie wydłużonych struktur zwanych kosmkami. Zmiany cytologiczne obejmują wydłużenie i nawarstwianie jąder komórkowych, dezorganizację przypodstawnej lokalizacji jąder, zwiększenie stosunku jądrowo-cytoplazmatycznego, zagęszczenie i grudkowanie chromatyny jądrowej (hiper- i heterochromazja), pojawianie się jąderek oraz licznych, w tym nieprawidłowych, figur podziału. Liczba komórek kubkowych w nabłonku dysplastycznym ulega zmniejszeniu, obserwuje się także obecność dystroficznych komórek kubkowych, czyli komórek z kubkami zlokalizowanymi po stronie błony podstawnej. Opisane zmiany cytologiczne nazywane są także gruczolakowatym typem dysplazji (ang. adenomatous type), co ma swoje uzasadnienie w różnicowaniu gruczolaków ze zmianami ząbkowanymi. Zmiany dysplastyczne pojawiają się zwykle najpierw w powierzchownych warstwach błony śluzowej, co skutkuje wzrostem gruczolaka od góry ku dołowi (ang. top-down) i także pomaga w różnicowaniu z innymi polipami jelita grubego.
W zależności od nasilenia zmian architektonicznych i cytologicznych wyróżnia się dwa stopnie dysplazji – dysplazję małego i dużego stopnia (29, 30). W terminologii opisowej dla określenia dysplazji dużego stopnia można spotkać również wcześniej stosowane pojęcia raka śródśluzówkowego czy też raka in situ. Znalazły się one w jednej grupie klasyfikacji wiedeńskiej (30), stanowiącej konsensus diagnostyczny pomiędzy patologami europejskimi i amerykańskimi, a patologami japońskimi, którzy kładą główny nacisk na zmiany cytologiczne. Należy podkreślić, że Światowa Organizacja Zdrowia i Europejskie Rekomendacje dotyczące zapewnienia jakości badań przesiewowych w kierunku wykrywania raka jelita grubego zalecają stosowanie określenia dysplazji dużego stopnia dla wszystkich zmian śródśluzówkowych, w tym także tych, które naciekają blaszkę właściwą, ale nie przekraczają blaszki mięśniowej błony śluzowej (2, 29).
Klasyczne gruczolaki jelita grubego zostały podzielone na trzy główne typy, w zależności od udziału komponentu kosmkowego:
– gruczolaki cewkowe, w których komponent kosmkowy nie przekracza 25%,
– gruczolaki cewkowo-kosmkowe, które zawierają od 25% do 75% elementu kosmkowego,
– gruczolaki kosmkowe, w których udział komponentu kosmkowego przekracza 75%.
Największym ryzykiem przemiany do raka jelita grubego charakteryzują się tzw. zaawansowane gruczolaki, czyli zmiany wyróżniające się co najmniej jedną z następujących cech: dysplazja dużego stopnia, średnica ≥ 10 mm lub komponent kosmkowy powyżej 25% (19, 20, 31, 32).
Na rycinach 1-3 w rozdziale przedstawiono obrazy morfologiczne ogniska nieprawidłowych krypt typu dysplastycznego oraz typowe obrazy gruczolaka cewkowego i cewkowo-kosmkowego.
A.

B.
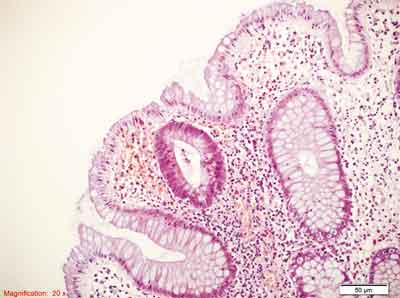
Rycina 1. Nieprawidłowe ognisko krypt typu dysplastycznego. Strzałką oznaczono pojedynczą cewę jelitową z cechami dysplazji małego stopnia typu gruczolakowatego. Niewielka hiperchromazja i nawarstwianie jąder komórkowych. Barwienie HE, A. – pow. 100x, B. – pow. 200x.
A.
B.

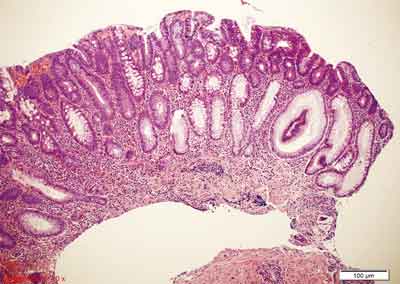
Rycina 2. Gruczolak cewkowy, dysplazja małego stopnia. Barwienie HE, A. – pow. 100x, B. – pow. 400x.
A. Widoczny rozrost błony śluzowej typu top-down (od warstw powierzchownych w głąb), struktury cewkowe.
B. Cechy cytologiczne i zaburzenia architektoniki typowe dla dysplazji małego stopnia. Nawarstwianie się i hiperchromazja jąder komórkowych. W dolnej części ryciny cewy bez cech dysplazji.
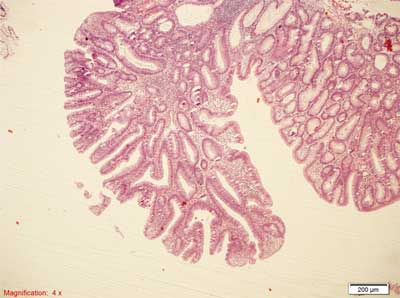
Rycina 3. Gruczolak cewkowo-kosmkowy, dysplazja małego stopnia. Barwienie HE, pow. 40x. Widoczne struktury cewkowe i kosmkowe (<75%).
Szlak neoplazji ząbkowanej rozwoju raka jelita grubego, polipy ząbkowane – perspektywa historyczna
Drogą szlaku supresorowego rozwija się prawdopodobnie około 80% raków jelita grubego (33). Zaobserwowano jednak, że niektóre guzy nie wykazują mutacji w zakresie genu APC czy β-kateniny, nie wykazują także niestabilności chromosomalnej w postaci delecji, insercji czy utraty heterozygotyczności. Muszą one zatem rozwijać się poprzez alternatywny szlak karcynogenezy, obecnie zwany szlakiem neoplazji ząbkowanej (34, 35, 36, 37, 38, 39, 40, 41). Szlak ten obejmuje liczne zmiany genetyczne, które można podzielić na kilka podstawowych, czasem współistniejących grup zagadnień:
– Niestabilność mikrosatelitarna (MSI – microsatelite instability)
– Nadmierna metylacja wysp CpG (CIMP phenotype)
– Utrata ekspresji MGMT (transferazy O6-metyloguaniny)
– Mutacja genu KRAS i BRAF (22, 42)
MSI – powstawanie mikrosatelitarnie niestabilnych raków jelita grubego jest wynikiem nagromadzenia mutacji w genach naprawy DNA (ang. mismatch repair genes), takich jak MLH-1, MSH-2, MSH-6, MSH-3 czy PMS-2. Mikrosatelity to krótkie, powtarzające się sekwencje DNA, występujące w licznych miejscach genomu ludzkiego zarówno w rejonach niekodujących, jak i kodujących konkretne białka (33). Uszkodzenie genów naprawy DNA prowadzi do kolejnych zaburzeń w regulacji genów związanych z procesami podziałowymi komórki (22), takich jak transformujący czynnik wzrostu β typu II (TGFβ 2), receptor insulinopodobnego czynnika wzrostu typu II (IGF II), Bax i wielu innych. Uszkodzenie genów naprawy DNA może być spowodowane mutacją germinalną tj. mutacją dotyczącą komórek rozrodczych przekazywaną potomstwu, jak w zespole dziedzicznego raka jelita grubego bez polipowatości (HNPCC – ang. hereditary nonpolyposis colon cancer), częściej jednak jest wynikiem sporadycznej hipermetylacji cytozyny wysp CpG w rejonie promotora genu MLH-1 (22). W zależności od liczby loci uszkodzonych genów wyróżnia się raki o wysokim (MSH-H) i niskim (MSH-L) poziomie niestabilności mikrosatelitarnej.
Fenotyp metylacji wysp CpG. Metylacja DNA jest ważnym mechanizmem epigenetycznym. Następuje ona zazwyczaj w rejonie powtarzających się sekwencji cytozyna-guanina, zwanych wyspami CpG. Serie takich sekwencji obecne są w rejonach promotorowych wielu genów. Metylacja cytozyny inaktywuje promotor, co skutkuje wyciszeniem genu (33, 43). Dotyczy to, między innymi, takich genów jak: MLH-1, MGMT, p14, p16 i EphB2 (42, 44, 45, 46, 47, 48, 49, 50, 51, 52). Około 30-50% raków jelita grubego wykazuje nadmierną metylację wysp CpG – zjawisko to zwane jest fenotypem metylatora wysp CpG (CIMP). W zależności od stopnia metylacji wyróżnione zostały formy o wysokim (CIMP-H) i niskim (CIMP-L) stopniu tego zjawiska. W badaniach porównujących zastosowanie panelu markerów do oznaczenia CIMP jako dyskryminującego raki jelita grubego wykazano, że pacjenci z pozytywnym statusem CIMP to częściej osoby starsze i kobiety, osoby z prawostronnymi rakami o utkaniu raka śluzowego lub niskozróżnicowanego. Ponadto, zmiany te są niestabilne mikrosatelitarnie i mają mutacje w genie BRAF (43, 53, 54, 55). Metylacja wysp CpG stanowi wczesne wydarzenie na drodze szlaku neoplazji ząbkowanej i obecna jest już na poziomie nieprawidłowego ogniska krypt (ACF) (56).
Utrata ekspresji MGMT – nadmierna metylacja promotora genu MGMT prowadzi do zaburzeń jego funkcji i powstawania raków o niskim poziomie niestabilności mikrosatelitarnej (MSI-L).
Mutacje genów KRAS i BRAF – geny te są elementami szlaku MAPK-ERK, przekazującego odpowiedzi na liczne pozakomórkowe sygnały, które regulują takie procesy jak programowana śmierć komórki, proliferacja i różnicowanie. KRAS koduje białko p21ras, które wpływa na podziały komórkowe. Mutacja KRAS skutkuje ciągłą aktywacją genu i niekontrolowanym, autonomicznym dzieleniem się komórki. BRAF to białko z rodziny kinaz serynowych/tyrozynowych, stanowiące element szlaku RAS/RAF/ERK/MAPK, które także odgrywa dodatkowo rolę antyapoptotyczną. Jego nadekspresja inaktywuje kaspazy, co prowadzi do hamowania apoptozy. Morfologicznym tego wyrazem jest powstawanie nawarstwień niezłuszczonego nabłonka gruczołowego jelita grubego, zwanych ząbkami. Mutacja BRAF w raku jelita grubego bardzo często towarzyszy niestabilności mikrosatelitarnej oraz nadmiernej metylacji DNA (57, 58, 59, 60). Nie obserwuje się jej jednak u pacjentów z HNPCC, co dowodzi innego źródła MSI w rakach dziedzicznych i sporadycznych (47). Mutacje w genach KRAS i BRAF wzajemnie się wykluczają. Oznacza to, że obecność mutacji w genie KRAS wyklucza mutację BRAF, mutacja w genie BRAF wyklucza mutację KRAS (54, 59, 61).
Szlak neoplazji ząbkowanej jest wielotorowy i wydaje się znacznie bardziej heterogenny od klasycznej drogi supresorowej. W jednym guzie można obserwować różne zaburzenia genetyczne, które prowadzą do powstawania podobnych zmian morfologicznych.
Na podstawie profilu genetycznego Jass i wsp. wyodrębnili kilka podtypów molekularnych raka jelita grubego (8). Zostały one przedstawione w tabeli 1.
Tabela 1. Charakterystyka molekularna raków jelita grubego, rozwijających się w mechanizmie drogi supresorowej i szlaków neoplazji ząbkowanej.
| | Szlak supresorowy | Szlak neoplazji ząbkowanej | Szlak mieszany |
| Dziedziczność | Dziedziczny i sporadyczny | Dziedziczny | Dziedziczny i sporadyczny | | ? |
| CIMP | negatywny | negatywny | CIMP-H | | CIMP-L |
| MSI | MSS | MSI-H | MSI-H | MSI-L | MSI-L lub MSS |
| Niestabilność chromosomalna | obecna | nieobecna | nieobecna | nieobecna | obecna |
| KRAS mutacja | +++ | +/- | – | – | +++ |
| BRAF mutacja | – | – | +++ | +++ | – |
| MLH1 status | prawidłowy | mutacja | metylacja | częściowa metylacja | norma |
| MGMT metylacja | – | – | +/- | +++ | +++ |
Podobnie jak w przypadku drogi supresorowej i klasycznych gruczolaków, także raki jelita grubego rozwijające się na szlaku neoplazji ząbkowanej mają swoje prekursory – są nimi polipy ząbkowane. Jest to zróżnicowana morfologicznie grupa zmian, której cechą wspólną jest występowanie nawarstwiania nabłonka krypt jelitowych w postaci przypominającej zęby piły, prowadzące do powstania ząbkowania (ang. saw-tooth pattern). Wynika ono z zahamowania fizjologicznego złuszczania się komórek w nabłonku pokrywnym, związanego z zaburzoną apoptozą (62, 63, 64).
Do połowy lat 80. XX wieku wszystkie tego typu polipy nazywano polipami hiperplastycznymi i uważano za rozrosty nabłonkowe nienowotworowe, które nie mają potencjału przemiany do raka jelita grubego. Oryginalne opisy polipów hiperplastycznych, zwanych także metaplastycznymi, pojawiały się już od lat 30. XX wieku (65, 66). Polipy te nie wykazywały cech dysplazji w rozumieniu opisanego wcześniej gruczolakowatego typu, natomiast ich cechą charakterystyczną było występowanie ząbkowania. Pojawiały się jednak doniesienia, w których opisywano obecność utkania polipa hiperplastycznego na obwodzie niektórych gruczolaków (67), czy też współwystępowania polipów hiperplastycznych z prawostronnymi rakami jelita grubego (68, 69) lub w populacjach chorych z wysokim ryzykiem rozwoju raka jelita grubego (70). Prace te nie wpływały zasadniczo na opinię klinicystów i morfologów, a główna linia podziału polipów nadal przebiegała na osi gruczolak-polip hiperplastyczny. W 1981 roku Sumner i wsp. (71) opisali mieszane utkanie dużego polipa hiperplastycznego z gruczolakiem u chorego z polipowatością hiperplastyczną, wysuwając koncepcję istnienia „niebezpiecznych polipów hiperplastycznych”. Opis przypadku raka jelita grubego rozwijającego się na podłożu mieszanego polipa hiperplastyczno-gruczolakowatego (72) wskazał na różnorodność polipów hiperplastycznych oraz możliwy potencjał onkogenny. Następnie w 1990 roku Longacre i Fenoglio-Preiser (73) analizowali grupę polipów o mieszanych cechach morfologicznych polipa hiperplastycznego i klasycznego gruczolaka. Uznali oni, iż nie jest to połączenie dwóch utkań histologicznych, ale odrębny typ gruczolaka, łączący cechy zmian cytologicznych z architektoniką ząbkowaną, przypominającą polipa hiperplastycznego. Autorzy nazwali tę zmianę gruczolakiem ząbkowanym, wprowadzając tym samym nową kategorię diagnostyczną. Umieścili oni jednak gruczolaka ząbkowanego w grupie gruczolaków klasycznych, jako ich wariant. Zmiana ta po raz pierwszy, jako oficjalna kategoria diagnostyczna, pojawiła się w klasyfikacji WHO w 2000 roku. Powyższe opisy okazały się mechanizmem inicjującym, jasne stało się bowiem, że polipy hiperplastyczne nie są homogenną grupą zmian i wymagają intensywnych badań morfologicznych i molekularnych. Na ich wyniki nie trzeba było długo czekać. Już w 1996 roku Emina Torlakovic publikuje pracę, w której opisuje chorych z zespołem polipowatości hiperplastycznej (74). Autorka podkreśla, że polipy hiperplastyczne u tych pacjentów różnią się istotnie od małych sporadycznych polipów hiperplastycznych. Posiadają część cech typowych dla opisanego wcześniej gruczolaka ząbkowanego i zachowują przy tym „siedzący” charakter. Zaproponowano wówczas zastosowanie określenia siedzący gruczolak ząbkowany (ang. sessile serrated adenoma – SSA), aby zmiany takie odróżnić od gruczolaka ząbkowanego. Stwierdzono ponadto, że w licznych wcześniejszych pracach publikowane zdjęcia polipów przypominały bardziej zmianę typu siedzącego polipa ząbkowanego niż klasycznego hiperplastycznego. Dotyczyło to zmian w wyrostku robaczkowym, tak zwanych odwróconych polipów hiperplastycznych, czy, co może najistotniejsze, mieszanych polipów hiperplastyczno-gruczolakowatych. Jak widać na przestrzeni zaledwie kilku lat dokonał się ogromny postęp w diagnostyce polipów ząbkowanych, doprowadziło to jednak do chaosu klasyfikacyjnego, który przez długie lata utrudniał, i nadal utrudnia, właściwe rozpoznanie histopatologiczne.
W 2003 roku Torlakovic i wsp. opublikowali pracę, która stała się fundamentem współczesnego spojrzenia na polipy ząbkowane (75). Przedstawiono w niej dokładną charakterystykę histopatologiczną sporadycznych polipów ząbkowanych. Analizowano zmienne morfologiczne dotyczące ogólnej architektury, typów proliferacji komórkowej, nasilenia ząbkowania krypt, zawartości śluzu w komórkach i w świetle krypt. Oceniano również obecność i rodzaj atypii jądrowej, nawarstwianie się jąder komórkowych, rozkład komórek w kryptach. Dokładna analiza tych danych doprowadziła do wydzielenia polipów ząbkowanych o nieprawidłowym typie proliferacji, które według autorów występowały częściej u kobiet, głównie po prawej stronie jelita grubego i były większe od polipów z prawidłową proliferacją. Nieprawidłowa proliferacja polega na pojawianiu się komórek dojrzałych wydzielających śluz w dolnej części rozrastającej się krypty. Dojrzewanie skutkujące gromadzeniem śluzu w komórkach, przy braku właściwego złuszczania, prowadzi do powstawania struktur ząbkowanych. W polipach z nieprawidłową proliferacją ząbkowanie pojawia się w warstwach głębszych, także tuż przy blaszce mięśniowej błony śluzowej i ma często charakter asymetryczny, to znaczy dotyczy jedynie jednego z ramion krypty. Nadmierne rozrastanie się dolnych części krypt prowadzi do przyjmowania przez nie nieprawidłowych kształtów. Polipy, które nie wykazują takich cech, nazywane są polipami o prawidłowym typie proliferacji lub zwykłymi polipami hiperplastycznymi.
Torlakovic i wsp. (75) dokonali także po raz pierwszy dodatkowego podziału zwykłych polipów hiperplastycznych na trzy podtypy – drobnopęcherzykowe polipy hiperplastyczne (ang. microvesicular hyperplastic polyp – MVHP), polipy hiperplastyczne z dużą liczbą komórek kubkowych (ang. goblet cell hyperplastic polyp – GCHP) oraz polipy hiperplastyczne ubogie w śluz (ang. mucin poor hyperplastic polyp – MPHP). Cechy charakterystyczne wszystkich podtypów polipów hiperplastycznych zostaną przedstawione w dalszej części pracy. Podział ten, choć w chwili obecnej nie ma jeszcze udowodnionego znaczenia klinicznego, został zaakceptowany przez Światową Organizację Zdrowia i włączony do najnowszej klasyfikacji WHO 2010.
Do grupy polipów ząbkowanych z nieprawidłową proliferacją zostały zaliczone zmiany o morfologii typowej dla siedzącego gruczolaka ząbkowanego (SSA). Kolejni autorzy badający zagadnienie polipów ząbkowanych stosowali wymiennie określenia siedzący gruczolak ząbkowany (SSA) i siedzący polip ząbkowany (SSP) (28, 33). Pojawiły się także określenia polip ząbkowany z nieprawidłową proliferacją (ang. serrtaed polyp with abnormal proliferation – SPAP) oraz polip hiperplastyczny „wariant” (ang. „variant” hyperplastic polyp). Ten zamęt klasyfikacyjny wydaje się uzasadniony z perspektywy czasu. Jak wspominano uprzednio, określenie gruczolak dotyczy łagodnego nowotworu nabłonkowego, którego cechą morfologiczną jest obecność dysplazji. Dla większości patologów pojęcie dysplazji odnosi się głównie do zmian cytologicznych (typ gruczolakowaty dysplazji) w kontekście zmian architektonicznych. W zmianach typu SSA/SSP bardzo często nie obserwuje się zaburzeń cytologicznych. Jądra komórkowe są ułożone przypodstawnie, nie wykazują hiperchromazji, nawarstwiania czy powiększenia. Trudno zatem było zaakceptować w środowisku patomorfologów określenie gruczolak dla zmian, w których zaburzenia dotyczyły jedynie nieprawidłowej architektoniki i proliferacji krypt. Stąd też określenie siedzący polip ząbkowany (SSP) jest określeniem kompromisowym, zostało zaakceptowane przez WHO i obecnie traktowane jest jako równoznaczne z siedzącym gruczolakiem ząbkowanym (SSA).
Część autorów, w tym Odze, (28) bardzo konsekwentnie podkreśla, że właściwą nazwą jest SSP, bowiem zmiany tego typu wykazują jedynie zaburzenia architektoniczne oraz nieprawidłową proliferację. Do zmian ząbkowanych z dysplazją autor ten zalicza jedynie gruczolaka ząbkowanego (któremu wraz z rozwojem wiedzy na temat polipów ząbkowanych dodano określenie „tradycyjny”) oraz polipy mieszane, w utkaniu których można wyróżnić SSP z ogniskami przekształceń z obecnością typowej gruczolakowatej dysplazji (tzw. zaawansowany siedzący polip ząbkowany). Inni autorzy (33) dopuszczają stosowanie określenia siedzący gruczolak ząbkowany (SSA) wymiennie z SSP, a do grupy polipów mieszanych zaliczają zmiany zbudowane z polipów hiperplastycznych i gruczolaków typowych czy też tradycyjnych gruczolaków ząbkowanych. Mimo pojawienia się klasyfikacji WHO w 2010 roku konfuzja terminologiczna trwa, a wielu autorów nadal posługuje się określeniem SSA (76, 77, 78). Należy przyjąć, że w chwili obecnej określenia SSP i SSA dotyczą takiej samej morfologicznie zmiany i mogą być stosowane wymiennie lub łącznie z zastosowaniem ukośnika (SSA/SSP) (79). Na potrzeby niniejszej pracy w dalszej jej części przyjęto stosowanie określenia siedzący polip ząbkowany (SSP), zgodnie z klasyfikacją WHO, praktyką naszego Ośrodka i rekomendacjami europejskimi ds. nadzoru nad jakością badań przesiewowych w kierunku wykrywania raka jelita grubego (2).
Zespół polipowatości ząbkowanej
Znakomita większość pacjentów to chorzy, u których występują sporadyczne polipy ząbkowane. Od wielu lat opisywane są jednak przypadki obecności licznych zmian ząbkowanych, które wcześniej określano mianem zespołu polipowatości hiperplastycznej. Okazało się, że duża część z tych zmian odpowiada morfologią siedzącym polipom ząbkowanym (75) i współczesna klasyfikacja preferuje określenie polipowatości ząbkowanej (29).
Kryteria rozpoznania zespołu obejmują:
1. Występowanie co najmniej 5 polipów ząbkowanych położonych proksymalnie do esicy, z których co najmniej dwa mają powyżej 10 mm średnicy.
2. Występowanie jakiejkolwiek liczby polipów ząbkowanych położonych proksymalnie do esicy u chorego z krewnym pierwszego stopnia z zespołem polipowatości ząbkowanej.
3. Występowanie powyżej 20 polipów ząbkowanych dowolnej wielkości na całej długości jelita grubego.
Związek zespołu polipowatości ząbkowanej z rakiem jelita grubego wydaje się przesądzony, jednak konkretne ryzyko przemiany rakowej jest trudne do ustalenia (80, 81, 82, 83, 84). W materiale z naszego Ośrodka, obejmującym ponad 50 tysięcy kolonoskopii przesiewowych, zidentyfikowano 28 pacjentów spełniających kryteria rozpoznania zespołu polipowatości ząbkowanej (85), nie stwierdzając raka jelita grubego u żadnego z nich. W innych pracach częstość raka sięgała nawet 35% i obejmowała przypadki rozpoznawane w czasie kolonoskopii wyjściowej i 6-letniej obserwacji (86). Ryzyko rozwoju raka może być uzależnione od typu obserwowanych zmian. Typ 1 obejmuje chorych z dużymi proksymalnymi siedzącymi polipami ząbkowanymi i u tych chorych ryzyko rozwoju raka jest znaczące, zaś typ 2 to pacjenci z licznymi drobnymi klasycznymi polipami hiperplastycznymi w całym jelicie grubym, z mniejszym ryzykiem rozwoju raka (83). Także profil zmian genetycznych i patogeneza raka u pacjentów z zespołem polipowatości ząbkowanej nie zostały dokładnie określone, głównie z powodu nielicznych rodzin pozostających w obserwacji (83). Najbardziej oczywistymi są szlaki neoplazji ząbkowanej, analogiczne do polipów sporadycznych (54, 64, 87). Niewykluczone jednak, że inne zmiany genetyczne, takie jak mutacja genu MUTYH, biorą udział w rozwoju polipowatości ząbkowanej.
Charakterystyka morfologiczna, molekularna i kliniczna oraz kryteria diagnostyczne polipów ząbkowanych
W chwili obecnej wyróżnia się następujące typy polipów ząbkowanych:
1. Polip hiperplastyczny
– typ MVHP
– typ GCHP
– typ MPHP
2. Siedzący polip ząbkowany (SSP)
3. Tradycyjny gruczolak ząbkowany (TSA)
4. Polipy mieszane
Polipy hiperplastyczne należą do polipów ząbkowanych wykazujących nadmierną, prawidłową proliferację. Mianem tym nazywano kiedyś wszystkie polipy ząbkowane. Są to klasyczne małe zmiany (do 5 mm), najczęściej spotykane w lewej połowie jelita grubego i stanowią około 80-95% wszystkich polipów ząbkowanych (73, 75, 88, 89). Charakteryzują się poszerzeniem strefy proliferacyjnej, która obejmuje zwykle od 1/3 do 1/2 wysokości krypty. Zmiany są symetryczne i ukierunkowane – rozrost typu „bottom-up”. Na podstawie architektoniki krypt oraz zawartości śluzu w komórkach polipy hiperplastyczne zostały podzielone na trzy podtypy:
– drobnopęcherzykowy polip hiperplastyczny (ang. microvesicular hyperplastic polyp – MVHP). Jest zmianą, której budowa najbardziej odpowiada klasycznemu opisowi polipa hiperplastycznego. Zbudowany jest z wydłużonych krypt o wąskim dnie, w których wyróżnić można symetryczną strefę proliferacyjną, obejmującą dolną część krypty, zazwyczaj maksymalnie do połowy jej wysokości. W górnej części krypty obserwuje się ząbkowanie, któremu towarzyszą różnego rodzaju zaburzenia budowy komórek kubkowych. Liczba komórek kubkowych jest mniejsza niż w otaczającej błonie śluzowej, obecne są drobne wakuole wypełnione mucynami. Należy także wspomnieć o występowaniu dystroficznych komórek kubkowych, czyli komórek, w których kropla śluzu posadowiona jest od strony błony podstawnej, a nie w kierunku światła krypty. Komórki nabłonka mają zazwyczaj delikatnie kwasochłonną cytoplazmę. Nawarstwianie jąder komórkowych jest mało nasilone i dotyczy strefy proliferacyjnej (75). Mitozy mogą występować, ale dotyczą dolnych partii krypt, atypia jądrowa, zazwyczaj niewielkiego stopnia, może być obecna. Liczba komórek neuroendokrynnych Kulczyckiego jest zwiększona i są one większe (hiperplazja i hipertrofia), w większości zmian obserwuje się także obecność komórek neuroendokrynnych z jasną cytoplazmą (75). Blaszka mięśniowa błony śluzowej ulega pogrubieniu w 82% MVHP, dodatkowo w prawie jednej trzeciej zmian widoczne jest wnikanie włókien blaszki mięśniowej błony śluzowej pomiędzy dna krypt. Błona podstawna jest pogrubiała, ale zmiany tego typu mają zazwyczaj charakter ogniskowy. Polipy MVHP w pokaźnym odsetku wykazują mutacje genu BRAF (8, 90), a rzadko mutacje w genie KRAS, są one zazwyczaj stabilne mikrosatelitarnie, a poziom metylacji rejonów CpG jest niski (34).
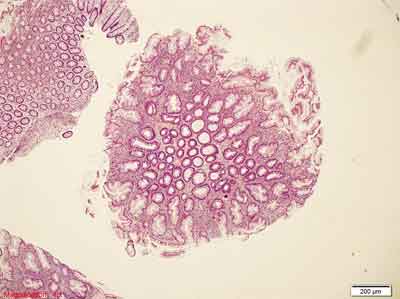
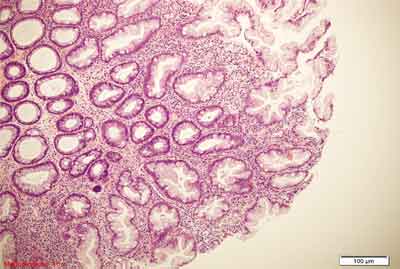
MVHP to najczęstszy podtyp polipa hiperplastycznego, występuje częściej po lewej stronie jelita grubego, do 15% tego typu zmian obserwowanych jest po stronie prawej (75). Polipy MVHP to zmiany małe (średnia wielkość to 3,2 mm) (75). Przykłady obrazów morfologicznych MVHP przedstawiono na rycinie 4.
A.
B.
C.
D.

Rycina 4. Polip hiperplastyczny typu drobnopęcherzykowego (MVHP). Barwienie HE, A. – pow. 40x, B. – pow. 100x, C. – pow. 200x, D. – pow. 400x.
A., B. – Rozrost powierzchownych warstw błony śluzowej jelita grubego, z tworzeniem struktur ząbkowanych. Przekroje skośne.
C. – Widoczna strefowość zmian. 1/3-1/2 dolna część błony śluzowej – strefa proliferacyjna (zmniejszona ilość śluzu, ciemne komórki, brak komórek kubkowych). Przekrój prostopadły. Ząbkowanie w górnej warstwie błony śluzowej.
D. – Rozrośnięte krypty z widocznym niewielkim nawarstwianiem jąder komórkowych, zmiany w obrębie komórek kubkowych., zęby piły.
– polip hiperplastyczny z dużą liczbą komórek kubkowych (ang. goblet-cell hyperplastic polyp – GCHP). Drugi co do częstości występowania podtyp polipa hiperplastycznego charakteryzuje się obecnością mało nasilonego ząbkowania ograniczonego do górnej strefy krypty lub tylko samej powierzchni błony śluzowej. Cechą typową, mającą odzwierciedlenie w nazwie polipa jest duża liczba komórek kubkowych, które stanowią zasadniczą część budowy histologicznej. Zaburzenia architektoniczne są mniejsze niż w MVHP, nie obserwuje się nawarstwiania jąder komórkowych, atypii jądrowej, nadmiernej apoptozy, dystrofii komórek kubkowych, komórki neuroendokrynne z jasną cytoplazmą występują rzadziej niż w MVHP (75). Do cech typowych dla polipów hiperplastycznych (także dla GCHP) należą pogrubienie błony śluzowej, pogrubienie błony podstawnej nabłonka powierzchownego oraz pogrubienie blaszki mięśniowej błony śluzowej. W badaniach molekularnych GCHP wykazują dość często obecność mutacji w genie KRAS (90), są zazwyczaj stabilne mikrosatelitarnie, a poziom metylacji DNA w rejonach CpG jest niski (22, 34, 42). GCHP występują głównie po lewej stronie jelita grubego (jedynie 4% zmian po stronie prawej) (75), a ich średnia wielkość jest jeszcze mniejsza od drobnopęcherzykowych polipów hiperplastycznych. Przykłady obrazów morfologicznych GCHP przedstawiono na rycinie 5.
A.
B.

C.
D.
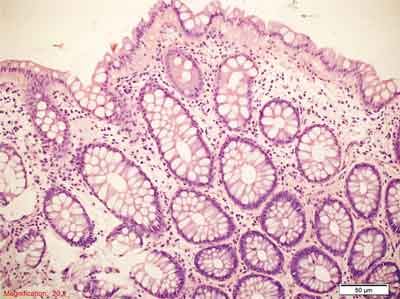
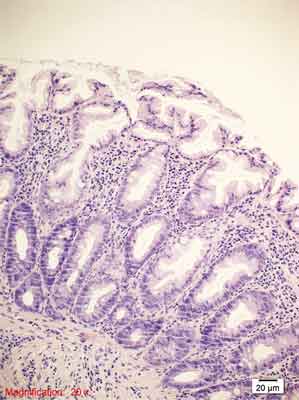
Rycina 5. Polip hiperplastyczny bogaty w komórki kubkowe (GCHP). Barwienie HE, A. – pow. 40x, B. – pow. 100x, C., D. – pow. 200x.
A., B. – Drobny polip GCHP. W górnej warstwie błony śluzowej widoczne poszerzenie przekrojów krypt jelitowych ze wzrostem liczby komórek kubkowych, brak ząbkowania.
C. – Bardzo liczne komórki kubkowe w rozrastających się kryptach jelitowych. Mało nasilone ząbkowanie na powierzchni błony śluzowej. Proliferacja dotyczy górnej połowy krypt.
D. – Pogrubienie błony podstawnej pod nabłonkiem pokrywnym jelita.
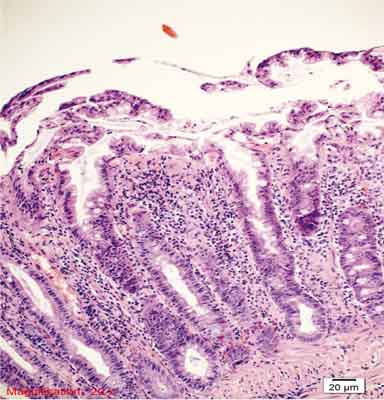
– polip hiperplastyczny ubogi w śluz (ang. mucin-poor hyperplastic polyp – MPHP) To najrzadszy i najmniej poznany podtyp polipa hiperplastycznego. Podobnie jak w MVHP krypty jelitowe ulegają wydłużeniu, a strefa proliferacyjna poszerzeniu. Ząbkowanie w polipach typu MPHP jest różnie nasilone i dotyczy górnej części krypty. Ma charakter drobnobrodawkowaty, ilość śluzu w komórkach jest zmniejszona, a liczba komórek kubkowych obniżona, czasem znacznie. Dystrybucja nielicznych komórek kubkowych jest chaotyczna, nie obserwuje się w nich figur podziału. Charakterystyczną cechą MPHP jest wyraźna atypia jądrowa oraz obecność komórek neuroendokrynnych z jasną cytoplazmą (22, 33, 34, 75). Widoczne cechy „pobudzenia” komórek nabłonka mogą być związane z naciekiem zapalnym, który często wypełnia blaszkę właściwą. Nie poznano jak dotąd natury zmian genetycznych MPHP. Z dotychczasowych obserwacji wynika, że MPHP występują po lewej stronie jelita grubego, a ich średnia wielkość jest porównywalna z MVHP. Przykłady obrazów morfologicznych MPHP przedstawiono na rycinie 6.
A.
B.

C.
D.

E.
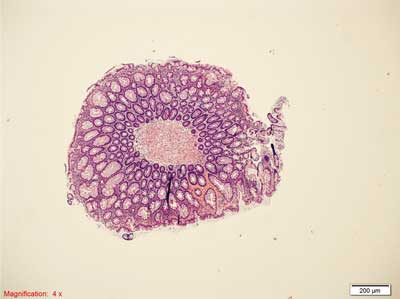
Rycina 6. Polip hiperplastyczny ubogi w śluz (MPHP). Barwienie HE, A. – pow. 40x, B. – pow. 100x, C. – pow. 200x, D. – pow. 400x, E. – pow. 200x.
A., B. – Przekroje przez cewy ze spłaszczonym nabłonkiem, komponent zapalny w blaszce właściwej błony śluzowej.
C. – Wąskie cewy, niewielka ilość śluzu w komórkach, drobnobrodawkowaty rozrost nabłonka cew gruczołowych, liczne komórki zapalne w blaszce właściwej.
D. – Cechy morfologiczne jak w podpunkcie C. oraz ogniskowo cechy atypii jądrowej (anizocytoza, heterochromazja, różna wysokość posadowienia jąder).
E. – Przekrój poprzeczny przez MPHP. Niewielka atypia, zmniejszenie ilości śluzu w komórkach.
W tabeli 2 przedstawiono porównanie najważnieszych cech morfologicznych i molekularnych podtypów polipów hiperplastycznych.
Tabela 2. Charakterystyka cech morfologicznych i molekularnych polipów hiperplastycznych (zmodyfikowane za Snover) (35).
| Podtyp polipa | Cechy morfologiczne | Zmiany genetyczne |
| Drobnopęcherzykowy polip hiperplastyczny (MVHP) | Proste krypty, wąskie podstawy, wyraźne ząbkowanie, śluz w drobnych pęcherzykach, mała liczba komórek kubkowych | Mutacja BRAF, niski CIMP, brak lub niska niestabilność mikrosatelitarna |
| Polip hiperplastyczny z dużą liczbą komórek kubkowych (GCHP) | Proste krypty, wąskie podstawy, niewielkie ząbkowanie, duża ilość śluzu w komórkach kubkowych | Mutacja KRAS, niski CIMP, brak lub niska niestabilność mikrosatelitarna |
| Polip hiperplastyczny ubogi w śluz (MPHP) | Proste krypty, wąskie podstawy, wyraźne ząbkowanie z drobnobrodawkowatymi strukturami, mało śluzu, hiperchromazja i nawarstwianie jąder, naciek zapalny w blaszce właściwej | Nieznane |
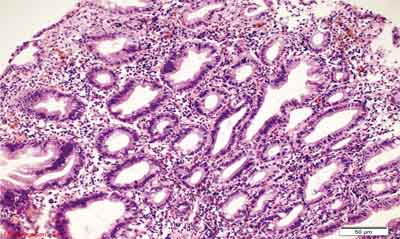
Siedzący polip ząbkowany (ang. sessile serrated polyp – SSP) – to z definicji zmiana siedząca (nieuszypułowana), zazwyczaj słabo oddzielona od otoczenia i może przypominać endoskopowo powiększone fałdy jelitowe (88). Główną cechą morfologiczną siedzących polipów ząbkowanych jest nieprawidłowa proliferacja, która prowadzi do zaburzeń architektonicznych widocznych zazwyczaj już pod małym powiększeniem. Krypty są wydłużone, a strefa proliferacyjna jest asymetryczna i nie zawsze położona w dolnych partiach krypt. Krypty ulegają poszerzeniu w części podstawnej, czasem są rozgałęzione, przyjmują także dziwaczne kształty w postaci litery L, odwróconej litery T czy butelki. Niektóre krypty układają się wręcz równolegle do blaszki mięśniowej błony śluzowej.
W dolnych częściach krypt pojawiają się dojrzałe komórki kubkowe oraz komórki fenotypowo przypominające nabłonek dołeczkowy żołądka. Ząbkowanie można zaobserwować w każdej części krypty, także u podstawy (34, 91, 92). Opisane zmiany zajmują często tylko jedno ramię krypty, co jeszcze bardziej podkreśla ich asymetrię. Inną ciekawą cechą siedzących polipów ząbkowanych jest przenikanie niektórych zmienionych krypt przez blaszkę mięśniową błony śluzowej do błony podśluzowej (ang. crypt herniation).
Nie obserwuje się natomiast typowego dla polipów hiperplastycznych pogrubienia błony podstawnej (63). Zaburzenia strukturalne nie dotyczą wszystkich krypt (63).
Autorzy przyjmują różne minimalne kryteria rozpoznania SSP. Według jednych SSP można rozpoznać, gdy opisane zmiany dotyczą dwóch lub trzech sąsiadujących krypt jelitowych (63), dla innych zmiany muszą być obecne w co najmniej dwóch, ale niekoniecznie sąsiadujących kryptach (78). Odzwierciedleniem zastosowania tych kryteriów jest różna częstość występowania SSP, co opisano w dalszej części pracy. Do zmian architektonicznych dołączają się raczej dyskretne zmiany cytologiczne w postaci niewielkiego nawarstwiania jąder, ich zaokrąglenia, pojawienia się rozrzedzenia chromatyny i jąderek. Cytoplazma komórek może być nieznacznie kwasochłonna. Mitozy mogą pojawiać się w środkowych i górnych partiach krypt, komórki neuroendokrynne są zazwyczaj nieobecne. Należy podkreślić, że do rozpoznania SSP niepotrzebna jest obecność zaburzeń cytologicznych jak w gruczolakach (tzw. gruczolakowaty typ dysplazji). Zmiana SSP jest zaliczana do polipów ząbkowanych bez dysplazji (28).
Siedzące polipy ząbkowane mają także określony profil molekularny zmian, do których należą częste mutacje w genie BRAF, obecność niestabilności mikrosatelitarnej oraz fenotyp metylatorowy CIMP (93). Uważa się, że SSP stanowią prekursory raka jelita grubego, rozwijającego się na szlaku neoplazji ząbkowanej. Cześć autorów sądzi nawet, że tego typu polipy szybciej ulegają przemianie do raka od konwencjonalnych gruczolaków, rozwijających się na szlaku neoplazji supresorowej (94). Profil molekularny zmian w SSP jest dość podobny do zaburzeń obserwowanych w polipach hiperplastycznych, zwłaszcza w podtypie MVHP. Spekuluje się, że MVHP może bezpośrednio poprzedzać rozwój SSP i być także faktycznie zmianą przednowotorową, a polipy te mogą stanowić kontinuum zmian morfologicznych (95, 96). Co ciekawe, to właśnie między polipami hiperplastycznymi z grupy MVHP a SSP przebiega linia diagnostyki różnicowej. Zmiany te mają wiele wspólnych cech, zwłaszcza w powierzchownych warstwach krypt. Podobieństwa są tym większe, im zmiana mniejsza (96), a do prawidłowego rozpoznania potrzebne są pełne, prostopadłe przekroje polipa, sięgające blaszki mięśniowej błony śluzowej. Badano także przydatność immunohistochemicznej ekspresji rodzajów śluzu do różnicowania polipów hiperplastycznych i siedzących polipów ząbkowanych, jednak panel obejmujący MUC2, MUC5AC i MUC6 nie jest wystarczająco specyficzny (97, 98). Ekspresja Ki67 w SSP jest nieciągła i niesymetryczna w obrębie indywidualnych krypt (99) i także nie jest przydatna w codziennej rutynowej pracy (34).
Rozpoznanie histopatologiczne pozostaje zatem złotym standardem diagnostycznym w różnicowaniu polipów ząbkowanych (96). Ma to kluczowe znaczenie w selekcji pacjentów, którzy poddani zostają nadzorowi endoskopowemu analogicznemu do konwencjonalnych gruczolaków (2 ,100).
Siedzące polipy ząbkowane są zazwyczaj zmianami większymi od polipów hiperplastycznych, występują częściej u kobiet i po prawej stronie jelita grubego (28, 33, 34, 79). Nowsze prace wskazują jednak, że wielkość SSP jest bardziej zróżnicowana i część z nich to zmiany ≤ 9 mm i ≤ 5 mm, w badaniu Gurudu to odpowiednio 69% i 42% (100). Częstość ich występowania, jak wspomniano, zależy od zastosowanych kryteriów rozpoznawczych oraz grup badanych i jest bardzo zróżnicowana. Podawane wartości rozpoczynają się od 1,7% wszystkich polipów (3,4% polipów ząbkowanych) (76), poprzez 1,9% (8,3% polipów ząbkowanych) (89), po nawet 9% wszystkich i 22% polipów ząbkowanych, jak podaje Spring (61). Pojawiły się także prace dotyczące ponownej oceny polipów uprzednio rozpoznawanych jako hiperplastyczne. Odsetek zmian, które uległy reklasyfikacji do kategorii siedzących polipów ząbkowanych sięga kilkunastu procent (101). Względnie niedawno ustalone kryteria oraz liczba cech analizowanych w obrazie morfologicznym sprawiają, że rozpoznanie siedzącego polipa ząbkowanego jest trudne, a współczynnik zgodności κ między patologami niski. W grupach niewyselekcjonowanych wynosi on 0,14 i wzrasta do 0,64 w zmianach powyżej 5 mm (102). W tabeli 3 przedstawiono podsumowanie najważniejszych cech morfologicznych SSP, a rycina 7 przedstawia typowe przykłady obrazów morfologicznych siedzących polipów ząbkowanych.
Tabela 3. Główne cechy morfologiczne siedzących polipów ząbkowanych (zmodyfikowane za Noffsinger) (33).
| Nieprawidłowa proliferacja/zaburzenia dojrzewania |
atypia jądrowa w środkowych i górnych strefach krypty
owalne jądra w środkowej strefie krypty
obecność jąderek w środkowej i górnej strefie krypty
dystroficzne komórki kubkowe
nieregularna dystrybucja komórek kubkowych
mitozy w środkowej i górnej strefie krypty |
| Zaburzenia architektoniczne |
poszerzenie części podstawnych krypt
poziome ułożenie krypt, krypty w kształcie odwróconej litery T, litery L, krypty butelkowate
nadmierne ząbkowanie na wszystkich poziomach
krypty odwrócone, rozgałęzione
krypty asymetryczne |
| Inne cechy |
brak pogrubienia błony podstawnej
przenikanie krypt przez muscularis mucosae |
A.

B.

C.

D.
E.
F.
G.
H.
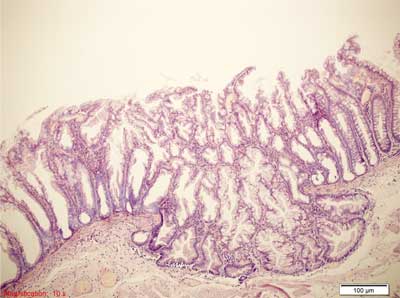
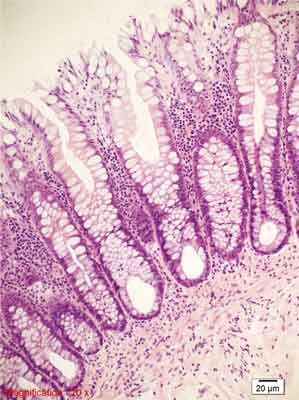
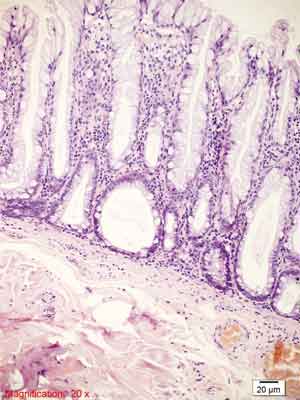
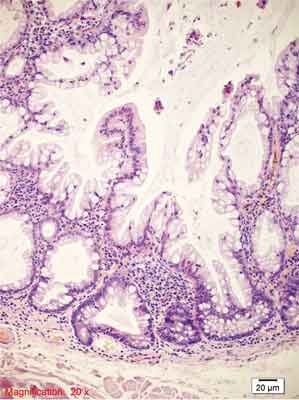
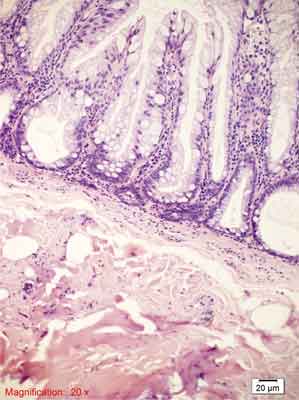
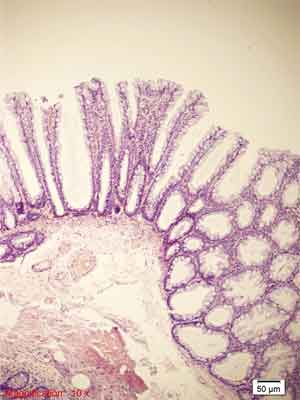
Rycina 7. Siedzący polip ząbkowany (SSP). Barwienie HE, A., B. – pow. 100x, C.-F. – pow. 200x, G., H. – pow. 100x.
A.-C. – Siedzący polip, proliferacja na całej długości krypty. Na zdjęciu A. widoczny rozrost adipocytów w błonie podśluzowej.
D.-F. – Rozrost dolnych części krypty, krypty w kształcie butelkowatym, buta, odwróconej litery T i L, komórki kubkowe na całej długości krypty, ząbkowanie w dolnej części krypty, przewężenia i rozgałęzienia krypt.
G. – Po lewej stronie przekrój prostopadły, z rozdętymi podstawami krypt. Po stronie prawej przekroje skośne, przypominające utkanie MVHP.
H. – Pseudoinwazja rozdętych, zmienionych krypt – wnikanie do błony podśluzowej (ang. crypt herniation). Poza tym obraz jak w typowym SSP.
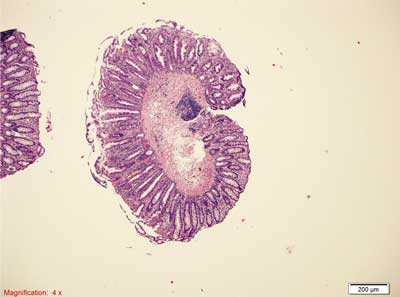
Tradycyjny gruczolak ząbkowany (ang. traditional serrated adenoma – TSA) opisany został w 1990 roku (73) i wówczas nazwany gruczolakiem ząbkowanym (ang. serrated adenoma).
W związku z rozwojem wiedzy o polipach ząbkowanych i wyróżnieniem kolejnych podtypów konieczne było dodanie przymiotnika „tradycyjny”, aby oddzielić TSA od polipów hiperplastycznych i SSP. Tradycyjny gruczolak ząbkowany to zazwyczaj egzofityczna struktura uszypułowana lub na szerokiej podstawie, która makroskopowo przypomina klasycznego gruczolaka. Mikroskopowo TSA cechuje się obecnością struktur cewkowych i kosmkowych, architektonicznie rozrastających się podobnie do polipów hiperplastycznych, a więc wykazujących ząbkowanie, czasem nawet nasilone. Unikalne dla TSA jest tworzenie ektopowych krypt, rosnących prostopadle do osi długiej kosmka. Krypty te nie mają kontaktu z blaszką mięśniową błony śluzowej, komórki ich aktywnie się dzielą (aktywność podziałowa TSA mierzona ekspresją Ki67 jest ograniczona właściwie do krypt ektopowych) (63, 103).
W odróżnieniu od polipów hiperplastycznych rozrastające się krypty pokryte są nabłonkiem gruczołowym, który wykazuje cechy dysplazji przypominające konwencjonalne gruczolaki. Jądra są powiększone, hiperchromatyczne, mają owalny lub wydłużony, ołówkowaty kształt i ulegają zazwyczaj niewielkiemu nawarstwianiu. Zlokalizowane są centralnie w komórce, której cechą charakterystyczną jest kwasochłonna cytoplazma. Większość tradycyjnych gruczolaków ząbkowanych wykazuje cechy dysplazji małego stopnia. Wykładnikami dysplazji dużego stopnia jest tłoczenie się cew z układami „plecy w plecy” oraz znaczne nawarstwianie się jąder komórkowych (83). Duże, położone dystalnie tradycyjne gruczolaki ząbkowane mają czasem wyraźnie palczastą powierzchnię, która wysłana jest nabłonkiem o ząbkowanych zarysach, z obecnością typowych zmian cytologicznych. Zmiany tę są często owrzodziałe, podścielisko wykazuje cechy znacznego obrzęku. W 2007 roku Yantiss i wsp. opisali serie takich przypadków, nazywając je palczastymi tradycyjnymi gruczolakami ząbkowanymi (104). W obrębie tradycyjnych gruczolaków ząbkowanych spotyka się wiele zmian genetycznych. Do częstych należy mutacja genu P53, część wykazuje niestabilność mikrosatelitarną i różnego stopnia metylację DNA. Również ekspresja MGMT jest obniżona w co najmniej 1/4 przypadków. Nieprawidłowości w funkcjonowaniu szlaku kinazy MAP występują w większości tradycyjnych gruczolaków ząbkowanych i mogą dotyczyć genów KRAS oraz rzadziej BRAF (22, 61, 90, 105, 106, 107, 108, 109, 110). Co ciekawe, w odróżnieniu od konwencjonalnych gruczolaków, tradycyjny gruczolak ząbkowany pozbawiony jest zmian w zakresie genu APC. Wydaje się więc, że tradycyjny gruczolak ząbkowany jest prekursorem raka jelita grubego, rozwijającego się na drodze neoplazji ząbkowanej. Ryzyko przemiany nowotworowej wydaje się podobne jak w konwencjonalnych gruczolakach (111, 112) i zależy od wielkości i lokalizacji zmiany (113).
Tradycyjny gruczolak ząbkowany jest zwykle dużą (> 1 cm) zmianą egzofityczną, występującą głównie po lewej stronie jelita grubego u osób starszych. Częstość występowania TSA jest niższa od SSP i oscyluje zazwyczaj poniżej 1% wszystkich zmian ząbkowanych (34, 35, 63, 76, 79). Diagnostyka różnicowa obejmuje zarówno inne zmiany ząbkowane, jak i konwencjonalne gruczolaki z ząbkowaną architekturą (79). Rycina 8 przedstawia obraz morfologiczny tradycyjnego gruczolaka ząbkowanego.
A.

B.

C.
D.

E.
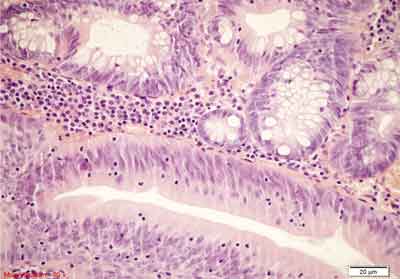
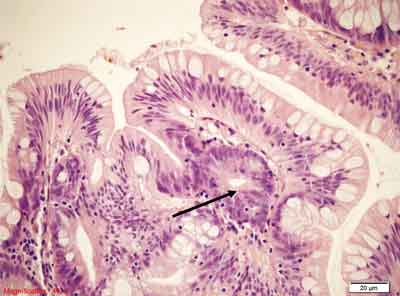
Rycina 8. Tradycyjny gruczolak ząbkowany (TSA). Barwienie HE, A. – pow. 40x, B. – pow. 100x, C.-E. – 400x.
Architektoniczne cechy polipa hiperplastycznego (rozrost brodawkowaty powierzchni, tworzenie struktur ząbkowanych) oraz cechy cytologiczne dysplazji gruczolakowatej (nawarstwianie, wydłużenie i hiperchromazja jąder). Zwraca uwagę kwasochłonność cytoplazmy. Centralne posadowienie jąder widoczne w C. oraz obecność krypt ektopowych (C., D. oznaczone strzałką).
Polip mieszany – jest to zmiana zawierająca współistniejące obok lub ściśle wymieszane utkanie polipa ząbkowanego bez dysplazji – polipa hiperplastycznego lub siedzącego polipa ząbkowanego ze zmianą dysplastyczną, czyli konwencjonalnym gruczolakiem lub tradycyjnym gruczolakiem ząbkowanym (29). Mieszane formy polipów są opisywane od wielu lat, począwszy od polipa hiperplastyczno-gruczolakowatego (72), poprzez zmiany z udziałem gruczolaka ząbkowanego (73), aż do zmian klasyfikowanych współcześnie (22, 33). Wydaje się, że polipy mieszane są w istocie homogenne genetycznie i powstają w wyniku odróżnicowania się części komórek w kierunku dysplazji typu gruczolakowatego w obszarze polipów ząbkowanych, zwłaszcza siedzącego polipa ząbkowanego (114). Można by je zatem nazwać siedzącym polipem ząbkowanym z dysplazją, co było zresztą proponowane przez niektórych autorów (22) i funkcjonuje w klasyfikacji WHO 2010. Polipy mieszane występują rzadko i stanowią prawdopodobnie poniżej 1% wszystkich polipów jelita grubego (22, 33).
Polipy ząbkowane stanowią zatem zróżnicowaną grupę polipów nabłonkowych, która poddawana jest intensywnym badaniom, mającym na celu poszerzenie i uszczegółowienie wiedzy. Rozpoznanie i właściwa klasyfikacja polipów ząbkowanych oparta jest na badaniu histopatologicznym. Ważnym elementem jest otrzymanie do badania pełnego, prawidłowo zatopionego przekroju, który zapewni możliwość oceny całej długości krypt jelitowych.
W przypadkach wątpliwych poleca się stosowanie określenia polip ząbkowany niesklasyfikowany, z podaniem przyczyny braku możliwości dokładniejszej charakterystyki oraz kręgu różnicowego.
Podział na polipy ząbkowane o prawidłowej proliferacji (polipy hiperplastyczne) i nieprawidłowej proliferacji (siedzący polip ząbkowany i tradycyjny gruczolak ząbkowany) ma nie tylko znaczenie nomenklaturowe, ale przede wszystkim kliniczne, gdyż zmiany z grupy SSP i TSA są zmianami przedrakowymi i wymagają nadzoru endoskopowego analogicznego do konwencjonalnych gruczolaków (2, 115). Literatura polskojęzyczna dotycząca polipów ząbkowanych jest bardzo uboga i obejmuje właściwie pojedyncze pozycje (85). Nie publikowano dotąd prac poświęconych rozpoznawaniu, częstości występowania oraz dystrubucji polipów ząbkowanych w populacji polskich pacjentów. Środowisko polskich patologów nie wypracowało także kryteriów diagnostycznych powszechnie stosowanych w naszym kraju.
Wczesne wykrywanie raka jelita grubego i zmian przedrakowych
Rak jelita grubego stanowi istotny problem zdrowotny, a w nadchodzących latach liczba chorych będzie się zwiększać (116). Badania randomizowane wykazały, że systematyczne prowadzenie populacyjnych programów badań przesiewowych w kierunku wykrywania raka jelita grubego u pacjentów w określonym wieku prowadzi do zmniejszenia liczby zachorowań dzięki wykrywaniu zmian bezobjawowych (117, 118, 119). Do powszechnie stosowanych w badaniach przesiewowych metod należą badanie krwi utajonej w kale oraz badania endoskopowe jelita grubego (sigmoidoskopia i kolonoskopia) (120, 121, 122, 123, 124). Badania endoskopowe umożliwiają także usuwanie zmian przedrakowych, które potencjalnie mogłyby ulec przemianie złośliwej (2). Opierając się na powyższych badaniach Rada Komisji Unii Europejskiej wydała w 2003 roku zalecenia dotyczące prowadzenia wysokiej jakości badań przesiewowych w kierunku wykrywania raka jelita grubego (125). Badania takie powinny być wykonywane zgodnie z Europejskimi Wytycznymi do Spraw Zapewnienia Jakości (ang. European Quality Assurance Guidelines), które zostały wypracowane i zaproponowane przez ekspertów we współpracy z Międzynarodową Agencją Badania Raka (ang. International Agency for Research on Cancer). Komisja Europejska zachęca wszystkie kraje biorące udział w badaniach przesiewowych do stosowania powyższych wytycznych. Zapewni to, oprócz najwyższej jakości oferowanych usług, także właściwy przepływ informacji, tworzenie baz danych i paneuropejskich raportów dotyczących epidemiologii raka jelita grubego. Autorzy wskazują także na obszary zagadnień, wymagające dalszych intesywnych badań (34). Należy do nich szlak neoplazji ząbkowanej i cała grupa polipów i zmian ząbkowanych, których diagnostyka histopatologiczna jest trudna, a potencjał onkogenny nie w pełni określony.
W Polsce od 2000 roku prowadzony jest program badań przesiewowych w kierunku wykrywania raka jelita grubego. Polscy eksperci brali czynny udział w pracach Komisji Europejskiej, a krajowe ośrodki ściśle współpracują ze sobą oraz z partnerami z innych krajów w kwestii przestrzegania zaleceń.
CEL PRACY
1. Ocena morfologii polipów ząbkowanych w populacji osób objętych programem badań przesiewowych z rejonu warszawskiego, poddanych badaniu kolonoskopowemu w Centrum Onkologii-Instytucie w Warszawie w latach 2000-2004:
– ocena typów histopatologicznych polipów ząbkowanych u poszczególnych płci, w różnych kategoriach wiekowych i lokalizacjach anatomicznych oraz dla różnych wielkości zmian,
– ocena współwystępowania kategorii histopatologicznych polipów ząbkowanych u poszczególnych płci, w różnych kategoriach wiekowych i lokalizacjach anatomicznych oraz dla różnych wielkości zmian,
– ocena współwystępowania gruczolaków konwencjonalnych u osób z polipami ząbkowanymi.
2. Poszukiwanie czynników predykcyjnych występowania poszczególnych kategorii histopatologicznych polipów ząbkowanych:
– polipów hiperplastycznych ogółem oraz ich podtypów morfologicznych,
– siedzących polipów ząbkowanych,
– tradycyjnych gruczolaków ząbkowanych.
3. Ocena ryzyka rozwoju raka jelita grubego u pacjentów z polipami ząbkowanymi na podstawie analizy występowania raków interwałowych.
MATERIAŁy I METODY
Materiały
Materiał do analizy stanowiła baza danych wyników badań przesiewowych przeprowadzonych w Centrum Onkologii-Instytucie im. Marii Skłodowskiej-Curie w latach 2000-2004. Badania kolonoskopowe zostały przeprowadzone w Klinice Gastroenterologii Centrum Onkologii, zgodnie z założeniami określonymi w Programie Ministerstwa Zdrowia (126). Dane bazy Programu Badań Przesiewowych (PBP) zostały zapisane w postaci cyfrowej, w postaci plików arkusza kalkulacyjnego Microsoft Excel 2003 oraz bazy danych Microsoft Access 2003. Baza ta obejmuje osoby bez objawów klinicznych ze strony przewodu pokarmowego, poddane kolonoskopii przesiewowej w ramach ogólnopolskiego Programu Badań Przesiewowych w kierunku wczesnego wykrywania raka jelita grubego, będącego częścią Narodowego Programu Zwalczania Chorób Nowotworowych. Program adresowany jest do osób bez objawów klinicznych raka jelita grubego, w wieku pomiędzy 50. a 65. r.ż., a także osób w wieku 40-49 lat, u których w rodzinie występowały przypadki nowotworów. Baza danych obejmowała 10 507 kolonoskopii. Wyszukano wszystkie rekordy obejmujące określenia „polip hiperplastyczny” i „ząbkowany” w opisach utkania histopatologicznego. U osób z tej grupy wyszukano także rekordy z opisami konwencjonalnych gruczolaków. Wykluczono z analizy pacjentów z zespołami polipowatości oraz rekordy, w których pojawiły się rozpoznania histopatologiczne innych polipów, takich jak polipy hamartomatyczne, zapalne czy inne. W archiwum Zakładu Patologii wyszukano preparaty histopatologiczne. W sytuacji braku lub niewystarczającej jakości preparatu odszukiwano bloczek parafinowy i odtwarzano preparat histopatologiczny. Ostateczna grupa objęła 2970 polipów ząbkowanych pobranych od 1597 pacjentów. U 181 pacjentów występowały także gruczolaki konwencjonalne, które włączono do analizy statystycznej.
Metody
Wszystkie 2970 polipów poddano ponownej ocenie histopatologicznej. Zgodnie z obowiązującymi i opisanymi we Wstępie kryteriami wyróżniono pięć kategorii histopatologicznych:
– drobnopęcherzykowe polipy hipeplastyczne (Kategoria 1 MVHP),
– polipy hiperplastyczne z licznymi komórkami kubkowymi (Katergoria 2 GCHP),
– ubogie w śluz polipy hiperplastyczne (Katergoria 3 MPHP),
– siedzące polipy ząbkowane (Kategoria 4 SSP),
– tradycyjne gruczolaki ząbkowane (Kategoria 5 TSA).
Dla rozpoznania SSP wymagana była obecność co najmniej 4 cech morfologicznych,w tym co najmniej trzech z grupy zaburzeń architektonicznych w dwóch lub więcej sąsiadujących ze sobą kryptach jelitowych.
Każdą zmianę scharakteryzowano uwzględniając jej:
– wielkość,
– lokalizację,
– płeć,
– wiek pacjenta.
W większości przypadków wielkość zmiany była zmierzona przez endoskopistę wykonującego badanie, w przypadku braku danych pomiaru dokonywano na podstawie preparatu histopatologicznego.
Wielkość kategoryzowano następująco:
– 0-5 mm,
– 6-10 mm
– powyżej 10 mm.
Kategorie lokalizacyjne potraktowano szczegółowo, wyróżniając następujące:
– odbytnica,
– esica,
– zstępnica,
– poprzecznica,
– wstępnica,
– kątnica.
Dodatkowo przeprowadzono analizy z zastosowaniem podziału lokalizacji na proksymalne i dystalne, według dwóch stosowanych w literaturze definicji proksymalności. Pierwszy podział, zgodny ze stosowanym w badaniach endoskopowych, do grupy zmian proksymalnych zalicza polipy kątnicy, wstępnicy, poprzecznicy i zstępnicy. Drugi, odnoszący się do topografii krezki jelita i pochodzenia embriologicznego, granicę proksymalności stawia w zagięciu śledzionowym. Podział na część proksymalną i dystalną jelita grubego ma także uzasadnienie w prawdopodobnej różnicy patogenetycznej rozwoju raka jelita grubego i wrażliwości na stosowane leczenie chemiczne (127, 128, 129, 130, 131, 132).
W analizach zastosowano podział na następujące kategorie wiekowe:
– 40-44,
– 45-49,
– 50-54,
– 55-59,
– 60-64,
– 65-66.
U wszystkich osób w analizowanej grupie przeprowadzono „follow-up” w celu identyfikacji przypadków raka jelita grubego w okresie do 2010 roku (tj. od 10 do 6 lat od chwili badania przesiewowego). Przeszukano bazy danych Krajowego Rejestru Nowotworów, ustalono czas rozpoznania, diagnozę histopatologiczną i dokładną lokalizację raka jelita grubego. Dane te porównano z liczbą raków interwałowych w całej grupie osób poddawanych badaniu przesiewowemu z całego kraju z analogicznego okresu lat 2000-2004.
Metody statystyczne
Charakterystyka ogólna – statystyki opisowe
Wykonano analizy „per patient” dotyczące relacji występowania polipów ząbkowanych względem lokalizacji, wielkości, płci i wieku, i współwystępowania gruczolaków, jak również analizy „per polyp” odnoszące się do lokalizacji i wielkości.
Modele wieloczynnikowe
Związek pomiędzy rozważanymi czynnikami a wystąpieniem danego podtypu histologicznego polipa ząbkowanego zbadano przy pomocy wieloczynnikowych modeli logitowych.
W modelach uwzględniono:
– wiek,
– płeć,
– wielkość zmiany,
– współwystępowanie gruczolaków,
– lokalizację.
Dopasowanie modeli sprawdzono przy pomocy testu Hosmera-Lemeshowa.
Za poziom istotności statystycznej przyjęto 5%.
WYNIKI
Ogólna charakterystyka osób z polipami ząbkowanymi
W ocenianej kohorcie znalazło się 1597 osób w wieku od 40 do 66 lat (średnia wieku 55,23 lat). W grupie tej było 652 mężczyzn (40,83%) i 945 kobiet (59,17%). Łącznie u pacjentów stwierdzono 2970 polipów ząbkowanych. U 181 pacjentów stwierdzono także obecność konwencjonalnych gruczolaków jelita grubego. W tabelach 4 i 5 zestawiono dane dotyczące częstości występowania polipów ząbkowanych w zależności od płci i wieku pacjenta.
Tabela 4. Częstość występowania poszczególnych kategorii histopatologicznych polipów ząbkowanych w zależności od płci pacjenta. Podane odsetki nie sumują się do 100% ze względu na współwystępowanie różnych typów polipów ząbkowanych u jednej osoby.
| | MVHP | GCHP | MPHP | SSP | TSA |
| Mężczyzna | 415
(63,65%) | 234
(35,89%) | 74
(11,35%) | 18
(2,76%) | 12
(1,84%) |
| Kobieta | 659
(69,74%) | 267
(28,25%) | 108
(11,43%) | 28
(2,96%) | 15
(1,59%) |
| Łącznie | 1074
(67,25%) | 501
(31,37%) | 182
(11,40%) | 46
(2,88%) | 27
(1,69%) |
Tabela 5. Częstość występowania poszczególnych kategorii histopatologicznych polipów ząbkowanych w zależności od wieku pacjenta. Podane odsetki nie sumują się do 100% ze względu na współwystępowanie różnych typów polipów ząbkowanych u jednej osoby.
| | MVHP | GCHP | MPHP | SSP | TSA |
| 40-44 r.ż. | 44
(83,02%) | 13
(24,53%) | 4
(7,55%) | 1
(1,89%) | 0 |
| 45-49 r.ż. | 127
(85,81%) | 24
(16,22%) | 7
(4,73%) | 2
(1,35%) | 2
(1,35%) |
| 50-54 r.ż. | 358
(67,67%) | 163
(30,81%) | 69
(13,04%) | 14
(2,65%) | 5
(0.95%) |
| 55-59 r.ż. | 330
(68,46%) | 167
(34,65%) | 42
(8,71%) | 10
(2,07%) | 9
(1,87%) |
| 60-64 r.ż. | 178
(55,45%) | 115
(35,83%) | 42
(13,08%) | 15
(4,67%) | 9
(2,80%) |
| 65-66 r.ż. | 37
(57,81%) | 19
(29,69%) | 18
(28,13%) | 4
(6,25%) | 2
(3,13%) |
| Łącznie | 1074
(67,25%) | 501
(31,37%) | 182
(11,40%) | 46
(2,88%) | 27
(1,69%) |
Rozkład poszczególnych typów polipów ząbkowanych pomiędzy płciami jest dość równomierny. U 63% mężczyzn i 69% kobiet znaleziono co najmniej jednego polipa typu MVHP. Odsetek ten w przypadku polipów typu GCHP i MPHP wyniósł odpwiednio 35% i 28% oraz po 11%. Dane te odzwierciedlają malejące liczby bezwzględne poszczególnych typów, według których polipów typu GCHP jest ponad dwa razy mniej niż MVHP, a polipów typu MPHP ponad 7 razy mniej od najczęstszego typu polipów ząbkowanych. W analizowanym materiale rozkład siedzących polipów ząbkowanych (SSP) pomiędzy płciami był równomierny, a odsetek pacjentów z co najmniej jednym SSP był prawie taki sam u mężczyzn i kobiet (odpowiednio 2,76% i 2,96%). Również tradycyjne gruczolaki ząbkowane występowały podobnie często u obu płci.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Ferlay J, Shin HR, Bray F et al.: GLOBOCAN 2008, Cancer incidence and mortality worldwide. 2010 IARC CancerBase No. 10. International Agency for Research on Cancer, Lyon.
2. Quirke P, Risio M, Lambert R et al.: Quality assurance in pathology in colorectal cancer screening and diagnosis – European recommendations. Virchows Arch 2011; 458:1-19.
3. Jemal A, Murray T, Samuel A et al.: Cancer Statistics 2003. CA Cancer J Clin 2003; 53: 5-26.
4. Didkowska J, Wojciechowska U, Zatoński W: Nowotwory złośliwe w Polsce w 2010 roku. Centrum Onkologii-Instytut, Warszawa 2012.
5. Grady WM: Epigenetic events in the colorectum and in colon cancer. Biochem Soc Trans 2005; 33: 684-8.
6. Olschwang S, Hamelin R, Laurent-Puig P et al.: Alternative genetic pathways in colorectal carcinogenesis. Proc Natl Acad Sci USA 1997; 94: 12122-7.
7. Salahshor S, Kressner U, Pahlman L et al.: Colorectal cancer with and without microsatellite instability involves different genes. Genes Chromosomes Cancer 1999; 26: 247-52.
8. Jass JR: Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology 2007; 50: 113-30.
9. Reguła J, Rupiński M, Kraszewska E et al.: Colonoscopy in colorectal-cancer screening for detection of advanced neoplasia. N Eng J Med 2006; 355: 1863-1872.
10. Citarda F, Tomaselli G, Capocaccia R et al.: Efficacy in standard clinical practice of colonoscopic polypectomy in reducing colorectal cancer incidence. Gut 2001; 48: 812-5.
11. Frazier AL, Colditz GA, Fuchs CS et al.: Cost-effectiveness of screening for colorectal cancer in the general population. J Am Med Assoc 2000; 284: 1954-61.
12. Lieberman D: Colon cancer screening and surveillance controversies. Curr Opin Gastroenterol 2009; 25: 422-7.
13. Winawer SJ, Zauber AG, Ho MN et al.: Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993; 329: 1977-81.
14. Hewett DG, Kahi CJ, Rex DK: Does colonoscopy work? J Natl Compr Canc Netw 2010; 8: 67-76.
15. Kaminski MF, Regula J: Colorectal cancer screening by colonoscopy-current issues. Digestion 2007; 76: 20-5.
16. Kudo S, Lambert R, Allen J et al.: Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointest Endosc 2008; 68: S3-47.
17. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach and colon. Gastrointest Endosc 2003; 58 (suppl 6): S3-43.
18. Muto T, Bussey HJR, Morson BCM: The evolution of cancer of the colon and rectum. Cancer 1975; 36: 2251-70.
19. Shinya H, Wolff WI: Morphology, anatomic distribution and cancer potential of colonic polyps. Ann Surg 1979; 190: 679-83.
20. Konishi F, Morson BC: Pathology of colorectal adenomas: A colonoscopic survey. J Clin Pathol 1982; 35: 830-41.
21. Fearon ER, Vogelstein B: A genetic model for colorectal tumorigenesis. Cell 1990; 61: 759-67.
22. Yantiss RK: Serrated colorectal polyps and the serrated neoplastic pathway: Emerging concepts in colorectal carcinogenesis. Cur Diag Pathol 2007; 13: 456-66.
23. Vogelstein B, Fearon ER, Hamilton SR et al.: Genetic alterations during colorectal-tumor development. N Engl J Med 1988; 319: 525-32.
24. Hamilton SR: The adenoma-adenocarcinoma sequence in the large bowel: variations on a theme. J Cell Biochem Suppl 1992; 16G: 41-6.
25. Nascimbeni R, Villanaci V, Mariani PP et al.: Abberant crypt foci in the human colon. Frequency and histologic patterns in patients with colorectal cancer and diverticular disease. Am J Surg Pathol 1999; 23: 1256-63.
26. Cheng L, Lai MD: Aberrant crypt foci as microscopic precursors of colorectal cancer. World J Gastroenterol 2003; 9: 2642-9.
27. Riddell RH, Goldman H, Ranshoff DF et al.: Dysplasia in inflammatory bowel disease: standardized classification with provisional clinical applications. Hum Pathol 1983; 14: 931-68.
28. Hornick JL, Odze RD: Polyps of the large intestine. In: Surgical Pathology of the GI Tract, Liver, Biliary Tract, and Pancreas. Odze RD, Goldblum JR (eds). 2nd ed. Saunders Elsevier 2009; 498-520.
29. WHO (2010) Serrated polyps of the colon and rectum and serrated polyposis. in Classification of tumours of the digestive system. Snover DC, Ahnen DJ, Burt RW and Odze RD. International Agency for Research on Cancer, IARC, Lyon, 160-165.
30. Stolte M: The new Vienna classification of the epithelial neoplasia of gastrointestinal tract: advantages and disadvantages. Virchow Arch 2003; 422: 99-106.
31. Schlemper RJ, Riddell RH, Kato Y et al.: The Vienna classification of gastrointestinal epithelial neoplasia. Gut 2000; 47: 251-55.
32. Gschwantler M, Kriwanek S, Langner E et al.: High-grade dysplasia and invasive carcinoma in colorectal adenomas: a multivariate analysis of the impact of adenoma and patient characteristics. Eur J Gastroenterol Hepatol 2002; 14: 183-8.
33. Noffsinger AE: Serrated polyps and colorectal cancer: new pathway to malignancy. Annu Rev Pathol 2009; 4: 343-64.
34. Snover DC, Jass JR, Fenoglio-Preiser C et al.: Serrated polyps of the large intestine: a morphologic and molecular review of an evolving concept. Am J Clin Pathol 2005; 124: 380- 91.
35. Snover DC: Serrated polyps of the large intestine. Semin Diagn Pathol 2005; 22: 301-8.
36. Leggett B, Whitehall V: Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology 2010; 138: 2088-100.
37. Jass JR, Young J, Leggett BA: Hyperplastic polyps and DNA microsatellite unstable cancers of the colorectum. Histopathology 2000; 37: 295-301.
38. Huang CS, O’brien MJ, Yang S, Farraye FA: Hyperplastic polyps, serrated adenomas, and the serrated polyp neoplasia pathway. Am J Gastroenterol 2004; 99: 2242-55.
39. Young J and Jass JR: The case of a genetic predisposition to serrated neoplasia in the colorectum: Hypothesis and review of the literature. Biomarkers Prev 2006; 15: 1778-84.
40. Jass JR: Hyperplastic Polyps and Colorectal Cancer: Is There a Link? Clin Gastroenterol Hepatol 2004; 2: 1-8.
41. Jass JR, Whitehall LJ, Young J, Leggett B: Emerging concepts in colorectal neoplasia. Gastroenterology 2002; 123: 862-76.
42. O’Brien MJ, Yang S, Mack C et al.: Comparison of microsatellite instability, CpG island methylation phenotype, BRAF and KRAS status in serrated polyps and traditional adenomas indicates separate pathways to distinct colorectal carcinoma end points. Am J Surg Pathol 2006; 30: 1491-501.
43. Toyota M, Ahuja N, Ohe-Toyota M et al.: CpG island methylator phenotype in colorectal cancer. Proc Natl Acad Sci 1999; 96: 8681-86.
44. Dong SM, Lee EJ, Jeon ES et al.: Progressive methylation during the serrated neoplasia pathway of the colorectum. Mod Pathol 2005; 18: 170-178.
45. Laiho P, Kokko A, Vanharanta S et al.: Serrated carcinomas form a subclass of colorectalcancer with distinct molecular basis. Oncogene 2007; 26: 312-20.
46. O’Brien MJ, Shi Y, Clebanoff JL et al.: Hyperplastic (serrated ) polyps of the colorectum. Relationship of the CpG island methylation phenotype and K-ras mutation to location and histologic subtype. Am J Surg Pathol 2004; 28: 423-34.
47. Mc Givern A, Wynter CV, Whitehall VL et al.: Promoter hypermethylation frequency and BRAF mutations distinguish hereditary nonpolyposis colon cancer syndrome from sporadic MSH-H colon cancer. Fam Cancer 2004; 3: 101-7.
48. Oh K, Redston M and Odze RD: Support for hMLH1 and MGMT silencing as a mechanism of yumorigenesis in the hyperplastic-adenoma-carcinoma (serrated) carcinogenic pathway in the colon. Hum Pathol 2005; 36: 101-11.
49. Young J, Simms LA, Biden KG et al.: Features of colorectal cancers withg high level microsatellite instability occurring in familial and nonfamilial settings: parallel pathways of yumorigenesis. Am J Pathol 2001; 159: 2107-16.
50. Whitehall VL, Walsh MD, Young J et al.: Methylation of O-6-methylguanine-DNA transferase characterizes a subset of colorectal cancer with lowlevel DNA instability. Cancer Res 2001; 61: 827-30.
51. Noda H, Kato Y, Yoshikawa H et al.: Microsatellite instatility caused by hMLH1 promoter methylation increases with tumor progression in right-sided sporadic colorectal cancer. Oncology 2005; 69: 354-62.
52. Kuismanen SA, Homberg MT, Salovaara R et al.: Genetic and epigenetic modification of MLH1 accounts for a major share of microsatellite-unstable colorectal cancers. Am J Pathol 2000; 156: 1773-9.
53. Whitehall VL, Wynter CV, Walsh MD et al.: Morphological and molecular heterogeneity within nonmicrosatellite instability-high colorectal cancer. Cancer Res 2002; 62: 6011-14.
54. Kambara T, Simms L, Whitehall VLJ et al.: BRAF mutation and CpG island methylation: an alternative pathway to colorectal cancer. Gut 2004; 53: 1137-44.
55. Hawkins N, Norrie M, Cheong K et al.: CpG island methylation in sporadic colorectal cancer and its relationship to microsatellite instability. Gastroeneterology 2002; 122: 1376-87.
56. Beach R, Chan AO, Wu TT et al.: BRAF mutations in aberrant crypt foci and hyperplastic polyposis. Am J Pathol 2005; 166: 1069-75.
57. Davies H, Bignell GR, Cox C et al.: Mutations of the BRAF gene in human cancer. Nature 2002; 417: 949-54.
58. Rajagopalan H, Bardelli A, Lengauer C et al.: Tumorigenesis: RAF/RAS oncogenes and mismatch repair status. Nature 2002; 418: 934.
59. Yuen ST, Davies H, Chan TL et al.: Similarity of the phenotypic patterns associated with the BRAF and KRAS mutations in colorectal neoplasia. Cancer Res 2002; 62: 6451-55.
60. Weisenberger DJ, Siegmund KD, Campan M et al.: CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer. Nat Genet 2006; 38: 787-93.
61. Spring KJ, Zhao ZZ, Karamatic R et al.: High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoimg colonoscopy. Gastroenterology 2006; 131: 1400-07.
62. Goldstein NS: Serrated pathway and APC (conventional)-type colorectal polyps: molecular morphologic correlations, genetic patways and implications for classification. Am J Clin Pathol 2006; 125: 146-53.
63. Ensari A, Bosman FT, Offerhaus GJA: The serrated polyps – getting it right! J Clin Pathol 2010; 63: 665-8.
64. Jass JR, Whitehall VLJ, Zoung J, Legget BA: Emerging concepts in colorectal neoplasia. Gastroenterology 2002; 123: 862-76.
65. Rubio CA, Jaramillo E: Flat serrated adenomas of the colorectal mucosa. Jpn J Cancer Res 1996; 87: 305-9.
66. Li SC, Burgart L: Histopathology of serrated adenoma, its variants, and differentiation from conventional adenomatous and hyperplastic polyps. Arch Pathol Lab Med 2007; 1331: 440-45.
67. Goldman H, Ming S, Hickok DF: Nature and significance of hyperplastic polyps of the human colorectum. Arch Pathol 1970; 89: 349-54.
68. Azimuddin K, Stasik JJ, Khubchandani IT et al.: Hyperplastic polyps: “more than meet the eyes”? Report of sixteen cases. Dis Colon Rectum 2003; 43: 1309-13.
69. Warner AS, Glick ME, Fogt E: Multiple large hyperplastic polyps of the colon coincident with adenocarcinoma. Am J Gastroenterol 1994; 89: 123-5.
70. Eide TJ: Prevalance and morphological features of adenomas of the large intestine in individuals with and without colorectal carcinoma. Histopathology 1986; 10: 111-8.
71. Sumner HW, Wasserman NF, McClain CJ: Giant hyperplastic polyposis of the colon. Dig Dis Sci 1981; 26: 85-89.
72. Urbanski SJ, Marcon N, Kossakowska AE, Burce WR: Mixed hyperplastic adenomatous polyps – an underdiagnosed entity. Am J Surg Pathol 1984; 8: 551-6.
73. Longacre TA, Fenoglio-Preiser CM: Mixed hyperplastic adenomatous polyps/serrated adenomas: A distinct form of colorectal neoplasia. Am J Surg Pathol 1990; 14: 524-37.
74. Torlakovic E and Snover DC: Serrated adenomatous polyposis in humans. Gastroenterology 1996; 110: 748-755.
75. Torlakovic E, Skovland E, Snover DC et al.: Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol 2003; 27: 65-81.
76. Lash RH, Genta RM, Schuler CM: Sessile serrated adenomas: prevalence of dysplasia and carcinoma in 2139 patients. J Clin Pathol 2010; 63: 681-6.
77. Sugumar A, Sinicrope FA: Serrated polyps of the colon. F1000 Medicine Reports 2010; 2: 89.
78. Aust DE, Baretton GB, Members of the Working Group GI-Pathology of the German Society of Pathology: Serrated polyps of the colon and rectum (hyperplastic polyps, sessile serrated adenomas, traditional serrated adenomas and mixed polyps) – proposal for diagnostic criteria. Virchows Arch 2010; 457: 291-7.
79. Orłowska J: Serrated polyps of the colorectum: histological classification and clinical significance. Pol J Pathol 2010; 1: 8-22.
80. Ferrández A, Samowitz W, DiSario JA, Burt RW: Phenotypic characteristics and risk of cancer development in hyperplastic polyposis: case series and literature review. Am J Gastroenterol 2004; 99: 2012-18.
81. Hawkins NJ, Gorman P, Tomlinson IP et al.: Colorectal carcinomas arising in hyperplastic polyposis syndrome progress through chromosomal instability pathway. Am J Pathol 2000; 157: 385-392.
82. Hyman NH, Anderson P, Blasyk H: Hyperplastic polyposis and the risk of the colon cancer. Dis Colon Rectum 2004; 47: 2101-4.
83. Jass JR: Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology 2007; 50: 113-30.
84. Jass JR, Iino H, Ruszkiewicz A et al.: Neoplastic progression occurs through mutator pathways in hyperplastic polyposis of the colorectum. Gut 2000; 47: 43-9.
85. Orlowska J, Kiedrowski M, Kaminski MF et al.: Hyperplastic polyposis syndrome in asymptomatic patients: the results from the colorectal-cancer screening program. Virchows Arch 2009, 455 (Suppl. 1): S47.
86. Boparai KS, Mathus-Vliegen EM, Koornstra JJ et al.: Increased colorectal cancer risk during follow-up in patients with hyperplastic polyposis syndrome: a multicentre cohort study. Gut 2010; 59: 1094-100.
87. Young J, Jenkins M, Parry S et al.: Serrated pathway colorectal cancer in the population: genetic consideration. Gut 2007; 15: 1453-1459.
88. DiSario JA, Foutch PG, Mai HD et al.: Prevalence and malignant potential of colorectal polyps in asymptomatic, avarge-risk men. Am J Gastroenterol 1991; 32: 641-52.
89. Higuchi T, Sugihara K, Jass JR: Dempgraphic and pathological characteristics of serrated polyps of the colorectum. Histopathology 2005; 47: 32-40.
90. Yang S, Farraye FA, Mack C et al.: BRAF and KRAS mutations in hyperplastic polyps, and serrated adenomas of the colorectum: relationship to histology and CpG island methylation status. Am J Surg Pathol 2004; 28: 1452-9.
91. Goldstein NS: Small colonic microsatelite instable adenocarcinomas and high-grade epithelial dysplasias in sessile serrated adenoma polypectomy specimens: a study of eight cases. Am J Clin Pathol 2006; 125: 132-45.
92. Torlakovic M, Snover DC: Sessile serrated adenoma: brief history and current status. Critical Reviews in Oncogenesis 2006; 12: 27-39.
93. Gurianos C, Sanchez-Fortun C, Rodriguez-Solez M et al.: Serrated polyposis syndrome: molecular, pathological and clinical aspects. World J Gastroenterol 2012; 18(20): 2452-61.
94. Oono Y, Fu K, Nakamura H et al.: Progression of sessile serrated adenoma to early invasive cancer within 8 months. Dig Dis Sci 2009; 54: 906-9.
95. Sandmeier D, Benhattar J, Martin P, Bouzourene H: Serrated polyps of the large intestine: a molecular study comparing sessile serrated adenomas and hyperplastic polyps. Histopathology 2009; 55: 206-13.
96. Sandmeier D, Seelentag W, Bouzourene H: Serrated polyps of the colorectum: is sessile serrated adenoma distinguishable from hyperplastic polyp in daily practice? Virchows Arch 2007; 450: 613-18.
97. Hirano H, Ajioka Y, Watanabe H et al.: Bidirectional gastric differentiation in cellular mucin phenotype (foveolar and pyloric) in serrated adenoma and hyperplastic polyp of the colorectum. Pathol Int 2004; 54: 401-7.
98. Mochizuka A, Uehara T, Nakamura T et al.: Hyperplastic polyps and sessile serrated adenomas of the colon and rectum display gastric pyloric differentiation. Histochem Cell Biol 2007; 128: 445-55.
99. Torlakovic EE, Gomez JD, Driman DK et al.: Sessile serrated adenoma (SSA) versus traditional serrated adenoma (TSA). Am J Surg Pathol 2008; 32: 21-29.
100. Gurudu SR, Heigh RI, De Petris G et al.: Sessile serrated adenomas: Demographic, endoscopic and pathological characteristics. World J Gastroenerol 2012; 21: 3402-05.
101. Khalid O, Radaideh S, Cummings OW et al.: Reinterpretation of histology of proximal colon polyps called hyperplastic in 2001. World J Gastroenterol 2009; 14; 15: 3767-70.
102. Bustamante-Balen M, Bernet L, Cano R et al.: Assessing the reproducibility of the microscopic diagnosis of sessile serrated adenoma of the colon. Rev Esp Enferm Dig 2009; 4: 258-64.
103. Haramis AP, Begthel H, van der Barn M et al.: De novo crypt formation and juvenile polyposis on BMP inhibition in the mouse intestine. Science 2004; 303: 1684-6.
104. Yantiss RK, Oh KY, Chen YT et al.: “Filiform” serrated adenomas. A clinicopathologic and immunophenotypic study of 18 cases. Am J Surg Pathol 2007; 31: 1238-45.
105. Dehari R: Infrequent APC mutations in serrated adenoma. Tohoku J Exp Med 2001; 193: 181-6.
106. Hiyama T, Yokozaki H, Shimamoto F et al.: Frequent p53 gene mutations in serrated adenomas of the colorectum. J Pathol 1998; 186: 131-9.
107. Oh K, Redston M, Odze RD: Support for hMLH1 and MGMT silencing as a mechanism of tumorigenesis in the hyperplastic-adenoma-carcinoma (serrated) carcinogenic pathway in the colon. Hum Pathol 2005; 36: 101-11.
108. Dong SM, Lee EJ, Jeon ES et al.: Progressive methylation during the serrated neoplasia pathway of the colorectum. Mod Pathol 2005; 18: 170-8.
109. Park SJ, Rashid A, Lee JH et al.: Frequent CpG island methylation in serrated adenomas of the colorectum. Am J Pathol 2003; 162: 815-22.
110. Lee EJ, Choi C, Park CK et al.: Tracing origin of serrated adenomas with BRAF and KRAS mutations. Virchows Arch 2005; 447: 597-602.
111. Matsumoto T, Mizuno M, Shimizu M et al.: Serrated adenoma of the colorectum: colonoscopic and histologic features. Gastrointest Endosc 1999; 49: 732-42.
112. Fogt F, Brien T, Brown CA et al.: Genetic alterations in serrated adenomas. Comparison to conventional adenomas and hyperplastic polyps. Hum Path 2002; 33: 87-91.
113. Iwabuchi M, Sasano H, Hiwatashi N et al.: Serrated adenoma: A clinicopatholocal, DNA ploidy and immunohistochemical study. Anticancer Res 2000; 20: 1141-47.
114. Iino H, Jass JR, Simms LA et al.: DNA microsatellite instability in hyperplastic polyps, serrated adenomas and mixed polyps: a mild mutator pathway for colorectal cancer? J Clin Pathol 1999; 52: 5-9.
115. NCCN Clinical Practice Guidelines in Oncology. Colorectal cancer screening. www.nccn.org Accessed: 16.10.2012.
116. von Karsa L, Antilla A, Ronco G et al.: Cancer screening in the European Union – report of implementation of the Council Recommendation on cancer screening, First Report, European Commission, Luxembourg 2008.
117. Hardcastle JD, Chamberlain JD , Robinson MH et al.: Randomised controlled trial of fecal occult blood screening for colorectal cancer. Lancet 1996; 348: 1472-77.
118. Kronborg O, Fenger C, Olsen J et al.: Randomised study of screening for colorectal cancer with faecal-occult-blood test. Lancet 1996; 348: 1467-71.
119. Mandel JS, Bond JH, Church TR et al.: Reducing mortatlity from colorectal cancer by screening for fecal occult blood. Minesota colon cancer control study. N Eng J Med 1993; 328: 1365-71.
120. Imperiale TF, Ransohoff DF, Itzkowitz SH et al.: Fecal DNA vs. fecal occult blood for colorectal-cancer screening in an average-risk population. N Engl J Med 2004; 351: 2704-14.
121. Bohlman TW, Katon RW, Lipshutz GR et al.: Fiberoptic pansigmoidoscopy: an evaluation and comparison with rigid sigmoidoscopy. Gastroenterology 1977; 72: 644-49.
122. Lieberman DA, Weiss DG, Bond JH et al.: Use of colonoscopy to screen asymptomatic adults for colorectal cancer. Veterans Affairs Cooperative Study Group 380. N Engl J Med 2000; 343: 162-8.
123. Winawer SJ, Zauber AG, Ho MN et al.: Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Work Group. N Engl J Med 1993; 329: 1977-81.
124. Nelson DB, McQuaid KR, Bond JH et al.: Procedural success and complications of large-scale screening colonoscopy. Gastrointest Endosc 2002; 55: 307-14.
125. Council of the European Union. Council recommendation of 2 December 2003 on cancer screening (2003/878/EC). Off J Eur Union 2003; 327: 34-38.
126. Założenia programu badań przesiewowych opublikowane na stronie internetowej Ministerstwa Zdrowia (stan na 16.10.2012) http://www.mz.gov.pl/wwwmz/index?mr=q101&ms=&ml=pl&mi=&mx=0&mt=&my=0&ma=8548
127. Bufill JA: Colorectal cancer: Evidence for distinct genetic categories based on proximal or distal tumor location. Ann Intern Med 1990; 13: 779-88.
128. Li FY, Lai MD: Colorectal cancer, one entity or three. J Zhejiang Univ Sci B 2009; 10: 219-29.
129. Pocard M, Salmon RJ, Muleris M et al.: Two colons – two cancers? Proximal or distal adenocarcinoma: arguments for a different carcinogenesis. Bull Cancer 1995; 82: 10-21.
130. Distler P, Holt PR: Are right- and left-sided colon neoplasms distinct tumors? Dig Dis 1997; 15: 302-11.
131. Iacopetta B: Are there two sides to colorectal cancer? Int J Cancer 2002; 101: 403-8.
132. Iacopetta B, Kawakami K, Watanabe T: Predicting clinical outcome of 5-fluorouracil-based chemotherapy for colon cancer patients: is the CpG island methylator phenotype the 5-fluorouracil-responsive subgroup? Int J Clin Oncol 2008; 13: 498-503.
133. Freeman HJ: Heterogeneity of colorectal adenomas, the serrated adenoma and implications for screening and surveillance. World J Gastroenterol 2008; 14: 3461-63.
134. Lazarus R, Juntilla OE, Karttunen TJ, Makinen MJ: The risk of metachronous neoplasia in patients with serrated adenoma. Am J Clin Pathol 2005; 123: 349-359.
135. Li D, Chengshi J, McCulloch C et al.: Associaition of large serrated polyps with synchronous advanced colorectal neoplasia. Am J Gastroenetrol 2009; 104: 695-702.
136. Mäkinen MJ, George SM, Jernvall P et al.: Colorectal carcinoma associated with serrated adenoma-prevalence, histological features, and prognosis. J Pathol 2001; 193: 286-94.
137. Jass JR, Young J, Leggett BA et al.: Evolution of colorectal cancer: change of pace and change of direction. J Gastroenterol Hepatol 2002; 193: 286-94.
138. Kaminski MF, Regula J, Kraszewska E et al.: Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362: 1795-803.
139. Farris AB, Misdraji J, Srivastava A et al.: Sessile serrated adenoma. Challenging discrimination from other serrated colonic polyps. Am J Surg Pathol 2008; 32: 30-35.
140. Baker K, Zhang Y, Jin C, Jass JR: Proximal versus distal hyperplastic polyps of the colorectum: different lesions or biological spectrum? J Clin Pathol 2004; 57: 1089-1093.
141. Lauwers GY and Chung DC: The serrated polyp comes of age. Gastroenterology 2006; 131: 1631-4.
142. Owens SR, Chiosea SI, Kuan SF: Selective expression of gastric mucin MUC6 in colonic sessile serrated adenoma but not in hyperplastic polyp aids in morphological diagnosis of serrated polyps. Mod Pathol 2008; 21: 660-9.
143. Bartley AN, Thompson PA, Buckmeier JA et al.: Expression of gastric pyloric mucin MUC6 in colorectal serrated polyps. Mod Pathol 2010; 23: 1691-6.
144. Fujimori Y, Fujimori T, Imura J et al.: An assessment of the diagnostic criteria for sessile serrated adenoma/polyps: SSA/Ps using image processing software analysis for Ki67 immunohistochemistry. Diagn Pathol 2012; 7: 59.
145. Lindblom A: Different mechanisms in the tumorigenesis of proximal and distal colon cancers. Curr Opin Oncol 2001; 13: 63-9.
146. Chung SM, Chen YT, Panczykowski A et al.: Serrated polyps with intermediate features of sessile serrated polyp and microvesicular hyperplastic polyp: a practical approach to the classification of nondysplastic serrated polyps. Am J Surg Pathol 2008; 32: 407-12.
147. Montgomery E: Serrated colorectal polyps: emerging evidence suggesting the need for reappraisal. Adv Anat Pathol 2004; 11: 143-9.
148. Bariol C, Hawkins NJ, Turner JJ et al.: Histopathological and clinical evaluation of serrated adenomas of the colorectum. Mod Pathol 2003; 16: 417-23.
149. Jamarillo E, Watanabe M, Rubio C, Slezak P: Small colorectal serrated adenomas: endoscopic findings. Endoscopy 1997; 29: 1-3.
150. Harvey NT, Ruszkiewicz A: Serrated neoplasia of the colorectum. World J Gastroenterol 2007; 13: 3792-8.































