© Borgis - Medycyna Rodzinna 4/2006, s. 86-91
*Barbara Macura, Leopold Śliwa
Interakcje pomiędzy endogennymi estrogenami a środowiskowymi fitoestrogenami w regulacji działania układu rozrodczego męskiego
Interaction between endogenic estrogens and environmental phytoestrogens in control of male reproductive system
Zakład Biologii Rozwoju Człowieka, Instytut Pielęgniarstwa i Położnictwa Uniwersytet Jagielloński Collegium Medicum w Krakowie
Kierownik: dr hab. Leopold Śliwa
Summary
Estrogens are not only female hormons. Now it is well documented that they are also responsible for proper development and function of male reproductive system. A lot of evidences suggest that environmental estrogens possess estrogen-like biological activity. They can influence the synthesis and metabolism endogenic estrogens in organism. The aim of this article is to present the interaction of endogenic estrogens and environmental estrogens i.e. phytoestrogens in male reproductive system. Phytoestrogens can be found in number of edible plants. Some phytoestrogens i.e., genistein and daidzein possess estrogen-like biological activity and, in this way, they can influence the male fertility.

Metabolizm i mechanizmy działania estrogenów i fitoestrogenów w tkankach układu rozrodczego
Hormony steroidowe, a do takich należą estrogeny, posiadają zdolność dyfuzji przez błonę komórkową i wiązania się ze specyficznym białkowym receptorem (ER), zlokalizowanym w cytozolu lub jądrze komórkowym. Po przyłączeniu hormonu do ER następuje odłączenie białek szoku termicznego od nieaktywnego receptora, co zmienia jego ładunek i konformację przestrzenną, aktywizując go. Aktywacja umożliwia tworzenie się homo- lub heterodimerów receptorów. Jest to związane z występowaniem dwóch podstawowych typów receptorów estrogenowych, a mianowicie ERα i ERβ. ERβ występuje w dwóch podtypach ERβ1 i ERβ2, które posiadają liczne, różne formy. Kompleks hormon-receptor wiąże się ze specyficznym miejscem na DNA, zwanym sekwencją odpowiedzi hormonalnej – HRE (ang. hormon response element), zlokalizowanym przed transkrybowanymi genami. Wydaje się, że dimer ERα-ERα ma silniejsze właściwości wywoływania transkrypcji określonego fragmentu DNA, niż dimer ERβ-ERβ. Hormony steroidowe zmieniają przede wszystkim schemat ekspresji genów, a nie aktywność jednego, ściśle określonego genu. Ta droga wpływu estrogenów na przebieg procesów komórkowych wymaga dłuższego czasu, rzędu godzin, ponieważ wymusza syntezę nowych mRNA i nowych białek.
ERα i ERβ nie są swoimi izoformami, lecz produktami różnych genów, znajdujących się na różnych chromosomach. Ludzki ERα posiada masę cząsteczkową około 66 kDa, natomiast ERβ około 54 kDa. Oba typy receptorów zbudowane są z 6 domen, oznaczonych literami od A do F, z których każda pełni określoną funkcję biologiczną. Domena A/B zawiera region pełniący funkcję niezależnej od przyłączenia liganda aktywacji transkrypcji (AF1). Domena ta wykazuje najniższy stopień homologii pomiędzy obydwoma receptorami estrogenowymi, wynoszący 17%. Domena C zawiera region z motywem palców cynkowych, wiążących się z HRE. Domena ta wykazuje najwyższy stopień homologii pomiędzy obydwoma receptorami estrogenowymi, wynoszący 97%. Domena D odpowiada za jądrową lokalizację ER. Domena E zawiera region wiążący ligand, korepresory, koaktywatory i inne czynniki, wchodzące w skład kompleksu transkrypcyjnego, a także posiada miejsce dimeryzacji receptorów i drugie miejsce transaktywacji (AF2). Domena F jest domeną o nieznanej funkcji. Pomimo, że oba typy receptorów wykazują homologię sekwencji aminokwasowych w domenie wiążącej ligand i posiadają podobne powinowactwo do 17β estradiolu, różnią się one powinowactwem dla innych ligandów tych receptorów (1-6).
Istnieją również możliwości szybkich, nie-genomowych efektów oddziaływania estrogenów na komórki. Czas odpowiedzi komórki wynosi wtedy sekundy lub minuty. W błonie komórkowej zlokalizowano „klasyczny” receptor estrogenowy lub jego specyficzne odmiany. Po utworzeniu w błonie kompleksu hormon-receptor dochodzi do uruchomienia w komórce szeregu nie-genomowych procesów, prowadzących między innymi do wzrostu stężenia w cytoplazmie jonów Ca2+, K+ czy wzmożonej syntezy tlenku azotu. W kaskadę tych przemian są zaangażowane takie związki jak: kinaza tyrozyny, kinaza proteinowa A i C, białko G, cyklaza adenylowa, cAMP, fosfolipaza C, diacyloglicerol, 3 fosfoinozytol, fosfatydyloinozytol i wiele innych. Być może obie te drogi działania estrogenów (genomowa i nie-genomowa) mogą się wzajemnie w komórce krzyżować (1, 4).
Rozmieszczenie obu typów receptorów (ERα i ERβ) w układzie rozrodczym męskim dojrzałych płciowo szczurów przedstawiono w tabeli 1. Trwają jednak spory o dokładną ich lokalizację, a wyniki badań są sprzeczne, głównie ze względu na znaczne różnice międzygatunkowe w rozmieszczeniu ER jak i rozbieżności w zastosowanych metodach badawczych. Ponadto należy również pamiętać o obecności ER w podwzgórzu i przysadce mózgowej. Ta lokalizacja jest ważna ze względu na działanie hormonalnej osi podwzgórze – przysadka – gonady (7).
Tabela 1. Rozmieszczenie receptorów estrogenowych (ERα i ERβ) i aktywność aromatazy w układzie rozrodczym męskim dojrzałych płciowo szczurów.
| Tkanka/komórka | ERa | ERb | Aromataza |
| komórki Leydiga | + | +/- | + |
| komórki peritubularne | - | + | +/- |
| komórki Sertoliego | - | + | + |
| spermatogonie | - | + | NO |
| spermatocyty pachytenowe | - | + | + |
| spermatydy okrągłe | - | + | + |
| plemniki | +? | +? | + |
| sieć jądra | + | NO | NO |
| kanaliki odprowadzające | + | +/- | NO |
| najądrze * | + | + | NO |
| pęcherzyki nasienne | - | + | NO |
| prostata | - | + | NO |
Objaśnienia. +: występuje, –: nie występuje, NO: nie określono, +?: nie scharakteryzowano (ERα czy ERβ), *: w kierunku od głowy do ogona najądrza ilość ERα maleje, a ilość ERβ rośnie; zmodyfikowano za (7).
Estrogeny środowiskowe mogą współzawodniczyć z estradiolem o miejsce na ER i przez to wpływać na odpowiedź komórkową. Jest to związane z ich strukturalnym podobieństwem do endogennych estrogenów. Powinowactwo najsilniej działających fitoestrogenów do ER jest około 100 razy słabsze niż estradiolu. Związki te mogą działać jako agoniści lub antagoniści receptorów estrogenowych, przy czym wydaje się, że w niższych stężeniach działają jako agoniści, a w wyższych jako antagoniści tych receptorów. Kierunek działania fitoestrogenów zależny jest również, między innymi, od rodzaju samego receptora (fitoestrogeny wykazują wyższe powinowactwo do ERβ niż do ERα), środowiska hormonalnego (przy niedoborze endogennych estrogenów mogą one wykazywać działanie proestrogenowe, a przy ich nadmiarze – antyestrogenowe) a także od właściwości konkretnego fitoestrogenu (różne fitoestrogeny wykazują różną siłę działania estrogennego). Ponadto istotny wydaje się również rodzaj tkanki (różne tkanki wykazują zróżnicowany stopień ekspresji receptorów estrogenowych i różne są proporcje ERα i ERβ w poszczególnych tkankach) czy wreszcie gatunek zwierzęcia (różne zwierzęta wykazują różne nasilenie ekspresji receptorów estrogenowych).
Niektóre fitoestrogeny posiadają zdolność do wiązania się z ER, ale kompleks ten nie jest zdolny do indukcji transkrypcji, a więc nie wpływa na zmianę metabolizmu komórki; inne mogą obniżać stężenie ER w komórkach (2, 5, 6, 8).
Głównym źródłem estrogenów w organizmie męskim jest konwersja testosteronu (T), produkowanego w komórkach Leydiga, w gonadach. W reticulum endoplazmatycznym, zarówno komórek Leydiga, komórek Sertoliego, jak i komórek szlaku spermatogenezy testosteron jest przekształcany w estradiol (E2). Proces ten zachodzi przy udziale aromatazy, kompleksu enzymatycznego składającego się z dwóch białek. Pierwszym z nich jest specyficzna mikrosomalna hemoglikoproteina, cytochrom P450, a drugim niespecyficzna mikrosomalna reduktaza flawoproteinowa (reduktaza NADPH cytochromu P450). Są one kolejno odpowiedzialne za przyłączenie substratu i katalizowanie reakcji prowadzących do utworzenia charakterystycznego dla estrogenów pierścienia fenolowego, oraz za transfer elektronów z NADPH na cytochrom P450. Estradiol, estron i estriol są substratami dla enzymów wątrobowych katalizujących powstawanie pochodnych glukuronidowych lub siarczanowych, a następnie są wydalane z żółcią, kałem lub moczem.
Zamieszczony schemat (ryc. 1) przedstawia szlak syntezy estrogenów wraz z enzymami niezbędnymi do tego procesu oraz ich degradację. Enzymy, których cyfry wytłuszczono, to enzymy, których aktywność jest blokowana przez fitoestrogeny. Zjawisko to być może jest możliwe dzięki konkurencji fitoestrogenów z prekursorami lub pochodnymi estrogenów o centrum substratowe tych enzymów (3, 4, 9, 10, 11, 12).
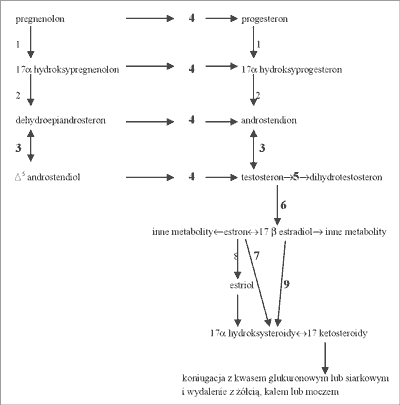
Ryc. 1. Szlak syntezy i degradacji estrogenów wraz z wytłuszczonymi numerami enzymów, których aktywność jest blokowana przez fitoestrogeny; zmodyfikowano za (3).
Objaśnienia. 1 – 17α hydroksylaza, 2 – C17-20 liaza, 3, 7, 9– rodzina dehydrogenaz 17β hydroksysteroidowych; 17β-OHSD, 4– dehydrogenaza 3β hydroksysteroidowa; 3β-OHSD (blokowana przez PE) oraz Δ5,4 izomeraza (nie blokowana przez PE), 5– 5α reduktaza, 6– aromataza, 8 – 16α hydroksylaza
Obecność kluczowego dla syntezy estrogenów enzymu aromatazy w układzie rozrodczym męskim przedstawiono w tabeli 1. Aktywność tego enzymu, podobnie jak i rozmieszczenie i ilość ER zależy od wieku i gatunku. Najwięcej badań, podobnie jak w przypadku ER, przeprowadzono na szczurach. Wyniki tych badań również nie są jednoznaczne. Wykazano wzmożoną syntezę P450 aromatazy w spermatocytach pachytenowych, a wzrost aktywności aromatazy w spermatydach wydłużonych, co może sugerować pewne opóźnienie czasowe w translacji mRNA aromatazy. Ponadto zaobserwowano spadek aktywności aromatazy w kierunku od głowy do ogona najądrza, co jest związane z odsznurowywaniem kropli cytoplazmatycznej przez plemniki, w której również stwierdzono aktywność aromatazy, wraz z ich przesuwaniem się przez ten narząd. Obecność aromatazy stwierdzono również w podwzgórzu szczura, a należy pamiętać, iż prawidłowy poziom estrogenów jest również niezbędny dla zapewnienia prawidłowych zachowań seksualnych samców.
Fitoestrogeny posiadają także zdolność do wiązania się z receptorem Ah (z ang. aryl hydrocarbon receptor), a kompleks ten obniża ilość ER w komórkach. Związki te ponadto posiadają zdolność blokowania kinaz białkowych (PTK), na przykład tyrozynowych, których funkcja polega między innymi na wiązaniu ligandów, którymi często są różnego rodzaju czynniki wzrostu. Fitoestrogeny hamują także aktywność topoizomerazy, enzymu odpowiedzialnego za „rozkręcenie” i ponowne „skręcenie” („zespolenie”) dwóch nici jednej cząsteczki DNA w jądrze przed i po replikacji. Ponadto zwiększają one aktywność enzymów uczestniczących w procesie usuwania wolnych rodników, hamują aktywność lipooksygenazy, enzymu odpowiedzialnego za peroksydację lipidów, blokują cykl komórkowy, indukują apoptozę i hamują angiogenezę (2, 4, 5, 8).
Rola estrogenów i fitoestrogenów w utrzymaniu równowagi hormonalnej osi podwzgórze – przysadka – gonady
Oś podwzgórze – przysadka – gonady to „klasyczna” oś hormonalna organizmu, której kontrola opiera się o zasadę ujemnego sprzężenia zwrotnego. Podwzgórze produkuje gonadoliberynę (GnRH), która powoduje uwolnienie hormonu luteinizującego (LH) i folikulotropowego (FSH) z przysadki. Te gonadotropiny mają swoje receptory w gonadach, odpowiednio na komórkach Leydiga (które produkują testosteron) i Sertoliego (które pełnią funkcje różnicujące i odżywcze w stosunku do komórek spermatogenicznych). Testosteron i estrogeny mają swoje receptory w gonadach, przysadce i podwzgórzu. Ich aktywacja prowadzi do zahamowania uwalniania GnRH, FSH i LH i do spadku produkcji hormonów płciowych (3).
Wyniki pomiarów stężeń LH, FSH, GnRH, T i E2 w surowicy krwi po podaniu fitoestrogenów są sprzeczne. Biorąc jednak pod uwagę fakt skomplikowanego oddziaływania tych związków na organizm i ich mieszane właściwości agonistyczno-antagonistyczne wydaje się zrozumiałe, dlaczego tak trudno jest przeprowadzić jednoznaczną analizę uzyskanych wyników. Wydaje się jednak, że fitoestrogeny mogą powodować obniżenie stężenia LH, a w konsekwencji testosteronu i endogennych estrogenów. Wykazano również, iż fitoestrogeny posiadają zdolność indukcji syntezy globuliny wiążącej hormony płciowe (SHBG), co powoduje spadek stężenia wolnej frakcji T i E2, a więc frakcji odpowiedzialnej za efekty biologiczne. Fitoestrogeny wykazują słabe powinowactwo do SHBG. Efekt obniżonego stężenia powyższych hormonów płciowych w wyniku działania fitoestrogenów jest raczej słabo zaznaczoną tendencją spadkową niż różnicami statystycznie znamiennymi pomiędzy grupami badanymi a kontrolnymi. Należy jednak pamiętać, że wyniki te nie wykluczają możliwości lokalnych zmian hormonalnych i ich efektu wewnątrz gruczołów płciowych (13-16).
Istnieją również doniesienia, iż fitoestrogeny mogą zwiększać syntezę dehydroepiandrosteronu (DHEA) w korze nadnerczy, który jest również prekursorem testosteronu. Nadnercza jednak w warunkach fizjologicznych są znacznie mniejszym źródłem tego hormonu niż gonady (17).
Działanie estrogenów w układzie rozrodczym męskim
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Luconi M., et al.: Genomic and nongenomic effects of estrogens: molecular mechanisms of action and clinical implications for male reproduction. J. Steroid Biochem. Mol. Biol., 2002; 80: 369-381. 2. Molteni A., et al.: In vitro hormonal effects of soybean isoflavones. J. Nutr., 1995; 125: 751S-756S. 3. Granner D.K. 1998.: Działanie hormonów (625-641). Przysadka mózgowa i hormony podwzgórza (642-656). Hormony gonadalne (699-717). In: Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W. Biochemia Harpera. Wydawnictwo Lekarskie PZWL, Warszawa. 4. Paziewska A., Bilińska B.: Estrogeny i ich rola w regulacji spermatogenezy. Post. Biol. Kom., 2003; 30: 461-481. 5. Rosselli M., et al.: Cellular and biochemical mechanisms by which environmental oestrogens influence reproductive function. Hum Reprod 2000; 6: 332-350. 6. Snochowski M.: The effect of hormonally active environmental compounds on sex hormone receptors. Prog. Andr., 2002; 4: 57-82. 7. Carreau S.: Estrogens and male reproduction. Folia Histochem Cytobiol., 2000; 38: 47-52. 8. Cos P., et al.: Phytoestrogens: recent developments. Planta Med., 2003; 69: 589-599. 9. Evans J.A.B., et al.: Inhibition of 5α-reductase in genital skin fibroblasts and prostate tissue by dietary lignans and isoflavonoids. J. Endocrinol., 1995; 147: 295-302. 10. Mäkelä S., et al.: Inhibition of 17β-hydroxysteroid oxidoreductase by flavonoids in breast and prostate cancer cells. P.S.E.B.M., 1998; 217: 310-316. 11. Papież M., et al.: The compounds from the hollyhock extract (althaea rosea cav. var. nigra) affect the aromatization in rat testicular cells in vivo and in vitro. Folia Histochem Cytobiol., 2002; 40: 353-359. 12. Whitten L.P., Patisaul B.H.: Cross – species and interassay comparisons of phytoestrogen action. Environ Health Perspect 2001; 109: 5-20. 13. Kurzer S.M.: Hormonal effects of soy in premenopausal women and men. J. Nutr., 2002; 132: 570S-573S. 14. Mousavi Y., Adlercreutz H.: Genistein is an effective stimulator of sex hormone – binding globulin production in hepatocarcinoma human liver cancer cells and suppresses proliferation of these cells in culture. Steroids 1993; 58: 301-304. 15. Munro C.I., et al.: Soy isoflavones: a safety review. Nutr. Rev., 2003; 61:1-33. 16. Strauss L., et al.: Genistein exerts estrogen – like effects in male mouse reproductive tracts. Mol. Cell. Endocrinol., 1991; 44: 83-93. 17. Mesiano S., et al.: Phytoestrogens alter adrenocortical function: genistein and daidzein suppress glucocorticoid and stimulate androgen production by cultured adrenal cortical cells. Clin. Endocrinol. Metab., 1999; 84: 2443-2448. 18. Carreau S., et al.: Sources of oestrogen in the testis and reproductive tract of the male. Int. J. Androl., 1999; 22: 211-223. 19. Hess A.R., Bunick D.: Sperm, a source of estrogen. Environ Health Perspect 1995; 103: 59-62. 20. Hess A.R., et al.: A role for oestrogens in the male reproductive system. Nature 1997; 390: 509-512. 21. O´Donnell., et al.: Estrogen and spermatogenesis. Endocr. Rev., 2001; 22: 289-318. 22. Hess A.R.: Estrogen in the adult male reproductive tract: a review. Reprod. Biol. Endocrinol., 2003; 1, 52. 23. Hess A.R., et al.: Oestrogen, its receptors and function in the male reproductive tract – a review. Mol. Cell. Endocrinol., 2001; 178: 29-38. 24. Hess A.R., et al.: Estrogens and epididymal function. Reprod. Fertil. Dev., 2001; 13: 273-283. 25. Bilińska B., Carreau S.: Plemniki szczura, potencjalnym źródłem estrogenów. Gin. Pol., 1998; 69: 394-399. 26. Carreau S., et al.: Aromatase expression and role of estrogens in male gonad – a review. Reprod. Biol. Endocrinol., 2003; 1, 35. 27. Carreau S., Levallet J.: Testicular estrogens and male reproduction. News Physiol. Sci., 2000; 15: 195-198. 28. Hess A.R.: Oestrogen in fluid transport in efferent ducts of the male reproductive tract. Rev. Reprod., 2000; 5: 84-92. 29. Kumi-Diaka J., et al.: Cytotoxic potential of the phytochemical genistein isoflavone (4´, 5´, 7-trihydroxyisoflavone) and certain environmental chemical compounds on testicular cells. Biol. Cell., 1999; 91: 515-523. 30. Kumi-Diaka J., et al.: Influence of genistein (4´, 5, 7- trihydroxyisoflavone) on the growth and proliferation of testicular cell lines. Biol. Cell., 1998; 90: 349-354. 31. Cline M.J., et al.: Effects of dietary isoflavone aglycones on the reproductive tract of male and female mice. Toxicol. Pathol., 2004; 32: 91-99. 32. Fritz A.W., et al.: Genistein alters growth but is not toxic to the rat prostate. J. Nutr., 2002; 3007-3011. 33. Fritz A.W., et al.: Dietary genistein down – regulates androgen and estrogen receptor expression in the rat prostate. Mol. Cell. Endocrinol., 2002; 186: 89-99. 34. Mäkelä I.S., et al.: Dietary soybean may be antiestrogenic in male mice. J. Nutr., 1995; 125: 437-445. 35. Risbridger P.G., et al.: The in vivo effect of red clover diet on ventral prostate growth in adult male mice. Reprod. Fertil. Dev., 2001; 13: 325-329. 36. Saito M., et al.: Genistein represses the induction of prostatic buds by testosterone. J. Soc. Biol., 2000; 194: 95-97. 37. Adeoya-Osiguwa A.S., et al.: 17β-estradiol and environmental estrogens significantly affect mammalian sperm function. Hum. Reprod., 2003; 18: 100-107. 38. Devi U.K., et al.: Inhibition of motility of hamster spermatozoa by protein tyrosine kinase inhibitors. Andrologia 2000; 32: 95-106. 39. Hinsch K.D., et al.: In vitro tests for essential sperm functions using the phyto-oestrogen genistein as a test substance. Andrologia 2000; 32:225-231. 40. Kumi-Diaka J., Townsend J.: Toxic potential of dietary genistein isoflavone and β-lapachone on capacitation and acrosome reaction of epididymal spermatozoa. J. Med. Food., 2003; 6: 201-208. 41. Kumi-Diaka J., Townsed J.: Effects of genistein isoflavone (4´,5´,7- trihydroxyisoflavone) and dexamethasone on functional characteristics of spermatozoa. J. Med. Food., 2001; 4: 39-47. 42. Pukazhenthi S.B., et al.: Inhibition of domestic cat spermatozoa acrosome reaction and zona pellucida penetration by tyrosine kinase inhibitors. Mol. Reprod. Dev., 1998; 49: 48-57. 43. Wanichacheewa S., et al.: Decrease in the number of sperm associated with decreased blood testosterone levels in male rats treated with extracts from seven plants consumed by natives of northern Thailand. Environ Toxicol Pharmacol 2001; 10: 1-4. 44. Delclos B.K., et al.: Effects of dietary genistein exposure during development on male and female CD (Sprague-Dawley) rats. Reprod Toxicol 2001; 15: 647-663. 45. Fielden R.M., et al.: Effect of human dietary exposure levels of genistein during gestation and lactation on long-term reproductive development and sperm quality in mice. Food Chem. Toxicol., 2003; 41: 447-454. 46. Kang S.K., et al.: Lack of adverse effects in the F1 offspring maternally exposed to genistein at human intake dose level. Food Chem. Toxicol., 2002; 40: 43-51. 47. Lewis W.R., et al.: The effects of the phytoestrogen genistein on the postnatal development of the rat. Toxicol. Sci., 2003; 71: 74-83. 48. Nagao T., et al.: Reproductive effects in male and female rats of neonatal exposure to genistein. Reprod Toxicol., 2001; 15: 399-411. 49. Wisniewski B.A., et al.: Exposure to genistein during gestation and lactation damasculinizes the reproductive system in rats. J. Urol. 2003; 169: 1582-1586.

