© Borgis - Postępy Fitoterapii 4/2013, s. 220-224
*Aleksandra Wawro, Dominika Pieprzyk-Kokocha, Agnieszka Gryszczyńska, Zdzisław Łowicki, Przemysław Ł. Mikołajczak, Katarzyna Grajek
Porównanie składu polifenoli zawartych w wyciągach hydroalkoholowych liści różnych odmian morwy białej (Morus alba L.)**
Comparison of the composition of the polyphenol content in the hydroalcoholic extracts leaves of different varieties of white mulberry (Morus alba L.)
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
The aim of the study was to analyze hydroalcoholic extracts (70% ethanol) obtained from the dried leaves of four varieties of white mulberry (Morus alba L.), in terms of the content of polyphenolic compounds. After the extraction the polyphenol content in the obtained extracts was measured by high performance liquid chromatography (HPLC). This allowed the determination of the following flavonoids: rutin, isovitexin, luteolin, apigenin, hyperoside, vitexin and phenolic acids: rosmarinic and chlorogenic acid. Based on the results, the highest content of chlorogenic acid was observed and for the rutin in the extracts from the dried leaves of the variety Kokuso white mulberry. The study showed that the white mulberry leaves are a good source of natural biologically active substances which are polyphenols.

Wstęp
Morwa biała (Morus alba L.) to roślina pochodząca z Azji południowo-wschodniej, przede wszystkim z północnych Chin. Jest to roślina występująca w postaci drzew i krzewów, o wysokości do 15 m, wieloletnia szeroko, rozpowszechniona na świecie, a więc łatwo przystosowująca się do różnorodnych warunków klimatycznych. Morwa hodowana jest w Europie od XI wieku jako roślina dostarczająca jadalnych owoców i przydatnych liści. W Europie wyróżnia się dwa gatunki morwy, jedną z nich jest morwa biała (Morus alba L.). Szereg właściwości leczniczych części morfologicznych morwy białej znano już od wieków. W tradycyjnej medycynie chińskiej wykorzystywano liście morwy białej, m.in. w obniżaniu wysokiego ciśnienia krwi i wysokiego poziomu cholesterolu. Podobne właściwości wykazywały także ekstrakty z kory korzenia morwy, które wykorzystywane były przeciwzapalnie, jako środki chroniące wątrobę i nerki, a także jako środki przeciwbólowe (1, 2, 3).
Coraz większe zagrożenie chorobami cywilizacyjnymi, takimi jak miażdżyca, cukrzyca, otyłość, czy choroby nowotworowe, spowodowało, że zaczęto szczegółowo badać właściwości morwy białej pod kątem wykorzystania wszystkich jej części morfologicznych w celach profilaktycznych lub leczniczych. Obecnie pojawia się wiele doniesień naukowych na temat tego, że morwa biała jest bardzo dobrym źródłem związków fenolowych, m.in. flawonoidów i kwasów fenolowych. Związki te stanowią grupę wartościowych substancji o charakterze bioaktywnym, które należą do największej grupy naturalnych antyoksydantów. Uważa się, że dzięki temu mogą odgrywać znaczącą rolę w ochronie ludzkiego organizmu, przed chorobami nowotworowymi i zmianami miażdżycowymi (4, 5).
Dawniej liście morwy białej służyły głównie jako pokarm dla jedwabników, jednakże dokładniejsze poznawanie bogatych właściwości prozdrowotnych, pozwoliło wykorzystać je również do celów żywieniowych. Obecnie na rynku spożywczo-farmaceutycznym znane są już produkty zawierające w swoim składzie liście morwy. Istnieją przesłanki, aby sądzić, że aktywność liści morwy może być silnie związana ze zmianami ilościowymi polifenoli, stąd poznanie tej grupy związków wydaje się ważne, zwłaszcza w celu dokładniejszego wystandaryzowania stosowanych odmian.
Cel pracy
Celem niniejszej pracy było określenie składu polifenoli zawartych w ekstraktach wodno-alkoholowych otrzymanych z liści różnych odmian morwy białej.
Materiał i metody
Materiał do badań stanowiły wysuszone liście morwy białej następujących odmian: Wielkolistna Żółwińska, China 32, Kokuso oraz Ichinoje. Zebrano je w 2010 i 2011 roku na terenie Zakładu Doświadczalnego Instytutu Włókien Naturalnych i Roślin Zielarskich w Pętkowie. Otrzymany surowiec rozdrabniano w młynku laboratoryjnym (uniwersalny młyn tnący Pulverisette 19, sita 0,25 mm) i poddano jednokrotnej ekstrakcji 70% alkoholem etylowym. Zawiesinę sączono na lejkach piankowych G-0, a następnie przesącz zamrażano (temp. –50°C) i liofilizowano (ciśnienie < 0,5 hPa). W tak otrzymanych wyciągach oznaczano wybrane polifenole przy pomocy wysokosprawnej chromatografii cieczowej (HPLC). Analizę fitochemiczną prowadzono za pomocą zwalidowanych metod własnych IWNiRZ. Zastosowano następujące warunki chromatograficzne: detektor DAD, kolumna Nucleosis C18 150,0 x 4,0 mm x 3,0 μm, skład faz ruchomych: A – tetrahydrofuran: diwodorofosforan sodu, pH = 3,0, 5:95 (v:v); faza ruchoma B – tetrahydrofuran: diwodorofosforan sodu, pH = 3,0, 40:60 (v:v), szybkość przepływu: 1,0 ml/min;
objętość nastrzyku: 20 μl; temp. kolumny: 30°C; detekcję dla izowiteksyny, witeksyny, luteoliny prowadzono dla długości fali λλ = 350 nm; dla hiperozydu i apigeniny przy długości fali λ = 210 nm, dla rutyny – λ = 360 nm, dla kwercetyny – λ = 370 nm. Podczas oznaczania kwasu rozmarynowego i kwasu chlorogenowego zmieniono skład fazy ruchomej następująco: faza ruchoma A – kwas fosforowy: woda 1:999 (v/v); faza ruchoma B – acetonitryl oraz szybkość przepływu 0,8 ml/min, objętość nastrzyku 10 μl; a temp. kolumny wynosiła 40°C. Detekcję dla kwasu rozmarynowego prowadzono przy długości fali λ = 205 nm, a dla kwasu chlorogenowego przy długości fali λ = 330 nm.
Wyniki wyrażano w postaci zawartości procentowej poszczególnych związków w wyciągach i przedstawiono jako średnie arytmetyczne (z co najmniej trzech oznaczeń) ± SD. Analizę ogólnej zmienności w dwóch latach zbiorów prowadzono w oparciu o analizę wariancji z powtórzeniami (ANOVA II). Do określenia różnic zawartości pomiędzy poszczególnymi odmianami zastosowano test Fishera LSD (post-hoc test). Znamienność statystyczną przyjęto dla p < 0,05.
Wyniki
Na rycinach 1-9 przedstawiono analizę zawartości substancji biologicznie czynnych metodą wysokosprawnej chromatografii cieczowej dla liści różnych odmian morwy białej. Podczas badań zidentyfikowano wybrane flawonoidy (kwercetyna, rutyna, witeksyna, izowiteksyna, luteolina, apigenina, hiperozyd) i kwasy fenolowe (kwas chlorogenowy, kwas rozmarynowy).
W przypadku kwercetyny (ryc. 1) nie zaobserwowano zmienności między otrzymanymi średnimi (ANOVA II (efekt główny) F(3,8) = 0,672; p = 0,592), zauważono jednak występowanie różnic dla poszczególnych lat zbioru (efekt czasu F(1,8) = 5,66, p = 0,04), przy braku jednoczesnej interakcji dla efektu głównego i czasu (F(3,8) = 0,856, p = 0,50). Na podstawie dalszej szczegółowej analizy stwierdzono, że zawartość kwercetyny w odmianie Żółwińskiej była znamiennie wyższa w 2011 roku w porównaniu do zbioru w 2010 roku (p < 0,05).
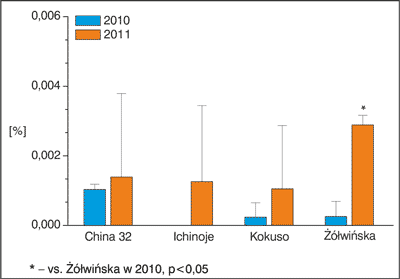
Ryc. 1. Zawartość kwercetyny w wyciągach otrzymanych z liści badanych odmian morwy białej.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Doi K, Kojima T, Makino M i wsp. Studies on the constituents of the leaves of Morus alba L. Chem Pharm Bull Tokyo 2001; 49(2):151-3. 2. Dugo P, Donato P, Cacciola F i wsp. Characterization of the polyphenolic fraction of Morus alba leaves extracts by HPLC coupled to a hybrid IT-TOF MS system. J Sep Sci 2009; 32:3627-34. 3. El-Beshbishy HA, Singab ANB, Sinkkonen J i wsp. Hypolipidemic and antioxidant effects of Morus alba L. (Egyptian mulberry) root bark fractions supplementation in cholesterol-fed rats. Life Sci 2006; 78:2724-33. 4. Dudek-Makuch M, Gawron-Gzella A. Naturalne antyoksydanty w profilaktyce chorób cywilizacyjnych. Herba Pol 2007; 53(2):143-4. 5. Butt MS, Nazir A, Sultan MT, Schroën K. Morus alba L. nature’s functional tonic. Trends Food Sci Tech 2008; 19:505-12. 6. Memon AA, Memon N, Luthria DL i wsp. Phenolic acids profiling and antioxidant potential of mulberry (Morus laevigata W., Morus nigra L., Morus alba L.) leaves and fruits grown in Pakistan. Pol J Food Nutr Sci 2010; 60(1):25-32. 7. Chu Q, Miao L, Tian X i wsp. Study on capillary electrophoresis-amperometric detection profiles of different parts of Morus alba L. J Chromatogr A 2006; 1116:286-90.

