© Borgis - Postępy Fitoterapii 4/2013, s. 248-255
*Monika Maliszewska
Genisteina i 3,3’-diindolilometan w chemoprewencji nowotworów
Genistein and 3,3’-diindolylmethane in cancer chemoprevention
Katedra i Zakład Farmacji Fizycznej, Śląski Uniwersytet Medyczny
Kierownik Zakładu i Katedry: prof. dr hab. n. farm. Anna Sułkowska
Summary
Cancer is one of the most common causes of death in the world. There are some agents that can delayed, arrested or reversed the multi-step process of carcinogenesis. This approach is named chemoprevention and is known from more than 30 years. Some of these agents with chemopreventive properties are natural substances such as genistein and 3,3’-diindolylmethane. Each of the compounds shows broad spectrum of biological activity in vitro. There are many examples of epidemiological observations which confirm in vitro studies. This review summaries the basic data on genistein and 3,3’-diindolylmethane with chemopreventive activity in cancer.

Wykaz skrótów
AhR – receptor węglowodorów aromatycznych; Akt – kinaza serynowo-treoninowa B; AR – receptor androgenowy; ALP – fosfataza alkaliczna; ATF – aktywujący czynnik transkrypcyjny; Bad, Bax – białka proapoptotyczne, Bcl-2, Bcl-xL – białka antyapoptotyczne; CREB – czynnik trankrypcyjny; EGFR – receptor czynnika wzrostu naskórka; ER – receptor estrogenowy; ERK – kinazy regulowane przez sygnał zewnątrzkomórkowy; GADD – grupa białek naprawczych; IFNγ – interferon γ; JNK – kinaza domeny N-końcowej białka Jun; MMP-9 – metaloproteinaza macierzy zewnątrzkomórkowej-9; p-21 – inhibitor kinaz zależnych od cyklin; NF-κB – jądrowy czynnik transkrypcyjny; p-38 – kinaza białkowa aktywowana mitogenami; PSA – swoisty antygen sterczowy; ROS – reaktywne formy tlenu; TGFβ – transformujący czynnik wzrostu β; u-PA – aktywator plazminogenu typu urokinazy; VEGF – naczyniowo-śródbłonkowy czynnik wzrostu.
Wstęp
Od wielu lat najczęstszymi przyczynami zgonów na świecie, obok chorób układu krążenia, są nowotwory złośliwe. W 2010 roku, według Raportów Centrum Onkologii, w Polsce odnotowano ogółem ponad 140 000 zachorowań na nowotwory złośliwe oraz około 80 000 zgonów z powodu tej choroby. Wśród kobiet najczęstszą przyczyną zachorowań jest nowotwór złośliwy sutka (15 784 nowych zachorowań w 2010 roku). Rak płuca stanowi najczęstszą przyczynę zachorowań i zgonów u mężczyzn (14 794 nowych zachorowań w 2010 roku) (1). Z dostępnych danych wynika, że zarówno zachorowalność, jak i śmiertelność z powodu nowotworów złośliwych, pozostają na bardzo wysokim poziomie.
Jedną z form profilaktyki przeciwnowotworowej jest chemoprewencja. Koncepcja chemoprewencji zrodziła się ponad 30 lat temu za sprawą badań Sporna nad retinoidami (2). Zakłada ona stosowanie naturalnych lub farmakologicznych czynników, dzięki czemu możliwe jest zatrzymanie lub spowolnienie przebiegu kancerogenezy, a także regresja już powstałych zmian. Są to działania zapobiegawcze ingerujące w możliwie najwcześniejsze etapy procesu nowotworowego (3). Należy jednak zaznaczyć, że główna rola chemoprewencji nie polega na hamowaniu wzrostu zaawansowanego nowotworu, a raczej na odwracaniu wczesnych zmian przedrakowych i zapobieganiu przekształcaniu się ich w formę złośliwą (2). Czynniki chemoprewencyjne możemy podzielić, ze względu na ich aktywność na różnych etapach transformacji nowotworowej, na czynniki hamujące etap inicjacji (blokujące) i czynniki wpływające na etapy promocji i progresji kancerogenezy (supresyjne) (4).
Niniejsza publikacja przedstawia charakterystykę dwóch substancji pochodzenia naturalnego o aktywności przeciwnowotworowej – genisteiny i 3,3’-diindolilometanu, które mogą mieć zastosowanie w chemoprewencji nowotworów.
Genisteina
Genisteina jest głównym flawonowym składnikiem nasion soi (Glycyne max. Merill), występuje również w nasionach roślin strączkowych. Soja oraz jej przetwory są najbogatszym źródłem genisteiny. Zawartość genisteiny w wybranych produktach sojowych została przedstawiona w tabeli 1 (5).
Tabela 1. Zawartość genisteiny w produktach sojowych (mg/100g) (wg 5).
| Źródło genisteiny | Zawartość w żywności (mg/100 g) |
| Mąka sojowa pełnotłusta | 98,77 |
| Mąka sojowa odtłuszczona | 87,31 |
| Nasiona soi dojrzałe, świeże | 80,99 |
| Nasiona soi dojrzałe, suche, prażone (w tym orzechy sojowe) | 75,78 |
| Natto | 37,66 |
| Chipsy sojowe | 27,45 |
| Nasiona soi dojrzałe, w puszkach | 25,15 |
| Miso | 23,24 |
| Błonnik sojowy | 21,68 |
| Tofu smażone | 18,43 |
| Pasta sojowa | 17,79 |
| Jogurt sojowy | 16,59 |
| Tofu świeże przygotowane z siarczanem wapnia | 12,99 |
| Lecytyna sojowa | 10.30 |
| Jogurt tofu | 9,40 |
| Napój sojowy | 5,10 |
| Makaron sojowy | 3,70 |
| Ser sojowy, mozarella | 2,60 |
| Mleko sojowe, wszystkie smaki, z dodatkiem witaminy A i D oraz wapnia, niskotłuszczowe | 1,51 |
| Ser sojowy, parmezan | 0,80 |
| Mleko sojowe, wszystkie smaki, z dodatkiem witaminy A i D oraz wapnia, beztłuszczowe | 0,41 |
Omawiany związek występuje w swojej naturalnej formie w nieaktywnej postaci tj. 7-O-β-D-glukopiranozylogenisteiny (genistyna) oraz w postaci estrów z niższymi kwasami karboksylowymi (przede wszystkim malonowym i octowym). Pod wpływem działania żołądkowego kwasu solnego oraz nieswoistych β-glukozydaz bakteryjnych przewodu pokarmowego lub obecnych w żywności (endogennych lub dodanych podczas przetwarzania) następuje hydroliza glikozydu i powstaje aktywny aglikon – genisteina (6). Dalsze przemiany metaboliczne omawianego izoflawonu (reakcje dehydroksylacji, demetylacji i redukcji) zachodzą w jelicie, są złożone i nie zostały do końca poznane (7). Zaproponowano, że genisteina najpierw jest przekształcana przez bakterie jelitowe do dihydrogenisteiny. Następnie przez rozszczepienie pierścienia C powstaje 6’-hydroxy-ODMA, który dalej może być rozkładany przez mikroflorę jelitową do kwasu 4-hydroksy-2-propionowego i trihydroksybenzenu. Dekarboksylacja kwasu 4-hydroksy-2-propionowego może prowadzić do powstania produktu metabolizmu 4-etylofenolu (8). Możliwe ścieżki metaboliczne dla genisteiny przedstawia rycina 1.
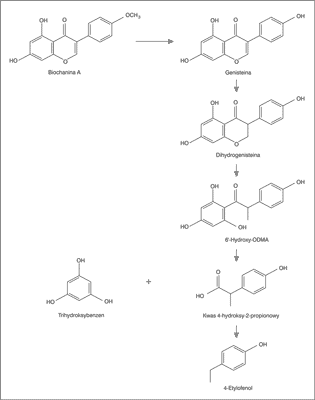
Ryc. 1. Możliwe szlaki metaboliczne biochaniny A lub genisteiny do 4-etylofenolu (wg 8).
W wyniku reakcji hydroksylacji powstaje 3’-OH-genisteina (3’,4’,5,7-tetrahydroksy-izoflawon), znana również jako orobol, która jest co najmniej tak samo aktywna jak genisteina w wielu testach in vitro (9). Można założyć, że genisteina jest poddana dalszej biotransformacji (O-metylacja) przez katecholo-O-metylotransferazę (COMT), ponieważ produkty aromatycznej hydroksylacji genisteiny mogą zawierać ugrupowanie katecholowe lub pirogalolowe (10). Może to być o tyle istotne, że katecholowe metabolity estrogenów są potencjalnymi kancerogenami biorącymi udział w etiologii raka sutka (11). W warunkach in vivo stwierdzono jednak bardzo małe ilości metylowanych pochodnych genisteiny, co świadczy o tym, że metylacja przez COMT nie odgrywa ważnej roli w biotransformacji tego izoflawonu in vivo (10). W wątrobie, przy udziale enzymów fazy II (UDP-glukuronozylotransferazy i sulfotransferazy) zachodzi sprzęganie metabolitów z kwasem glukuronowym lub/i kwasem siarkowym. Glukuronidowe i siarczanowe koniugaty genisteiny trafiają następnie do krążenia wątrobowo-jelitowego. Genisteina jest wydalana z moczem jako monoglukuronid na poziomie około 53-76% oraz w znacznie mniejszym stopniu jako diglukuronid (12-16%) i sulfoglukuronid (2-15%) (8). Jedynie 1-2% genisteiny wydalane jest z moczem w postaci niezmienionej (7).
Genisteina jest flawonoidem, który od dawna wzbudza ogromne zainteresowanie naukowców. Wpływ na to miały niewątpliwie wyniki badań dotyczących epidemiologii nowotworów. Wykazały one odwrotną zależność pomiędzy spożywaniem znacznych ilości produktów sojowych, które obfitują w genisteinę, a zachorowalnością na nowotwory sutka i prostaty oraz śmiertelnością z powodu tych nowotworów. Ustalono, że stężenie genisteiny w płynach ustrojowych w populacjach azjatyckich w porównaniu do mieszkańców krajów zachodnich, jest wielokrotnie wyższe (od 7 do 110 razy w osoczu i ok. 30 razy w moczu) (12). Śmiertelność z powodu raka sutka i prostaty w populacjach Dalekiego Wschodu (spożycie 20-80 mg genisteiny dziennie) jest 4-10 razy niższa w porównaniu do śmiertelności z powodu tych nowotworów w krajach Zachodu (spożycie 1-3 mg genisteiny dziennie) (13). Badania przeprowadzone przez Yamamoto i wsp. (14) w Japonii wskazują, że częste spożycie izoflawonów jest związane z zmniejszeniem ryzyka raka sutka. Również badania Cotterchio i wsp. (15) wśród kobiet z Kanady wykazały ujemną korelację między spożyciem fitoestrogenów, a ryzykiem zachorowania na raka sutka. Okazało się jednak, że redukcja ryzyka była istotna statystycznie jedynie wśród kobiet przed menopauzą, które mają nadwagę (BMI > 25). U kobiet po menopauzie nie wykazano istotnego statystycznie związku zaobserwowanego między ryzykiem zachorowania na raka sutka a spożyciem fitoestrogenów. Również badania na modelach zwierzęcych potwierdzają hamujący wpływ diety bogatej w genisteinę na proces kancerogenezy indukowany czynnikami chemicznymi lub promieniowaniem (12).
Z wielu badań in vitro i in vivo wynika, że genisteina charakteryzuje się szerokim wachlarzem działań biologicznych. Właściwości genisteiny, które uzasadniają stosowanie jej w chemoprewencji nowotworów, to m.in. właściwości przeciwutleniające, hamujące angiogenezę, aktywność antyproliferacyjna, działanie proapoptotyczne, zdolność do indukcji różnicowania, wpływ na cykl komórkowy i uczestniczące w nim cząsteczki o działaniu regulatorowym (6). Jednak jedną z najbardziej znanych właściwości genisteiny jest jej aktywność estrogenna. Fitoestrogeny mają bardzo podobną chemiczną strukturę do 17β-estradiolu i wiążą się z receptorami estrogenowymi (ER), z preferencją dla ER-β. I chociaż genisteina wykazuje słabe powinowactwo do receptora estrogenowego, z powodzeniem konkuruje z jego naturalnym substratem – estradiolem o wiązanie z receptorem, a odpowiedni kompleks wywołuje docelowy efekt hormonalny. Z powodu strukturalnego podobieństwa fitoestrogenów do estrogenów fizjologicznych można założyć, że mogą promować kancerogenezę i zwiększać ryzyko zachorowania na raka sutka. Jednak obserwacje epidemiologiczne wskazują, że w krajach, gdzie spożywa się w diecie znaczące ilości fitoestrogenów, występuje najniższa częstość zachorowania na raka sutka.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. http://epid.coi.waw.pl/krn/ 2. Sporn MB, Dunlop NM, Newton DL i wsp. Prevention of chemical carcinogenesis by vitamin A and its synthetic analogs (retinoids). Fed Proc 1976; 35:1332-8. 3. Sporn MB, Suh N. Chemoprevention of cancer. Carcinogenesis 2000; 21:525-30 4. Szczepański MA, Grzanka A. Chemoprewencyjne i przeciwnowotworowe właściwości kurkuminy. Nowotwory 2009; 59:377-84. 5. http://www.ars.usda.gov/SP2UserFiles/Place/12354500/Data/isoflav/Isoflav_R2.pdf. 6. Radzikowski C, Wietrzyk J, Grynkiewicz G i wsp. Genisteina – izoflawonoid soi o zróżnicowanym mechanizmie działania – implikacje kliniczne w lecznictwie i prewencji chorób nowotworowych. Post Hig Med Dośw 2004; 58:128-39. 7. Kwiatkowska E. Fitoestrogeny sojowe w profilaktyce chorób cywilizacyjnych. Post Fitoter 2007; (4):207-11.
8. http://edepot.wur.nl/121793 9. Tomonaga T, Mine T, Kojima I i wsp. Isoflavonoids, genistein, psi-tectorigenin, and orobol, increase cytoplasmic free calcium in isolated rat hepatocytes. Biochem Biophys Res Commun 1992; 182:894-9. 10. Kulling SE, Honig DM, Metzler M. Oxidative metabolism of the soy isoflavones daidzein and genistein in humans in vitro and in vivo. J Agric Food Chem 2001; 49:3024-33. 11. Bolton JL, Yu L, Thatcher GR. Quinoids formed from estrogens and antiestrogens. Meth Enzymol 2004; 378:110-23. 12. Grynkiewicz G i wsp. Bioaktywny izoflawon genisteina – perspektywy zastosowań medycznych. Post Fitoter 2000; 3:15-20. 13. Ball S. Naturalne substancje przeciwnowotworowe. Medyk, Warszawa 2000. 14. Yamamoto S, Sobue T, Kobayashi M i wsp. Soy, isoflavones, and breast cancer risk in Japan. J Natl Cancer Inst 2003; 18:906-13. 15. Cotterchio M, Boucher BA, Kreiger N i wsp. Dietary phytoestrogen intake – lignans and isoflavones – and breast cancer risk (Canada). Cancer Causes Control 2008; 19:259-72. 16. Czerpak R, Pietryczuk A, Jabłońska-Trypuć A i wsp. Aktywność biologiczna izoflawonoidów i ich znaczenie terapeutyczne i kosmetyczne. Post Fitoter 2009; (2):113-21. 17. McMichael-Phillips DF, Harding C, Morton M i wsp. Effects of soy-protein supplementation on epithelial proliferation in the histologically normal human breast. Am J Clin Nutr 1998; 68:1431-5. 18. Grosicka-Maciąg E. Biologiczne skutki stresu oksydacyjnego wywołanego działaniem pestycydów. Post Hig Med Dośw 2011; 65:357-66. 19. Wei H, Bowen R, Cai Q i wsp. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc Soc Exp Biol Med 1995; 208:124-30. 20. Majewska M, Czeczot H. Flawonoidy w profilaktyce i terapii. Farm Pol 2009; 65:369-77. 21. Mizia-Malarz A, Sobol G, Woś H. Angiogeneza w przewlekłych schorzeniach zapalnych i nowotworowych. Pol Merk Lek 2008; 141:185-9. 22. Fotsis T, Pepper M, Adlercreutz H. Genistein, a dietary ingested isoflavonoid, inhibits cell proliferation and in vitro angiogenesis. J Nutr 1995; 125:790-7. 23. Maliszewska M. Kurkumina, indolo-3-karbinol i resweratrol w chemoprewencji raka sutka. Post Fitoter 2013; (1):28-35 24. Wattenberg LW, Loub WD. Inhibition of polycyclic aromatic hydrocarbon-induced neoplasia by naturally occurring indoles. Cancer Res 1978; 38:1410-3. 25. Le HT, Schaldach CM, Firestone GL i wsp. Plant-derived 3,3’-diindolylmethane is a strong androgen antagonist in human prostate cancer cells. J Biol Chem 2003; 278:21136-45. 26. Leong H, Firestone GL, Bjeldanes LF. Cytostatic effects of 3,3’-diindolylmethane in human endometrial cancer cells result from an estrogen receptor-mediated increase in transforming growth factor-alpha expression. Carcinogenesis 2001; 22:1809-17. 27. Bonnesen C, Eggleston IM, Hayes JD. Dietary indoles and isothiocyanates that are generated from cruciferous vegetables can both stimulate apoptosis and confer protection against DNA damage in human colon cell lines. Cancer Res 2001; 61:6120-30. 28. Jin L, Qi M, Chen DZ i wsp. Indole-3-carbinol prevents cervical cancer in human papilloma virus type 16 (HPV16) transgenic mice. Cancer Res 1999; 59:3991-7 29. Struciński P, Ludwicki JK, Góralczyk K i wsp. Wybrane aspekty działania ksenoestrogenów z grupy persystentnych związków chloroorganicznych. Roczn Państw Zakł Hig 2000; 3:211-28. 30. Cover CM, Hsieh SJ, Tran SH i wsp. Indole-3-carbinol inhibits the expression of cyclin-dependent kinase-6 and induces a G1 cell cycle arrest of human breast cancer cells independent of estrogen receptor signaling. J Biol Chem 1998; 273:3838-47. 31. Hong C, Firestone GL, Bjeldanes LF. Bcl-2 family-mediated apoptotic effects of 3,3’-diindolylmethane (DIM) in human breast cancer cells. Biochem Pharmacol 2002; 63:1085-97. 32. Weng JR, Tsai CH, Kulp SK i wsp. Indole-3-carbinol as a chemopreventive and anti-cancer agent. Cancer Lett 2008; 262:153-63. 33. Kong D, Li Y, Wang Z. Inhibition of angiogenesis and invasion by 3,3’-diindolylmethane is mediated by the nuclear factor-kappaB downstream target genes MMP-9 and u-PA that regulated bioavailability of vascular endothelial growth factor in prostate cancer. Cancer Res 2007; 67:3310-9. 34. Howells LM, Moiseeva EP, Neal CP. Predicting the physiological relevance of in vitro cancer preventive activities of phytochemicals. Acta Pharmacol Sin 28:1274-304.

