© Borgis - Postępy Nauk Medycznych 5/2014, s. 346-351
*Radosław Chutkowski, Małgorzata Malec-Milewska
Kardiometria elektryczna – nowa metoda nieinwazyjnego monitorowania hemodynamicznego
Electrical velocimetry – a new noninvasive hemodynamic monitoring system
Klinika Anestezjologii i Intensywnej Terapii, Centrum Medyczne Kształcenia Podyplomowego, Warszawa
p.o. Kierownika Kliniki: dr med. Małgorzata Malec-Milewska
Streszczenie
Monitorowanie parametrów hemodynamicznych układu krążenia, a zwłaszcza rzutu serca (CO) i objętości wyrzutowej (SV), jest niezbędne nie tylko u pacjentów z chorobami układu krążenia, chorobami endokrynologicznymi (np. nadczynnością tarczycy), neurologicznymi, ale również u pacjentów po urazach czy w sepsie. Najprościej metody oceniające pracę serca i układ krążenia możemy podzielić na dwie grupy – metody inwazyjne i nieinwazyjne. Metody inwazyjne wymagają założenia specjalnych cewników do serca lub do żyły centralnej i tętnicy. Natomiast metody nieinwazyjne nie naruszają ciągłości skóry i tkanek pacjenta. Do metod inwazyjnych zaliczamy: metody Ficka (bezpośrednią i pośrednią), metodę rozcieńczeń barwnika, metodę termodilucji (PATD, PAC-CO), metodę ciągłego pomiaru rzutu serca (PAC-CCO), wentrykulografię oraz metody oparte na analizie fali tętna (PWA): analiza konturu pulsu (PICCO), analiza mocy pulsu (LIDCO) i APCO (Vigileo). Do metod nieinwazyjnych zaliczamy: rezonans magnetyczny, echokardiografię, fotoakustyczną ocenę gazów oddechowych, elektryczną bioimpedancję klatki piersiowej (TEB) i kardiometrię elektryczną (ang. electrical velocimetry – EV). Metoda kardiometrii elektrycznej (EV) opiera się na zmodyfikowanym pomiarze elektrycznej bioimpedancji klatki piersiowej (TEB). Jest to stosunkowo nowa metoda, charakteryzująca się ciągłością pomiaru, łatwością wykonania, praktycznie brakiem kosztów eksploatacyjnych (potrzebne są cztery elektrody EKG), możliwością zastosowania u większości pacjentów. W nielicznych przeprowadzonych dotychczas badaniach kardiometria elektryczna wykazuje istotną korelację z innymi metodami oceny rzutu serca. Z tych powodów może być cennym narzędziem diagnostycznym.
Summary
Cardiovascular monitoring of the hemodynamic parameters: cardiac output (CO) and stroke volume (SV) in particular, is essential not only in patients with cardiac, endocrinological (e.g. hyperthyroidism) or neurological diseases, but also in traumatic or septic patients. In general, hemodynamic monitoring systems can be divided into noninvasive and invasive methods. Invasive methods require catheterization the heart or central vein and artery. Noninvasive methods require no skin and tissue damage. Invasive methods are: Fick’s method (direct and indirect), indicator dilution systems, thermodilution (PATD, PAC-CO), continuous cardiac output (PAC-CCO) system, ventriculography and pulse waveform analysis (PWA) systems: pulse contour analysis (PICCO), pulse power analysis (LIDCO) and APCO (Vigileo). Noninvasive methods are MRI, echocardiography, inert gas rebreathing system, thoracic electric bioimpedance (TEB) and electrical velocimetry (EV). Electrical velocimetry is based on the modified thoracic bioimpedance measurement. It is a new method, which enables continuous monitoring, is easy to apply, not expensive (requires applying only 4 skin ECG electrodes), and may be used in most patients. Electrical velocimetry shows good correlation with other cardiac output monitoring systems according to the limited number of studies that are available. For these reasons electrical velocimetry might be an important diagnostic tool.

Wstęp
Choroby układu krążenia zajmują pierwsze miejsce w statystykach dotyczących zachorowalności i stanowią główną przyczynę zgonów. Aby móc je skutecznie rozpoznawać i leczyć, potrzebne są nowoczesne narzędzia diagnostyczne, umożliwiające ocenę parametrów hemodynamicznych układu krążenia. Istnieje wiele metod oceny funkcji układu krążenia, a najprościej można podzielić je ze względu na stopień agresywności na: metody inwazyjne, mniej inwazyjne (o ograniczonej inwazyjności) i nieinwazyjne. Do metod inwazyjnych związanych z koniecznością cewnikowania prawego lub lewego serca zaliczamy: bezpośrednią metodę Ficka, pośrednią metodę Ficka, metodę rozcieńczeń barwnika, metodę termodilucji (PATD, PAC-CO), metodę ciągłego pomiaru rzutu serca (PAC-CCO) czy wentrykulografię. Do metod mniej inwazyjnych zaliczamy te oparte na analizie fali tętna (PWA): analizę konturu fali tętna (ang. pulse contour analysis – PICCO), analizę mocy fali tętna (ang. pulse power analysis – LIDCO) i algorytm APCO (Vigileo). Ostatnia grupa to metody nieinwazyjne, a wśród nich: rezonans magnetyczny, echokardiografia, fotoakustyczna ocena gazów oddechowych, elektryczna bioimpedancja klatki piersiowej (TEB) czy kardiometria elektryczna (ang. electrical velocimetry – EV). Każda z tych metod ma swoje zalety i wady. Metody inwazyjne są czasochłonne, skomplikowane, kosztowne, obarczone ryzykiem zakażenia i wymagają przeszkolonego personelu, a wyniki nie zawsze są powtarzalne. Niestety również wśród metod nieinwazyjnych nie ma jednej idealnej. Nawet stosunkowo tania echokardiografia wymaga dużego doświadczenia od osoby wykonującej badania, a jej dostępność bywa bardzo różna (1).
Obiecująco prezentują się dwie spośród metod nieinwazyjnych. Są to elektryczna bioimpedancja klatki piersiowej (TEB), zwana też kardiografią impedancyjną (ICG), i kardiometria elektryczna (EV). Wśród zalet TEB i EV są wymieniane: możliwość długotrwałego i ciągłego pomiaru rzutu serca (CO), systemowego oporu naczyniowego (SVR), płynu w klatce piersiowej (TFC), łatwość stosowania, niskie koszty eksploatacyjne, praktycznie brak ograniczeń stosowania co do miejsca, czasu, stanu czy wieku chorego. Ograniczeniem tych metod jest niedokładność pomiarów u pacjentów z zaburzeniami rytmu i z niedomykalnością zastawki aortalnej (1, 2).
Warto też wspomnieć, że w naszym kraju znaczący wkład w rozwój nieinwazyjnych metod monitorowania hemodynamicznego serca wniósł dr hab. inż. Gerard Cybulski. Skonstruował on polski przenośny kardiograf impedancyjny typu Holtera (3). W wielu polskich ośrodkach kardiografia impedancyjna od lat jest z powodzeniem wykorzystywana do monitorowania parametrów hemodynamicznych w leczeniu nadciśnienia tętniczego, zespołu metabolicznego, niewydolności serca czy w testach z próbą Valsalvy (3-6).
Podstawy fizyczne metody
Kardiometria elektryczna jest nieinwazyjną metodą oceny hemodynamicznej układu krążenia, u podstaw której leży elektryczna bioimpedancja klatki piersiowej (TEB).
TEB polega na określeniu bezpośredniej zależności między zmianą oporności tkanek (bioimpedancją) a przepływem krwi przez duże naczynia tętnicze w badanej okolicy ciała (np. w klatce piersiowej). Mięsień sercowy cyklicznie kurczy się i rozkurcza, powodując pulsacyjny przepływ krwi. W czasie skurczu krew jest wrzucana z prawej komory do pnia płucnego, a z lewej komory do aorty. Objętość komór w skurczu maleje, a prędkość i objętość przemieszczanej krwi narasta, powodując rozszerzenie aorty wstępującej i tętnic płucnych (ryc. 1). Poszczególne tkanki ludzkiego ciała mają własny opór elektryczny (impedancję), który wynika z ich budowy (rodzajów pierwiastków, atomów), gęstości i temperatury. Impedancja jest odwrotnością przewodności. Klatka piersiowa składa się z tkanek o wysokim oporze – tkanka tłuszczowa, mięśnie, kości, płuca (R = 2000-5000 Ω-cm), i krwi, która jest dobrym przewodnikiem (R = 130 Ω-cm). Najlepszym przewodnikiem prądu elektrycznego jest osocze krwi (R = 65 Ω-cm), w którym są zawieszone elementy morfotyczne mające dużo większą oporność elektryczną. Spośród elementów morfotycznych istotne znaczenie mają tylko erytrocyty. Krwinki czerwone mają kształt dwuwklęsłego dysku. Podczas skurczu lewej komory dochodzi do szybkiego przepływu krwi do aorty. Szczyt tego przepływu występuje tuż po otwarciu zastawki aortalnej, wymuszając równoległe układanie się erytrocytów względem siebie i ściany naczynia. Takie ustawienie krwinek czerwonych ułatwia przepływ prądu elektrycznego, czyli spada mierzone napięcie prądu, a wzrasta przewodność (maleje impedancja). W czasie rozkurczu lewej komory serca zastawka aortalna jest zamknięta i w aorcie nie ma przepływu krwi. Sytuacja ta powoduje, że erytrocyty układają się chaotycznie, stanowiąc dodatkowy opór, który musi pokonać przyłożony prąd elektryczny. Skutkiem tego jest wzrost mierzonego napięcia prądu elektrycznego i spadek przewodności (wzrost impedancji) (ryc. 2) (1, 2, 7, 8).

Ryc. 1. Przepływ krwi przez aortę – rozszerzenie objętościowe tuż po otwarciu zastawki aortalnej (9).
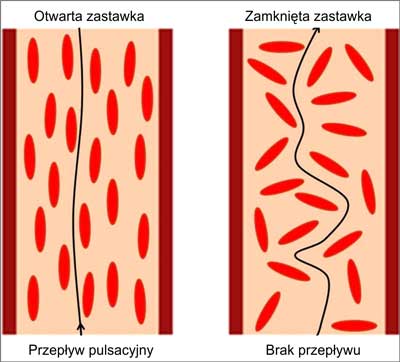
Ryc. 2. Przepływ prądu przez aortę.
TEB jest metodą nieinwazyjną, ciągłą, a zastosowanie małych prądów 2-4 mA o częstotliwości 20-100 Hz jest całkowicie nieodczuwalne i bezpieczne. W ciągłym pomiarze elektrycznej bioimpedancji klatki piersiowej rejestrowany sygnał przedstawiony jest jako fala bioimpedancyjna. Krzywa ta stanowi głównie odzwierciedlenie zmian zachodzących w aorcie wstępującej, a więc jest zależna od cyklu pracy mięśnia sercowego i swoim kształtem przypomina kształt fali ciśnienia tętniczego. Tak więc podstawą kardiografii impedancyjnej jest model interpretacji sygnału bioimpedancji, zakładający, że bezpośrednio po otwarciu zastawki aortalnej i wzroście objętości (rozszerzenie objętościowe) w podatnej aorcie wstępującej dochodzi do gwałtownego wzrostu przewodności elektrycznej w klatce piersiowej, czyli spadku bioimpedancji (1, 2, 7, 8).
W 2001 roku Bernstein i Osypka zaproponowali inny model interpretacji sygnału bioimpedancji, na którym została oparta nowa metoda zwana kardiometrią elektryczną (ang. electrical velocimetry) (9, 10). Jest to model elektrycznego pomiaru prędkości przepływu (EV), którego podstawą są zmiany przewodności krwi w aorcie. Zakłada on, że zmiana ustawienia erytrocytów z chaotycznego (brak przepływu) na ukierunkowanie zgodne (równoległe do kierunku przepływu) po otwarciu zastawki aortalnej wywołuje gwałtowny wzrost przewodności (z gwałtownym spadkiem impedancji).
Urządzenia wykorzystujące metodę kardiometrii elektrycznej AESCULON® i ICON® dokonują pomiaru elektrycznej bioimpedancji klatki piersiowej (TEB) – głównie zmian bioimpedancji zależnie od cyklu pracy serca, dzięki którym wyliczają objętość wyrzutową serca (SV).
Pomiar dokonywany jest przez układ czterech elektrod EKG umieszczanych na skórze. Dwie elektrody przykleja się po lewej stronie na szyi (jedna pod drugą), a kolejne dwie – na klatce piersiowej w linii środkowo-pachowej lewej, na wysokości wyrostka mieczykowatego (też jedna pod drugą) (ryc. 3). Przez parę zewnętrznych elektrod przepływa prąd zmienny (AC) o stałej amplitudzie, wytwarzany przez aparat. Prąd ten płynie w klatce piersiowej przez tkanki o najniższym oporze (krew jest najlepszym przewodnikiem), pokonując jak najkrótszą drogę, którą jest aorta wstępująca i zstępująca. Para wewnętrznych elektrod rejestruje powstałe napięcie i wytwarza powierzchniowy zapis EKG (9, 11).

Ryc. 3. Rozmieszczenie elektrod EKG (9).
Wskaźnik podanego prądu i zmierzonego napięcia jest równy przewodności, która jest odwrotnością impedancji. Na bioimpedancję mierzoną w czasie Z(t) składają się trzy wartości: impedancja podstawowa Z0, która jest pseudostatyczną częścią impedancji, a jej wielkość wynika głównie z objętości płynów w klatce piersiowej, do których wliczana jest też krew; zmiany impedancji zależne od oddychania ΔZR; zmiany impedancji zależne od cyklu pracy serca ΔZC:
Z(t) = Z0 + ΔZR + ΔZC
W prezentowanej metodzie przy obliczaniu objętości wyrzutowej serca (SV) zmiany impedancji zależne od oddychania ΔZR traktowane są jako artefakt i zostają wytłumione (12).
Przebieg zapisu zmian impedancji zależnych od cyklu pracy serca ΔZC w czasie ma kształt fali sygnału zbliżony do kształtu fali ciśnienia tętniczego.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Krzesiński P, Gielerak G, Kowal J: Kardiografia impedancyjna – nowoczesne narzędzie terapii monitorowanej chorób układu krążenia. Kardiologia Polska 2009; 67: 65-71.
2. Kim DW: Detection of physiological events by impedance. Yonsei Med J 1989; 30: 1-11.
3. Cybulski G, Koźluk E, Michalak E et al.: Holter-type impedance cardiography device. A system for continuous and non-invasive monitoring of cardiac haemodynamics. Kardiologia Polska 2004; 61(8): 138-146.
4. Niewiadomski W, Pilis W, Laskowska D et al.: Effects of a brief Valsalva manoeuvre on hemodynamic response to strength exercises. Clin Physiol Funct Imaging 2012; 32(2): 145-157.
5. Cybulski G: Reokardiograficzna optymalizacja leczenia hipotensyjnego. Kardiologia Polska 2012; 70(6): 608.
6. Niewiadomski W, Pilis A, Strasz A et al.: In aged men, central vessel transmural pressure is reduced by brief Valsalva manoeuvre during strength exercise. Clin Physiol Funct Imaging 2013 Aug 26; doi: 10.1111/cpf.12080.
7. Woltjer HH, Bogaard HJ, de Vries PM: The technique of impedance cardiography. Eur Heart J 1997; 18: 1396-1403.
8. Summers RL, Shoemaker WC, Peacock WF et al.: Bench to bedside: electrophysiologic and clinical principles of noninvasive hemodynamic monitoring using impedance cardiography. Acad Emerg Med 2003; 10: 669-680.
9. Wong J: Non-invasive output and oxygen delivery measurements in acute critical anemia PAS 2010, Vancouver.
10. Zoremba N, Bickenbach J, Krauss B et al.: Comparison of electrical velocimetry and thermodilution techniques for the measurement of cardiac output. Acta Anaesthesiol Scand 2007; 51: 1314-1319.
11. Suttner S, Shöllhorn T, Boldt J et al.: Noninvasive assessment of cardiac output using thoracic electrical bioimpedance in hemodynamically stable and unstable patients after cardiac surgery: a comparison with pulmonary artery thermodilution. Intensive Care Med 2006 Dec; 32(12): 2053-2058.
12. Bernstein DP, Osypka MJ: Apparatus and method for determining an approximation of stroke volume and cardiac output of the heart. US Patent 6,511,438 B2, January 2 2003.
13. Osthaus WA, Hubert D, Beck C et al.: Comparison of electrical velocimetry and transpulmonary thermodilution for measuring cardiac output in piglets. Pediatric Anesthesia 2007 Aug 17; 8: 749-755.
14. Norozi K, Beck C, Osthaus WA et al.: Electrical velocimetry for measuring cardiac output in children with congenital heart disease. Br J Anaesth 2008; 100(1): 88-94.
15. Schmidt C, Theilmeier G, Van Aken H et al.: Comparison of electrical velocimetry and transoesophageal doppler echocardiography for measuring stroke volume and cardiac output. Br J Anaesth 2005 Nov; 95(5): 603-610.



