© Borgis - Postępy Nauk Medycznych 6/2014, s. 405-409
*Joanna Pilch-Kowalczyk, Jan Baron
Diagnostyka obrazowa w ostrym zapaleniu trzustki
Diagnostic imaging of acute pancreatitis
Katedra Radiologii i Medycyny Nuklearnej, Śląski Uniwersytet Medyczny, Katowice
Kierownik Katedry: dr hab. med. Jan Baron
Streszczenie
Ostre zapalenie trzustki (OZT) jest chorobą o bardzo zróżnicowanym przebiegu klinicznym. Do bieżącej oceny lub predykcji ciężkości OZT służy wiele skal kliniczno-laboratoryjnych, jednak najszersze zastosowanie znajduje tomografia komputerowa (TK), oceniająca zmiany morfologiczne samej trzustki i jej najbliższego otoczenia. Liczbowym zapisem zmian trzustkowych, okołotrzustkowych, stopnia martwicy trzustki i okołotrzustkowych zbiorników ostrej fazy jest Computed Tomography Severity Index (CTSI) przydatny do prognozowania stopnia ciężkości OZT. Standardem oceny ciężkości OZT jest zmodyfikowana klasyfikacja z Atlanty, która łączy elementy morfologiczne z parametrami klinicznymi OZT, po ostatniej modyfikacji uwzględniając również wyniki badań obrazowych. W pracy przedstawiono zasady diagnostyki obrazowej OZT ze szczególnym uwzględnieniem zbiorników wewnątrz- i okołotrzustkowych oraz powikłań okołotrzustkowych. Zmodyfikowana klasyfikacja z Atlanty definiuje na nowo zbiorniki okołotrzustkowe: zbiornik ostrej fazy, torbiel rzekoma, ostry zbiornik martwicy, zbiornik otorbionej martwicy zaznaczając, że każdy z nich może być jałowy lub zakażony. Skale prognostyczne uwzględniające powikłania okołotrzustkowe lub narządowe to zmodyfikowana przez Mortele skala CTSI oraz skala EPIC.
Summary
Acute pancreatitis (AP) is a disease of complex spectrum of clinical severity. Many clinical-laboratory diagnostic scales are used to assess current or predicted severity of AP, however, computed tomography (CT) evaluating morphological alterations within and beyond pancreas is most widely used tool for this purpose. Computed Tomography Severity Index (CTSI) is a semiquantitive scale taking into account pancreas, peripancreatic structures, size of necrosis and acute phase fluid collections and was found very useful for AP prognosis. The standard method to assess AP status is modified Atlanta classification that combines imaging and clinical features of AP. This article presents the principles of diagnostic imaging of AP with particular attention given to intra- and peripancreatic fluid collections and peripancreatic complications. Modified Atlanta classification redefines the peripancreatic fluid collections: acute peripancreatic fluid collection, pancreatic pseudocyst, acute necrotic collection, walled-off necrosis, each of them able to be infected or sterile. The prognostic scales which take into account the peripancreatic complications are: the CTSI modified by Mortele and the EPIC scale.

Wstęp
Ostre zapalenie trzustki (OZT) jest chorobą, w przebiegu której oprócz niewydolności trzustki dochodzić może zarówno do objęcia procesem zapalnym sąsiednich tkanek, jak i uszkodzenia odległych narządów. Aktualnie w ocenie ciężkości OZT stosowana jest kolejna modyfikacja klasyfikacji klinicznej z Atlanty, odnosząca się zarówno do objawów klinicznych, jak i zmian morfologicznych stwierdzanych w badaniach obrazowych (ostatnia modyfikacja miała miejsce w 2012 roku).
Kliniczne rozpoznanie OZT opiera się na obecności dwóch spośród trzech objawów (1-3):
– bólu brzucha sugerującego OZT,
– aktywności surowiczej amylazy i/lub lipazy trzykrotnie przekraczającej górną granicę normy,
– charakterystycznych cech OZT w jednym z badań obrazowych (USG, TK lub MR).
OZT przyjmować może skrajnie różne postacie – od łagodnej, dla której obecnie przyjęto nazwę ostrego, śródmiąższowego, obrzękowego zapalenia trzustki (ang. interstitial edematous pancreatitis – IEP), do postaci ciężkiej, określanej jako martwicze OZT (ang. necrotising pancreatitis – NP). W klinicznym spektrum OZT zdecydowanie przeważa postać łagodna, która dotyczy około 80% przypadków tej choroby.
We wczesnym stadium OZT po kontrastowe badania obrazowe sięga się wyłącznie, jeśli obraz kliniczny jest nietypowy, tzn. nie zostały spełnione dwa z wyżej wymienionych kryteriów diagnostycznych lub istnieje konieczność przeprowadzenia diagnostyki różnicowej z innym ostrym schorzeniem jamy brzusznej (1). We wczesnym okresie OZT w badaniach obrazowych można oczekiwać następujących zmian trzustkowych i okołotrzustkowych: obrzęku trzustki, zaburzeń perfuzji tego narządu oraz tzw. zbiorników ostrej fazy (1-3). Obrzęk trzustki jest efektem wysięku osocza do zrębu łącznotkankowego z obecnością drobnych ognisk martwicy tkanki tłuszczowej, niewidocznych jeszcze w badaniach obrazowych. W postaci obrzękowej OZT występuje fragmentaryczne lub rozlane zwiększenie objętości narządu z niewielkimi zmianami morfologicznymi. W obrazie USG stwierdza się obniżenie echogeniczności trzustki, w TK nieznaczne zmniejszenie jej densyjności, natomiast w MR sygnał trzustkowy jest nieco obniżony w sekwencjach T1-zależnych i podwyższony w sekwencjach T2-zależnych. Zaburzenia perfuzji narządu możliwe są do wykrycia wyłącznie w badaniach z dożylnym podaniem środków kontrastowych. W Polsce rzadko wykonuje się w tym celu USG lub MR, jako badania zbyt kosztowne i mało dostępne. W badaniu TK wykonanym po dożylnym podaniu jodowego środka kontrastowego pojawia się słabsze niż u osób ze zdrową trzustką wzmocnienie, które powinno przyjmować wartość około 150 j.H. w późnej fazie tętniczej/fazie miąższowej i 100 j.H. w fazie wrotnej badania. Zaburzenie perfuzji trzustki koreluje z późniejszym rozwojem martwicy.
Zbiornik ostrej fazy
Zbiornik ostrej fazy (ang. acute peripancreatic fluid collection – APFC) jest pierwszym zbiornikiem płynu, jaki pojawia się w przebiegu OZT. Jest on zbiornikiem płynu okołotrzustkowego o niskim, jednorodnym pochłanianiu promieni rentgenowskich, który towarzyszy łagodnej postaci OZT w trakcie pierwszych 4 tygodni trwania choroby. Zwykle znajdowany jest on wzdłuż powięzi przednerkowych, częściej po stronie lewej. APFC nie posiada własnych ścian, a jego ograniczenie stanowią wyłącznie struktury anatomiczne (ryc. 1). W przypadku dużej ilości płynu APFC może rozwarstwiać powięzie lub penetrować w głąb narządów miąższowych, takich jak śledziona lub wątroba, naśladując torbiele tych narządów (4). U 50-70% pacjentów APFC ulega samoistnej resorpcji po około 2 tygodniach (5). Zbiorniki płynowe powstałe w późniejszym okresie OZT są torbielami rzekomymi oraz zbiornikami martwicy. W pojedynczym badaniu TK mogą występować trudności w jednoznacznej klasyfikacji zbiornika płynowego, lecz wątpliwości te rozwiewa zwykle kolejne badanie TK, ze względu na dynamikę zmian morfologicznych tych struktur. Często konieczne jest też uzupełnienie diagnostyki o badanie ultrasonograficzne. Jeśli istnieje potrzeba potwierdzenia łączności zbiornika płynowego z przewodem trzustkowym lub przetoki do jamy opłucnowej, przydatny jest MR.
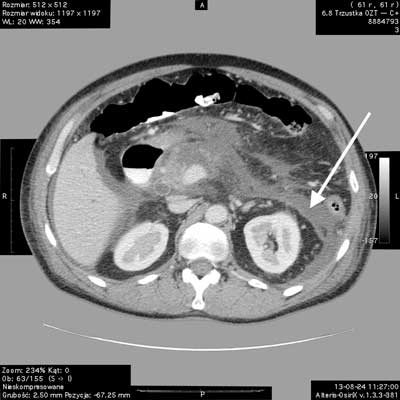
Ryc. 1. TK jamy brzusznej po dożylnym podaniu kontrastu, w fazie żylno-wrotnej. OZT - wokół trzustki zbiornik ostrej fazy - płyn ograniczony strukturami anatomicznymi, rozlewa się wzdłuż powięzi przednerkowej obustronnie, ale z przewagą strony lewej (ryc. 1 strzałka).
Torbiel rzekoma
Jeżeli zbiornik ostrej fazy nie ulegnie resorpcji, a wokół zbiornika powstanie łącznotkankowa ściana, jako reakcja otaczających tkanek na drażniące działanie płynu, to efektem tych zjawisk jest tzw. torbiel rzekoma (ang. pancreatic pseudocyst – PP). Zlokalizowana jest ona w sąsiedztwie trzustki, posiada wyraźną torebkę i okrągły lub owalny kształt (ryc. 2). Zawartość torbieli rzekomej stanowi jednolicie hipodensyjny płyn, bez obecności litych tkanek (1, 3). Dodatkowo nowa klasyfikacja z Atlanty wprowadza pojęcie prawdziwej trzustkowej torbieli rzekomej (ang. true pancreatic pseudocyst), która powstaje w wyniku wycieku soku trzustkowego poza światło przewodów trzustkowych w wyniku uszkodzenia ich ściany. W obrębie tak powstałego zbiornika w badaniach obrazowych nie stwierdza się tkanek martwiczych (2). U pacjentów z martwiczym zapaleniem trzustki, u których dochodzi do uszkodzenia przewodu trzustkowego, najczęściej na poziomie cieśni lub bliższej części trzonu gromadzący się sok trzustkowy prowadzi do odseparowania od siebie miąższu głowy i ogona trzustki, co określa się mianem zespołu rozłączonego przewodu (ang. disconnected duct syndrome). Taki zbiornik powstaje zazwyczaj kilka tygodni po zabiegu nekrozektomii, kiedy sok trzustkowy może swobodnie gromadzić się w przestrzeni powstałej po usuniętych tkankach martwiczych (1).

Ryc. 2. TK jamy brzusznej po dożylnym podaniu kontrastu. Do trzonu i ogona trzustki przylega cienkościenny zbiornik płynu – torbiel rzekoma.
Ostry zbiornik martwicy
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Banks PA, Bollen TL, Dervenis C et al.: Acute Pancreatitis Classification Working Group: Classification of acute pancreatitis – 2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62: 102-111.
2. Sarr MG: 2012 revision of the Atlanta classification of acute pancreatitis. Polskie Archiwum Medycyny Wewnęrznej 2013; 123: 118-124.
3. Thoeni RF: The revised Atlanta classification of acute pancreatitis: its importance for the radiologist and its effect on treatment. Radiology 2012; 262: 751-747.
4. Balthazar EJ, Krinsky G: Role of imaging methods in acute pancreatitis: diagnosis, staging, and detection of complications. [W:] Dominiguez-Munoz JE, Malfertheiner P: Clinical Pancreatology for Practising Gastroenterologists and Surgeons. 1st ed., Blackwell Publishing, Massachusetts 2005; 56-80.
5. Balthazar EJ: Acute pancreatitis: assessment of severity with clinical and CT evaluation. Radiology 2002; 223: 603-613.
6. Mortele KJ, Wiesner W, Intriere L et al.: A modified CT Severity Index for evaluating Acute Pancreatitis: improved correlation with patient outcome. AJR 2004; 183: 1261-1265.
7. Delure LJ, De Waele JJ, Duyck PO: Acute pancreatitis: radiologic scores in predicting severity and outcome. Abdom Imaging 2010; 35: 349-361.
8. Uhl W, Warshaw AL, Imrie C et al.: IAP Guidelines for the surgical management of acute pancreatitis. Pancreatology 2002; 2: 565-573.
9. Bollen TL, van Santvoort, HC, Besselink MG et al.: The Atlanta Classification of acute pancreatitis revisited. Br J Surg 2008; 95: 6-21.
10. Gabrylewicz A, Wereszczyńska-Siemiątkowska U: Ostre zapalenie trzustki. [W:] Konturek SJ: Gastroenterologia i hepatologia kliniczna. 5 wyd., PZWL, Warszawa 2006; 559-573.
11. Mortelè KJ, Mergo PJ, Taylor HM at al.: Peripancreatic vascular abnormalities complicating acute pancreatitis: contrast-enhanced helical CT findings. EJR 2004; 52: 67-72.
12. De Waele J, Delure L, Hoste E et al.: Extrapancreatic inflammation on abdominal computed tomography as an early predictor of disease severity in acute pancreatitis – Evaluation of a new scoring system. Pancreas 2007; 34: 185-190.


